حمض أميني
الأحماض الأمينية[1][2][3] هي لبنات البناء الرئيسية لبناء البروتين والببتيد، فالأحماض الأمينية هي مجموعة من المركبات العضوية متكونة من مجموعة أمين (–NH2) على الأقل مشتبكة مع مجموعة كربوكسيل (–COOH). ينتج التمثيل الغذائي في جسم الإنسان عددًا كبيرًا من الاحماض الأمينية المختلفة - وجميعها يتبع التقسيم المذكور أعلاه من جهة تكوينها من طرف أميني وطرف كربوكسيلي، ولكن توجد 9 أحماض أمينية لا يستطيع جسم الإنسان تصنيعها ولابد من أن يتناولها الشخص من غذائه؛ وتسمّى تلك الأحماض الأمينية الأساسية التسعة الأحماض الأمينية الضرورية.
حمض أميني |
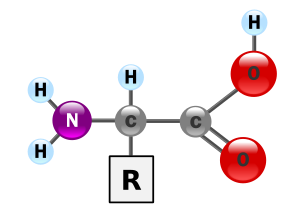
لكي يقوم الجسم بإنتاج ما يحتاجه من أحماض أمينية فهو يقوم بهضم الغذاء - وهنا على الأخص هضم البروتينات - فيحلل البروتين إلى أجزائه الصغرى وهي أحماض أمينية. عشرة أحماض أمينية أساسية مهمة جدا (لا يمكن للجسم البشري أن يصنعها بنفسه) والباقي غير أساسية (يمكن الجسم صنعها داخل الجسم البشري، بشرط التغذية السليمة). على الرغم من قدرة الجسم على تصنيع الأحماض الأمينية غير الأساسية، إلا أنه يحتاج الأحماض الأمينية الضرورية لكي يكون سليما معافيا. توجد ال 9 أحماض أمينية الضرورية في العديد من المواد الغذائية: في اللحوم والأسماك والبيض والحليب والبقوليات. وعادة لا يحدث خلل في الناس لأن غذاء الأنسان متنوع ويحمل في مجموعه الأحماض الأمينية الضرورية، وهي متنوعة وفي المتناول. كما يمكن الحصول على الأحماض الأمينية الضرورية إذا تم اتباع نظام نباتي كامل بشكل مناسب.[4]
تُرقم ذرات الكربون عادة بالأحرف الإغريقية، وتنتمي الحموض الأمينية المكونة للبروتينات إلى فئة ألفا α-Amino Acids وذلك لأن جذري الأمين والهيدروكسيل يرتبطان بذرة الكربون الأولى في السلسلة. وتوجد كذلك حموض أمينية أحيائية من فئة بيتا مثل البيتا-ألانين (بالإنجليزية: β-Alanine) وأخرى من فئة غاما مثل حمض الغاما-أمينوبيوتيريك (بالإنجليزية: γ-Aminobutyric acid) أو (بالإنجليزية: GABA). ورغم وجود عدد كبير من الحموض الألفا-الأمينية في الطبيعة إلا أن السلاسل البروتينية لا تحتوي سوى 20 نوعاً منها فقط. وتضطلع الحموض الأمينية بمهام أخرى كلعبها دور نواقل عصبية ومواد أولية لبعض الهرمونات، كما تتكون جزيئات المناعة منها أو كمصدر للطاقة في حالات قصوى. وتتوفر أيضا مجموعة من الحموض الأمينية المصطنعة كيميائيا ولها عدة استعمالات في مجال الصناعة الكيميائية والصيدلية والغذائية. إذا تنوع غذاء الإنسان من لحوم واسماك وبيض وحليب وخضروات وفاكهة يضمن حصوله على كل المواد الغذائية الضرورية لجسمه وسلامة صحته.
الأحماض الأمينية تركب الجينات
الأحماض الأمينية هي اللبنة الصغرى لتكوين بروتين. إضافة إلى بناء الخلايا والخلايا العضلية وإصلاح الأنسجة تشكل الأحماض الأمينية مادة البناء الأساسية للأجسام المضادة في نظام المناعة لمكافحة غزو البكتريا والفيروسات؛ كما تشكل جزءاً أساسياً في تصنيع الإنزيمات والهرمونات في جسم الإنسان؛ وهي تبني البروتينات النووية RNA (الحَمْضُ النَّوَوِيِّ الرايبوزي) والدنا (الحَمْضُ الرايبوزي النَّوَوِي المَنْزُوع الأوكسِجين) وهي الحاملة للشفرة الجينية الوراثية. كما تقوم الأحماض الأمينية بحمل الأكسجين في الهيموجلوبين في كرات الدم الحمراء وتوزعه في أعضاء الجسم المختلفة عن طريق الدورة الدموية، والأحماض الأمينية هي المكون الأساسي للعضلات وبروتينات الجسم. يتكون جسم الإنسان البالغ من نحو 16 كيلوجرام من البروتينات.
نظريا يوجد 64 نوع من الأحماض الأمينية، فالـ دي أن إيه يُبنى أساسا من 4 قواعد نتروجينية، يرمز لها بالحروف: A، C، G، T . وتبنى الأحماض الأمينية عادة بتركيب عدة قواعد نتروجينية، مثل GCA, GCC, GCG؛ كل منها يسمى كودون. لكن المتوفر في أجسام الكائنات الحية أقل من ذلك - ما بين 20 إلى 26 نوع من الأحماض الأمينية. مع ملاحظة أن الكثير من الأحماض الأمينية (الكودونات) يتشكل بأكثر من ثلاث قواعد نتروجينية وقد تصل إلى 6، والبعض منها مكون فقط من كودون واحد.
الحمض الأميني هو أحد مركبات عضوية تحمل نوعين من الجذور الكيميائية، وهي طرف قاعدي أميني (نشادري) [5] وطرف حمضي كربوكسيل متحدتين مع ذرة كربون مرتبطة بدورها ببقية عضوية جانبية Side chain تكون مختلفة من حمض أميني إلى آخر. تُعتبر الأحماض الأمينية وحدات التركيب الأساسي للبروتينات في الكائنات الحية، فهي تكون العضلات والأنسجة والأعضاء والجلد، وتدخل في تركيب الهرمونات والإنزيمات، وكذلك في تركيب خلايا المناعة.
للتذكرة بالقواعد النتروجينية:
البنية الكيميائية العامة
يعتبر هيدروكسي كرب أميد (بالإنجليزية: Hydroxycarbamide) الحمض الأميني الأبسط من حيث التركيب فهو متكون من جذر أميني متصل مباشرة بكربون جذر الهيدروكسيل COOH- . وهذا المركب غير أحيائي. أما في بقية الأحماض الأمينية فتدخل ذرة أو أكثر من الكربون بين هذين الجذرين. ويحدد موقع الأمين في السلسلة الكربونية الفئة (أحمر: ألفا، بيتا، جاما) التي ينتمي إليها الحمض الأميني كما يلي:
- حموض ألفا-أمينية، حيث يتصل جذر الأمين بالكربون رقم 2 بعد كربون جذر الهيدروكسيل ويرقم بألفا . يسمى المركب بالحمض 2-أمينوإيثانويك Aminoethanoic acid، أو ما يعرف بالجلايسين Glycine، أبسط الحموض الأمينية لدى الكائنات الحية. أما بقية الأحماض الألفا-أمينية فلها نفس البنية مع اختلاف في السلسلة الجانبية ، فعوضا عن ذرة الهيدروجين المرتبطة بالكربون ألفا في الجلايسين، تتخذ أنواع مختلفة، على سبيل المثال، جذر الميثيل Methyl في حالة الألانين Alanine أو جذر مختلف الحلقة Heterocyclic بالنسبة للتريبتوفان Tryptophan. والدور الأساسي للأحماض الألفا-أمينية هو بناء مختلف البروتينات.
- حموض بيتا-أمينية، يرتبط جذر الأمين بالكربون الثالث بداية من كربون جذر الهيدروكسيل ، وأبسط ممثل أحيائي لهذه الفئة هو البيتا-ألانين، يتأتي من تحلل الكارنوسين Carnosine، ويلعب دور ناقل عصبي مثبط للغليسين.
- حموض غاما-أمينية، يتحد جذر الأمين بالكربون الرابع بعد كربون جذر الهيدروكسيل ، المثال المعروف في هذه الفئة هو حامض الغاما-بيتيريك GABA، وهو كذلك ناقل عصبي مثبط.
التماثلية البصرية (التناظر)
لدى جميع الأحماض الألفا-أمينية، باستثناء الجلايسين، يكون الكربون-ألفا مرتبطاً بجذور مختلفة ومجموعة جانبية مميزة لذا نقول أنه كايرالي Chiral أو مركز ناشط بصريا. ونتيجة لهذه الخاصية، فان كل حمض ألفا-أميني متواجد في الطبيعة على شكل نظيرتين بصريتين Stereoisomers، يمينية Dextrogyre ويرمز لها، في الكيمياء الحيوية، بـ ، أو يسارية Levogyre ويرمز لها بـ . ومعنى ذلك فيزيائيا أنها تقوم بازاحة الضوء المستقطب بزاوية معينة اما باتجاه عقارب الساعة بنسبة للنظير ، وهو الاتجاه الموجب (+)، أو ضد اتجاه عقارب الساعة بنسبة للنظير ، وهو الاتجاه السالب (-). وبالنسبة لنظام التسمية R / S، الأكثر استعمالاً في الكيمياء العضوية، فان نفس المبدأ يتبع حسب قاعدة "كان إنجولد بريلوج" فــ == R و == S.
ولا تنطبـق هـذه القـاعدة الا على السيستيـن (بالإنجليزية: Cysteine) لأن الجذر الكبريتي ليسـت له الأولوية في هذه الحالــة. اذن فالـ -سيستين هو الـ S -سيستين، والـ -سيستين هو الـ R -سيستين.[6]
و في المثال الموجود على النموذج المقابل، نجد الـ -ألانين وكأنه صورة عبر المرآة لالـ -ألانين، وهما مركبان لا يمكن مطابقتهما non-superimposable، تماماً كما لا يمكن مطابقة كف اليد اليمنى مع ظهر اليد اليسرى صورة. ولسبب لا يزال محيرا، فان غالبية الأحماض الألفا-أمينية المكونة للبروتينات هي من النظيرة وليست . ولكن يمكن أن نجد بعض الـ -أحماض أمينية في أنواع مـن الصدفيات[7] مثل عائلة الكونيدات Conidae، وفي الغشاء البيبتدوسكري Peptidoglycan لبعض البكتيريا.[8]
تصنيف الأحماض الأمينية
تقسم الأحماض الألفا-أمينية العشرون الموجودة في البروتينات، والمشفرة في الشفرة الوراثية، إلى مجموعات حسب عدد من الخصائص الفيزيائية والكيميائية والأحيائية:
- الطبيعة الكيميائيـة للسلسلة الجانبيـة : بما أن المجموعة الجانبية هي التي تحدد هوية الحمض الأميني، يمكن إذن تقسيم الأحماض الأمينية إلى ذات سلسلة هيدروكاربونية، اما أليفاتية Aliphatic أو أروماتية Aromatic أو مختلفة الحلقة Heterocyclic.
- القطبيـة الكهربائيـة : تقسم الأحماض الأمينية حسب قطبيتها الكهربائية، وذلك حسب حالة التأين، إلى قطبية Polar (سالبة أو موجبة الشحنة) أو غير قطبية Nonpolar (عديمة الشحنة). تحدد هذه الخاصية المهمة قابلية الأحماض الأمينية للانحلال في الماء (وهي عبارة عن محلول قطبي للماء)، فتكون الأحماض الأمينية ذات المجموعات الجانبية القطبية متجاذبة مع الماء Hydrophilic، وهي عادة ما تكون على الجزء الخارجي للبروتينات. بينما الأحماض الأمينية ذات السلاسل الجانبية غير القطبية، وغير المتجاذبة مع الماء Hydrophobic، تميل إلى التجمع للداخل.
- القاعديـة\الحمضيـة : السلسلة الجانبية من الممكن أن تكون قاعدية، مثل حمض الليسين Lysine أو الأرجنين Arginine وهو شديد القاعدية، أو حمضية، مثل الجلوتميت Glutamic acid والأسبارتيت Aspartic acid، أو متعادلة مثل الجليسين والليوسين Leucine. وعادة ما تكون الأحماض الأمينية ذات المجاميع الجانبية القاعدية والحمضية قطبية جداً وهي توجد بصورة كبيرة على سطح البروتينات المماس للماء.
- يمكن أيضاً أن نقسم الأحماض الأمينية حسب أهميتها الغذائية وتوفرها الأحيائي إلى:
- أحماض أمينية ضرورية Essential لا يصنعها الجسم، ويجب تناولها في الغذاء. مثال، الليوسين والليسين.
- أحماض أمينية شبه أساسية Semi-essential يستطيع الجسم تخليقها ولكن ليس بكميات كافية، خاصة في مرحلة النمو؛ ويحبذ أن تتوفر في الغذاء. مثال: الأرجنين والهستيدين Histidine.
- أحماض أمينية غير أساسية Nonessential متوفرة في الجسم السليم بكميات دائمة، ويمكن للجسم تصنيعها، ولا تستلزم حضورها في الغذاء. مثال، الجليسين والبرولين Proline.
قــائمة تصنيف الأحمــاض الألفا-الأمينيـة المكونة للبروتينات[9]
أنظر إلى المقال المفصل التالي قائمة الأحماض الأمينية
| الحمض الأميني | الرمـز (ثلاثة حروف) | الرمـز (حرف واحد) | الكتلة الذرية (غ \ مول) | قطبية السلسلة الجانبية | حمضية أو قاعدية السلسلة الجانبية | الأهمية الغذائية |
|---|---|---|---|---|---|---|
| ألانين Alanine |
Ala |
A |
89,1 |
غير قطبي |
متعـادل |
غير أساسي |
| أرجنين Arginine |
Arg |
R |
174,20 |
قطبي |
قاعـدي (قوي) |
شبه-أساسي |
| أسباراجين Asparagin |
Asn |
N |
132,12 |
قطبي |
متعـادل |
غير أساسي |
| حمض الأسبارتيك Aspartic acid |
Asp |
D |
133,10 |
قطبي |
حمضـي |
غير أساسي |
| سيستين Cysteine |
Cys |
C (م) |
121,16 |
قطبي |
متعـادل |
غير أساسي (م م) |
| جلوتامين Glutamin |
Gln |
Q |
146,15 |
قطبي |
متعـادل |
غير أساسي |
| جلوتاميت Glutamic acid |
Glu |
E |
147,13 |
قطبي |
حمضـي |
غير أساسي |
| جلايسين Glycine |
Gly |
G |
75,07 |
غير قطبي |
متعـادل |
غير أساسي |
| هستيدين Histidine |
His |
H |
155,16 |
قطبي |
قاعـدي (ضعيف) |
شبه-أساسي |
| آيزوليوسين Isoleucine |
Ile |
I |
131,17 |
غير قطبي |
متعـادل |
أساسـي |
| ليوسين Leucine |
Leu |
L |
131,17 |
غير قطبي |
متعـادل |
أساسـي |
| لايسين Lysine |
Lys |
K |
146,19 |
قطبي |
قاعـدي |
أساسـي |
| مثيونين Methionine |
Met |
M |
149,21 |
غير قطبي |
متعـادل |
أساسـي |
| فينيل ألانين Phenylalanine |
Phe |
F |
165,19 |
غير قطبي |
متعـادل |
أساسـي |
| برولين Proline |
Pro |
P |
115,13 |
غير قطبي |
متعـادل |
غير أساسي |
| سيرين Serine |
Ser |
S |
105,09 |
قطبي |
متعـادل |
غير أساسي |
| ثريونين Threonine |
Thr |
T |
119,12 |
قطبي |
متعـادل |
أساسـي |
| تربتوفان Tryptophan |
Trp |
W |
204,23 |
غير قطبي |
متعـادل |
أساسـي |
| تيروسين Tyrosin |
Tyr |
Y |
181,19 |
قطبي |
متعـادل |
غير أساسي (م م) |
| فالين Valine |
Val |
V |
117,15 |
غير قطبي |
متعـادل |
أساسـي |
- (م) رمز السيستين C يمكن أن يكتب أيضا S-HC، إذا كان الجذر الكبريتي (-HS) حرا أو S-SC، إذا كان هذا الجذر مرتبطاً بجذر كبريتي لسيستين أخرى في السلسلة البيبتيدية. وتختلف الخاصيات أيضاً في هذه الحالة، فالسيستين المرتبطة تصير غير قطبية.
(م م) هذه الأحماض الأمينية تصير أساسية في مراحل النمو الأولى وعند الأطفال.
الخواص الكيميائية العامة
تكون الرابط البيبتيدي
الرابط البيبتيدي: وهي الروابط التي تتشكل بين جزيئتين عندما تتفاعل مجموعة الكربوكسيل للجزيئة الأولى مع مجموعة الأمينو للجزيئة الثانية محررة جزيئة الماء (H2O) ويدعى هذا التفاعل بالتآلف الجاف وكذلك يسمى (تفاعل التكثيف) ويحدث بين الأحماض الأمينية. إن الآصرة الناتجة من هذا التفاعل وهي CO-NH تسمى الصرة البيبتيدية وتدعى الجزيئة الناتجة بالأميد، وألاميدات مركبات عضوية تحتوي مجموعة وظيفية تدعى الاميد وهي عبارة عن زمرة كربونيل متصلة بزمرة أمين.
التفاعلات الكيميائية
1- الخواص الأيونية للحوامض الامينية: بالنظر لاحتواء الحوامض الامينية على مجموعتين الأمين والكاربوكسيل لذا فأنها تعتبر ثنائية القطب أي تعمل كحامض أو كقاعدة وتسمى امفوتيرية أي تفقد وتكتسب بروتون لذلك تكون على صورة ما يسمى بالأيون المزدوج وهو أيون ناتج عن منح مجموعة الكربوكسيل بروتونها لمجموعة الأمين لهذا فانها إذا وضعت في محاليل حامضية قوية PH = 1 تتقبل بروتون وتشحن (+) وإذا وضعت في محاليل قاعدية قوية تفقد بروتون وتنشحن (-) اما في نقطة التعادل الكهربائي (Pl-) هي النقطة التي تتساوى فيها عدد (+) مع (-) وتكون PH معينة لكل حامض أميني كالاتي: أ- الحوامض الأمينية المتعادلة:- محصلة الشحنة = صفر P1=PH= (5-6.3)
ب- القاعدية:
محصلة الشحنة == صفر P1 = PH == (7.6-10.8)
ج- الحامضية:
محصلة الشحنة == صفر P1 = PH == (2.97-3.2)
2- نزع الكربوكسيل تجرد الحامض الاميني من مجموعة الكاربوكسيل Decarboxylation عند تجريد المجموعة الكاربوكسيلية من الحوامض الأمينية فأنها تتحول إلى الأمينات الأولية وذلك بمساعدة الأنزيمات من نوع Decarboxylation
3- نزع الأمين تجريد المجموعة الأمينية (بالإنجليزية: Deamination) عند تجريد الحوامض الأمينية من مجموعة الأمين تتحول إلى حوامض كاربوكسيلية وأمونيا والحوامض الكاربوكسيلية تتمثل في الجسم إلى مركبات تستفيد منها الخلية أما الامونيا فأنها تطرح في البول على شكل يوريا بواسطة دورة تسمى بدورة اليوريا والتي تحدث في الكبد وذلك بتخليص الجسم من النتروجين أو من الامونيا السامة
4 - نقل الأمين تفاعل نقل مجموعة الأمين (بالإنجليزية: Transmination) ويتم في هذا التفاعل انتزاع مجموعة الامين بواسطة الاكسدة ونقلها من مركب إلى أخر من المركبات المتفاعلة، يتم هذا التفاعل بمساعدة انزيمات (Transminase) حيث تتحول الحوامض الأمينية إلى حوامض كيتونية والتي بدروها تتحول إلى مشتقات كاربوهيدراتية تستفيد منها الخلية
5- نترزة التفاعل مع حامض النتروز يستعمل هذا التفاعل لغرض قياس كمية الحامض الاميني في محلول معين حيث يتفاعل حامض النتروز مع الحامض الاميني محرراً النتروجين الذي يكمل جمعه وحساب حجمه يمكن تصنيف كمية الحامض الاميني
6- التفاعل: (بالإنجليزية: Nihydrin) Nihydrin: مادة مؤكسدة قوية تتفاعل مع الحوامض الأمينية لتعطي مركب أزرق اللون يعتمد هذا التفاعل على وجود مجموعتي الأمين والكاربوكسيل بشكل حر وهذا التفاعل يكون حساساً للكشف عن مركبات قليلة من الحوامض الامينية
7- تفاعل سانكر (بالإنجليزية: Sanger)) يستعمل هذا التفاعل لتشخيص الحامض الأميني الموجود في بداية السلسلة الببتيدية (النهاية النتروجينية) يستعمل كاشف (D.VFB) 2,4- Dinitre fluro Benzen حيث يتفاعل هذا المركب مع الحامض الأميني الأول في النهاية النتروجينية من السلسلة الببتيدية مكونا مركب أصفر اللون حيث يشخص الحامض الأميني المرتبط به بواسطة Chromatogralply في هذا التفاعل تتحرر الأحماض الامينية من السلسلة الببتيدية بشكل حر ويعتبر هذا التفاعل مدمراً للسلسلة الببتيدية وذلك بتحرير الحوامض الأمينية بشكل حر.
8- تفاعل إيدمان (بالإنجليزية: Edman reaction) يستعمل هذا التفاعل لمعرفة تتابع (Sequence) في السلسلة الببتيدية ويعتبر هذا التفاعل مهماً لأنه يحطم السلسلة الببتيدية ويمكن تكراره مع السلسلة الناتجة لحد عشرين حامض أميني أو أكثر يستعمل في هذا التفاعل الكاشف Phenyl iso thioCyngtac.
الخواص العامة للأحماض الأمينية
كاربونات ثنائية القطب الحوامض الأمينية مركبات مشابهة للأملاح مثل الأملاح كلها مركبات صلبة ذات درجة انصهار عالية لدرجة انها تحترق بصورة عامة قبل تحولها إلى الحالة المنصهرة انها مركبات غير ذائبة في المذيبات الغير المستقطبة وتذوب في الماء.
امتصاص واستخدامات الأحماض الأمينية
تنتقل الحوامض الأمينية، وهي النواتج النهائية لهضم البروتين تنتقل بسرعة من خلال جدران الأمعاء الدقيقة كما تمتص أيضا الببتيدات البسيطة وصغيرة جداً. تستعمل الحوامض الأمينية المنفردة في واحدة من الطرق الاتية: 1- لتصنيع نسيج بروتيني جديد، أو لترميم نسيج قديم أو للإحلال محل بروتينات سوائل الجسم المتحطمة. 2- لتصنيع مركبات غير بروتينية تحتوي على نتروجين مثل الحوامض النووية الهيم (heme) أو الكريانين (Creatine) 3- لتوفير الطاقة الكيميائية والتعرض للهدم. إذ قد تدخل المركبات الوسيطة الناتجة من هدم الحوامض الامينية في دورة حامض النتريك أو يمكن استعمالها لتصنيع الكلوكوز الحوامض الشحمية التي يمكن خزنها في النسيج الدهني. اما المركبات الرئيسية الناتجة عن الهدم الكامل للحوامض الامينية فما هي الا ثنائي اوكسيد الكاربون والماء واليوريا.
مصادر الأحماض الأمينية
إن وجود الأحماض الأمينية في الجسم يأتي من مصدرين هما:
1- الجزء الأكبر من الأحماض الأمينية يتناوله المرء من الغذاء: اللحوم والاسماك والبيض ومنتجات الألبان والحليب والجبن، والبقوليات، مثل الفول والعدس والفاصوليا والبازلاء وفول الصويا والحمص ولوبيا. تنويع الغذاء أحسن ضمان للحصول عليها جميعا، لأنها تدخل في تركيبات بروتينات الجسم (مثل العضلات وأنسجة الأعضاء)، وكذلك في تركيبات الهرمونات والإنزيمات، علاوة على ذلك تدخل في تركيب الخلايا المناعية.
2-من تعويض بروتينات الجسم بغدة endogrnous من خلال الجوع وسوء التغذية.
1) الهدمي Catabolic و
2)البنائي Anabolic
المراجع
- ^ Q115858366، ص. 822، QID:Q115858366
- ^ Q118929929، ص. 32، QID:Q118929929
- ^ Q114972534، ص. 21، QID:Q114972534
- ^ "Plant foods have a complete amino acid composition". مؤرشف من الأصل في 2020-08-24.
- ^ باستثناء وحيد وهو البرولين لأن جذره الأميني يرتبط ببقية (كيمياء) في شكل حلقة.
- ^ ينبغي عدم الخلط بين وهي المجموعة الجانبية وR وهو تسمية للنظيرة البصرية اليمينية.
- ^ Pisarewicz K, Mora D, Pflueger F, Fields G, Marí F (2005). "Polypeptide chains containing D-gamma-hydroxyvaline". J Am Chem Soc. ج. 127 ع. 17: 6207–15. PMID:15853325.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ van Heijenoort J (2001). "Formation of the glycan chains in the synthesis of bacterial peptidoglycan". Glycobiology. ج. 11 ع. 3: 25R–36R. PMID:11320055. مؤرشف من الأصل في 2009-07-01.
- ^ Nelson، David L. (2000). Lehninger Principles of Biochemistry (ط. 3rd ed). Worth Publishers. ISBN:1-57259-153-6.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة) والوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)
المصادر
- المظفر، سامي عبد المهدي، رياض رشيد سلمان «الكيمياء الحياتية (دار الكتب الطباعة – النشر» جامعة بغداد، كلية التربية 1984
- Roger, L; DeKock, Harry, B. gray "chemical structure and bonding" 1980 ترجمة: زكوم، مهدي ناجي، جماعة البصرة (1983).
- مقدمات في كيمياء الحياة، ترجمة الدكتور أحمد سلمان الجنابي.
- أسس الكيمياء العامة والعضوية والحياتية/ تأليف. جون ر.هرار ترجمة الدكتور عبد ناجي
- هربت ما يسليش/ تاليف هوارد بنجامكين/ جاكوب شارفكين
- هابر «الكيمياء الحيوية» ترجمة وأشراف أ.د. رويدة أبو سمرة د. نزار حمود / د. عماد أبو علي .
انظر أيضاً
- قاعدة الطرف الأميني
- أيض البروتينات
- إشارة تصدير نووي
- بروتين اندماجي
- نطاق بروتين
- طرف كربوكسيلي
- طرف أميني
- شفرة جينية
- ببيد
- بوابة أيض
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة صيدلة
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
| في كومنز صور وملفات عن: حمض أميني |