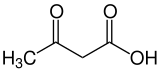
أجسام كيتونية
الأجسام الكيتونية (بالإنجليزية: Ketone bodies) هي ثلاثة جزيئات قابلة للذوبان في الماء (وهي: أسيتو الأسيتات وبيتا هيدروكسي بيوتيرات وناتج التفكك التلقائي لهما وهو الأسيتون) والتي تصنع بواسطة الكبد من الأحماض الدهنية.[1] خلال الفترات التي يكون فيها تناول الطعام منخفضا مثل الصيام وحميات تخفيض أكل الكربوهيدرات أو حدوث مجاعة أو ممارسة التمارين الرياضية المكثفة والمطولة[2] والمصابون بمرض السكري نوع 1 الغير معالج أو المعالج بشكل غير كافي. تلك الأجسام الكيتونية يتم التقاطها بشكل سريع من قبل أنسجة خارج الكبد بسبب انخفاض نسبة السكر في الدم وتُحوّل إلى أسيتيل مرافق الإنزيم-أ acetyl-CoA ومن ثم تدخل في دورة حمض الستريك وتؤكسد في الميتوكوندريا الموجودة في خلايا الجسم لكي تتحول إلى طاقة يحتاجها الجسم وأعضائه للقيام بوظائفها.[3] في الدماغ، تستعمل في صنع أسيتيل مرافق الإنزيم-أ إلى أحماض دهنية طويلة السلسلة والأخيرة لا يمكن الحصول عليها من الدم، لأنها غير قادرة على النفاذ من خلال الحاجز الدموي الدماغي. بهذه الطريقة يمكن للدماغ خلال وقت قصير في حالة نقص السكر في الدم استخدام 40 غرام من الجلوكوز (السكر) بدلا من 120 غرام جلوكوز في اليوم، أي ينتج معظم طاقته من الأجسام الكيتونية عوضا عن الجلوكوز.
الأجسام الكيتونية يتم صنعها من قبل الكبد تحت تأثير الظروف المذكورة أعلاه المتسببة في نقص السكر في الدم (الصيام والمجاعة وحميات قليلة الكاربوهيدرات والتمارين الرياضية المكثفة والسكري نوع 1 الغير معالج) نتيجة لدورة تخليق جلوكوز شديدة: وهي عملية صنع جلوكوز من مصادر غير كربوهيدراتية (لا تشتمل على أحماض دهنية).[1] ولهذا دائما ما تنطلق الأجسام الكيتونية إلى الدم بواسطة الكبد بالتزامن مع إفراز الجلوكوز حديث الصنع، بعدما تنضب مخازن الجلايكوجين الخاصة بالكبد (مخازن الكلايكوجين تنضب بعد 24 ساعة من الصيام).[1]
عندما يفقد جزيئان من اسيتايل كواي مرافق الانزيم أ الخاص بهما، يمكنهما صنع مركب كيميائي ثنائي الوحدات يسمى اسيتواستيت. بيتا هايدروكسي بيوتاريت هو الناتج من اختزال اسيتواستيت، حيث أن مجموعة الكيتون تحول إلى مجموعة كحول. كلاهما جزيئات رباعية الكربون لهذا تستطيع بشكل سريع أن تعود مرة أخرى إلى اسيتايل كواي بواسطة أغلب أنسجة الجسم مع الاستثناء للكبد طبعا. الأسيتون هو الجزيء منزوع الكاربوكسيل من اسيتواستيت، والذي لا يستطيع أن يحول مرة أخرى أو يعود إلى أسيتيل مرافق الإنزيم-أ ماعدا عن طريق عملية إزالة السموم في الكبد حيث أنه يحول إلى حامض اللبنيك والذي يستطيع بالمقابل أن يؤكسد إلى حامض البيروفيك، وعندها فقط إلى اسيتايل كواي.
الأجسام الكيتونية لها خاصية الرائحة المميزة، حيث يمكن كشفها من خلال رائحة النفس الخاصة بالأفراد المصابين بالحماض الكيتوني أو فرط كيتون الجسم، (التي عادة ما تشبه رائحة مزيل أصباغ الأظافر التي عادة ما تحتوي على أسيتون أو أثيل استيت).
بعيدا عن الأجسام الكيتونية الثلاثة (أسيتون وأسيتو استيت وبيتا هايدروكسيبيوتاريت)[4]، أجسام كيتونية أخرى مثل بيتا كيتوبينتانوت وبيتا هايدروكسيبينتانوت قد تصنع نتيجة لعملية التمثيل الغذاني للدهون الثلاثية الاصطناعية مثل هيباتنون الثلاثي.
الإنتاج
الدهون المخزونة في النسيج الدهني تطلق من الخلايا الدهنية إلى الدم بشكل أحماض دهنية حرة وجليسيرول عندما يكون مستوى الأنسولين منخفضا في الدم ومستويات الغلوكاغون والابنفرين في الدم عالية. هذا يحدث بين الوجبات وخلال الصيام والمجاعة والتمارين الرياضية المكثفة، في حالة كون مستويات الجلوكوز في الدم مرجح أن تنخفض).
الأحماض الدهنية هي مصادر طاقة عالية (حرارة الجسم، وطاقة لقيام أعضاء الجسم بوظائفها)، وتؤخذ من قبل كل الخلايا المؤيضة التي تحتوي على ميتوكوندريا، وهذا لأن الأحماض الدهنية لا تؤيض إلا في داخل المايتوكوندريا.[1][5] خلايا الدم الحمراء لا تحتوي على ميتوكوندريا لهذا تعتمد بشكل كامل على عملية التحلل السكري (تخمر الجلوكوز إلى حامض اللبنيك) من أجل متطلبات الطاقة الخاصة بها. في كل الانسجة الأخرى، الأحماض الدهنية التي تدخل إلى الخلايا المؤيضة سوف تجمع مع مرافق الانزيم أ لتكوين سلاسل أسيتيل مرافق الإنزيم-أ. وهذه تنقل إلى الميتوكوندريا الخاصة بالخلايا (حيث سيتم تكسيرهاالى وحدات من الاستايل كواي عن طريق سلسلة من التفاعلات المعروفة بـ أكسدة الأحماض الدهنية (بالإنكليزية: B Oxidation)[1][5] استايل كواي المنتج من عملية أكسدة الأحماض الدهنية تدخل إلى دورة حمض الستريك في الميتوكوندريا عن طريق أن تجمع مع اوكزالواستيت لتنتج الستريت (بالإنكليزية: citrate). وهذا يؤدي إلى الاحتراق الكامل لمجموعة الاستيل الخاصة بـ استيايل كواي إلى ماء وثنائي أوكسيد الكاربون. الطاقة الناتجة عن هذه العملية يتم التقاطها على شكل 1GTP و11جزيئة من الـ ATP لمجموعة الاستيل الواحدة المؤكسدة.[1][5] هذا هو مصير استيايل كواي حيثما حصلت عملية أكسدة الأحماض الدهنية ماعدا تحت ظروف معينة في الكيد. حيث أن الاوكزالواستيت في الكبد يقوم بشكل جزئي أو كامل بتحويل مساره إلى مسار عملية استحداث السكر خلال الصيام والمجاعة وحميات التقييد من الكاربوهيدرات والتمارين الرياضية المطولة والمكثفة وأيضا لدى المصابين بالسكري النمط الأول من دون علاج. تحت هذه الظروف اوكزالواستيت يتم هدرجته إلى حمض التفاح (malate) والذي يتم بعد ذلك إزالته من المايتوكوندريا حتى يتم تحويله إلى جلوكوز في سايتوبلازم خلايا الكبد، ومن حيث يتم إطلاق سراحه إلى الدم.[1] في الكبد لهذا اوكزالو استيت يكون غير متوفر للتكاثف مع استيايل كواي عند حصول تحفيز كبير لعملية استحداث السكر، وهذا التحفيز يكون نتيجة لتراكيز الانسولين المنخفض أو غلوجاغون العالي في الدم. تحت هذه الظروف يقوم استيايل كواي بنحويل مساره إلى صنع اسيتواستيت وبيتاهايدروكسي بيوتاريت.[1] اسيتواستيت، بيتاهايدروكسي بيوتاريت وناتج التكسر العشوائي لهما المعروف بـ اسيتون،[6] معروفين في كثير من الأحيان وبشكل مربك بالأجسام الكيتونية (برغم انهم ليسوا أجسام في الواقع بل جزيئات قابلة للذوبان في الماء). الاجسام الكيتونية تطلق بواسطة الكبد إلى الدم. جميع الخلايا في الجسد التي تحتوي على مايتوكوندريا تستطيع التقاط الأجسام الكيتونية من الدم وتعيد تحويلها إلى استيايل كواي، وبهذا تستعملها كمصدر وقود في دورات حامض الستريك، ولا يوجد نسيج آخر يستطيع تحويل مسار اوكزالواستيت إلى مسار عملية استحداث السكر كما يستطيع الكبد تحويلها. بخلاف الأحماض الدهنية الحرة، الأجسام الكيتونية تستطيع عبور الحاجز الدموي الدماغي وبهذا تكون متاحة كمصدر وقود لخلايا الجهاز العصبي المركزي، لتعمل كبديل للجلوكوز، الذي عليه عادة تعتمد الخلايا في النجاة.[1] حدوث ارتفاع في مستويات الأجسام الكيتونية في الدم خلال المجاعة أو حميات التقييد من الكاربوهيدرات أو التمارين الرياضية المكثفة والمطولة أو في السكري النمط الأول الغير معالج يسمى بفرط الجسم الكيتوني. وفي الحالات التي يكون مستوياتها عالية بشكل متطرف في مرض السكري النمط الأول تسمى بالحماض السكري اسيتو استيت يكون له خاصية الرائحة المميزة والتي تحصل في نفس المريض أو في البول خلال حالة فرط كيتون الجسم. [7]
استعمالات الأجسام الكيتونية في القلب والعضلات والدماغ (ولكن ليس الكبد)
الأجسام الكيتونية يمكن تستعملها خلايا الجسم لإنتاج الطاقة التي تحتاجها. الأجسام الكيتونية يتم نقلها من الكبد إلى الأنسجة الأخرى، حيث اسيتواستيت وبيتاهايدروكسيبيوتاريت يمكن إعادة تحويلها إلى استيايل كواي لكي تينتج طاقة من خلال دورة حمض الستريك. الاجسامالكيتونية لا يمكن استعمالها من قبل الكبد من اجل الحصول على طاقة، لأن الكبد يفتقر إلى انزيم ثايوبوريز . الاسيتون في مستويات منخفضة يتم أخذه بواسطة الكبد ليدخل بعملية إزالة السموم عن طريق مسار مثيل كلايوكسيل الذي ينتهي كحمض اللبنيك. الاسيتون في تراكيز عالية الذي يتكون بهذه التراكيز نتيجة للصيام المطول أو نتيجة لنظام غذائي مولد للكيتون، هذا الاسيتون يتم امتصاصه من قبل الخلايا عدا تلك الموجودة في الكبد وبعده تدخل في مسار مختلف بواسطة 1,2 بروبانيدول رغم أن المسار يتبع سلسلة مختلفة من الخطوات التي تتطلب ثلاثي فوسفات الادينوسين 1,2 بروبانيدول يمكن أن يتحول إلى حمض البايروفيك.[8]
القلب يقوم بشكل تفضيلي باستخدام الأحماض الدهنية تحت الظروف الفزيولوجية الطبيعة، ومع ذلك تحت ظروف فرط كيتون الجسم يقوم القلب باستخدام الأجسام الكيتونية بشكل فعال من أجل الحصول على الطاقة.[9]
الدماغ أيضا يحصل على جزء من الطاقة الخاصة به من الأجسام الكيتونية عندما يكون الجالكوز متوفر بشكل أقل (خلال الصيام أو المجاعة أو حميات التقييد من الكاربوهيدرات والنظام الغذائي مولد الكيتون وأيضا في التمارين لرياضية الشديدة). في حالة يكون مستوى الجالكوز في الدم منخفض فإن الأنسجة الأخرى في الجسم لها مصادر طاقة إضافية إلى جانب الأجسام الكيتونية (مثل الأحماض الدهنية). ولكن الدماغ على الأرجح له بعض المتطلبات الإجبارية لبعض الجالكوز.[10] بعد أن يتغير النظام الغذائي إلى مستوى جالكوز منخفض لثلاثة أيام، الدمغ يحصل على 25% من طاقته من الأجسام الكيتونية.[11] وبعد تقريبا 4 أيام، ترتفع هذه النسبة إلى 70% [12] (في المراحل الأولية الدم لا يقوم بحرق الاجسام الكيتونية، لكونها ركيزة مهمة لتخليق الدهون في الدماغ)، علاوة على ذلك الأجسام الكيتونية المنتجة من الأحماض الدهنية اوميجا 3 من الممكن أن تقلل تدهور القدرات الإدراكية في المراحل المتقدمة من العمر. [13]
الحماض الكيتوني وفرط كيتون الجسم
في الافراد الطبيعيين، هناك إنتاج ثابت من الأجسام الكيتونية من قبل الكبد واستخدامهم بواسطة الأنسجة خارج الكبد. تركيز الأجسام الكيتونية في الدم تكون قرابة واحد ملي غرام في الديسيلتر الواحد .افراز الاجسام الكيتونية في البول يكون قليل جدا وغير قابل للتمييز بواسطة اختبارات البول الروتينية. عندما يتجاوز معدل صنع الأجسام الكيتونية معدل افرازها، فإن تركيزها في الدم يزداد، وهذا يعرف بتراكم الأجسام الكيتونية في الدم (كيتونيميا) ومن ثم يتبع ببوجود زيادة في كمية الأجسام الكيتونية في البول وتعرف هذا الحالة بـ (كيتونيوريا) وهذين الحالتين مع بعضهما يكونان حالة تعرف بفرط كيتون الجسم. وهذه الحالة تمتاز بوجود رائحة اسيتون في أنفاس المريض. عندما تعاني حالة من مرض السكري نوع 1 من أحداث توتر بايولوجية (التهاب، سكتة قلبية، صدمات جسدية ) أو عندما تفشل في إدارة الأنسولين بشكل كافي من الممكن أن يدخل المريض في حالة الحماض الكيتوني فرط سكر الدم. تحت هذه الظروف انخفاض أو انعدام مستويات الانسولين في الدم، مع تراكيز الغلوكاغون المرتفعة بشكل غير مناسب، [14] يحث الكبد على إنتاج الجالكوز بمعدل مرتفع بشكل غير مناسب، مما يسبب استايل كواي (الناتج من الأحماض الدهنية في دورة الأحماض الدهنية) أن يتحول إلى أجسام كيتونية. المستويات الناتجة المرتفعة جدا من الأجسام الكيتونية تعمل على تخفيض درجة الأس الهايدروجيني الخاص ببلازما الدم والذي يحفز بشكل غريزي أن تقوم الكلى بإفراز بول شديد الحموضة. المعدلات المرتفعة من الجالكوز والأجسام الكيتونية في الدم أيضا تتسرب بشكل سلبي إلى البول (قابلية الأنابيب الكلوية في إعادة امتصاص الجالكوز والأجسام الكيتونية من السائل الأنبوبي، يطغى عليها لهذه القابلية من قبل الحجوم الكبيرة من هذه المواد التي يتم تصفيتها إلى السائل الانبوبي) اِدرار البول التناضحي للجالكوز الناتج يسبب إزالة الماء والشوارد الكهربائية من الدم مما يسبب احتمالية حصول جفاف مسبب للوفاة. الأفراد الذين يكونون تحت حميات التقييد من الكاربوهيدرات سينتج لديهم أيضا فرط كيتون الجسم. وهذا فرط كيتون الجسم المحثوث في بعض الأحيان يسمى بفرط كيتون الجسم الغذائي، ولكن مستوى تراكيز الأجسام الكيتونية تكون بين 0.5-5 ملي مول بينما الحماض السكري الكيتوني يكون بين 15-25 ملي مول . الآن يتم فحص فعالية فرط كيتون الجسم في تخفيف أعراض مرض الزهايمر.
التأثير على درجة الأس الهايدروجيني (ph)
كلا من حامض الاسيتواستيت وحامض البيتاهيدروكسيبيوترايت حامضية، في حالة ارتفاع مستويات هذان الاثنان من الأجسام الكيتونية بشكل كبير سيؤدي إلى انخفاض درجة الأس الهايدروجيني الخاصة بالجسم وسيؤدي إلى حالة الحماض الكيتوني، ومضاعفات لمرض السكري النمط الأول والغير معالج وفي بعض الأحيان يؤدي إلى المرحلة النهائية من السكري النمط الثاني.
انظر أيضا
السكري . الحماض الكيتوني السكري . فرط كيتون الجسم . دورة تخليق السكر . دورة حمض الستريك .
مصادر
- ^ أ ب ت ث ج ح خ د ذ Stryer، Lubert (1995). Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 510–515, 581–613, 775–778. ISBN:0 7167 2009 4.
- ^ Koeslag، J.H.؛ Noakes، T.D.؛ Sloan، A.W. (1980-04). "Post-exercise ketosis". Journal of Physiology (نُشِر في 1980). ج. 301: 79–90.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Mary K. Campbell؛ Shawn O. Farrell (2006). Biochemistry (ط. 5th). Cengage Learning. ص. 579. ISBN:0-534-40521-5.
- ^ Lori Laffel (1999). "Ketone bodies: a review of physiology, pathophysiology and application of monitoring to diabetes". Diabetes/Metabolism Research and Reviews. ج. 15 ع. 6: 412–426. DOI:10.1002/(SICI)1520-7560(199911/12)15:6<412::AID-DMRR72>3.0.CO;2-8. PMID:10634967.
- ^ أ ب ت Oxidation of fatty acids نسخة محفوظة 09 أغسطس 2017 على موقع واي باك مشين.
- ^ Ketone body metabolism, University of Waterloo نسخة محفوظة 22 سبتمبر 2016 على موقع واي باك مشين.
- ^ American Diabetes Association-Ketoacidosis نسخة محفوظة 22 ديسمبر 2017 على موقع واي باك مشين.
- ^ Integrated Risk Information System | US EPA نسخة محفوظة 24 سبتمبر 2015 على موقع واي باك مشين.
- ^ Kodde IF، van der Stok J، Smolenski RT، de Jong JW (يناير 2007). "Metabolic and genetic regulation of cardiac energy substrate preference". Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. ج. 146 ع. 1: 26–39. DOI:10.1016/j.cbpa.2006.09.014. PMID:17081788.
- ^ Clarke، DD؛ Sokoloff، L (1999). Siegel، GJ؛ Agranoff، BW؛ Albers، RW (المحررون). Basic Neurochemistry: Molecular, Cellular and Medical Aspects (ط. 6th). Philadelphia: Lippincott-Raven. مؤرشف من الأصل في 2019-03-23.
- ^ Hasselbalch، SG؛ Knudsen، GM؛ Jakobsen، J؛ Hageman، LP؛ Holm، S؛ Paulson، OB (1994). "Brain metabolism during short-term starvation in humans". Journal of cerebral blood flow and metabolism. ج. 14 ع. 1: 125–31. DOI:10.1038/jcbfm.1994.17. PMID:8263048.
- ^ Cahill GF. Fuel metabolism in starvation. Annu Rev Nutr 2006;26:1–22
- ^ Freemantle، E.؛ Vandal، M. N.؛ Tremblay-Mercier، J.؛ Tremblay، S. B.؛ Blachère، J. C.؛ Bégin، M. E.؛ Thomas Brenna، J.؛ Windust، A.؛ Cunnane، S. C. (2006). "Omega-3 fatty acids, energy substrates, and brain function during aging". Prostaglandins, Leukotrienes and Essential Fatty Acids. ج. 75 ع. 3: 213–20. DOI:10.1016/j.plefa.2006.05.011. PMID:16829066.
- ^ Koeslag، J.H.؛ Saunders، P.T.؛ Terblanche، E. (2003). "Topical Review: A reappraisal of blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus/syndrome X complex". Journal of Physiology. ج. 549: 333–346. DOI:10.1113/jphysiol.2002.037895.
| أجسام كيتونية في المشاريع الشقيقة: | |