|
تضامنًا مع حق الشعب الفلسطيني |
هيموغلوبين هوبكنز-2
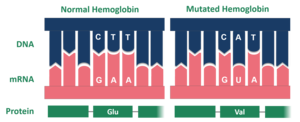
الهيموغلوبين هوبكنز 2، هو طفرة في بروتين الهيموغلوبين المسؤول عن نقل الأكسجين عبر الدم من الرئتين إلى عضلات الجسم في الفقاريات. تؤدي طفرة الهيموغلوبين هوبكنز 2 إلى تكوّن سلسلتين غير طبيعيتين من السلسلة ألفا (يتكون الهيموغلوبين البشري من مركبات عديدة الببتيد: مركبتي ألفا ومركبتي بيتا، ويطلق عليهما عادةً اسم السلاسل).[1] تحدث الطفرة نتيجة استبدال الهيستيدين 112 بحمض الأسبارتيك في سلسلة عديدة الببتيد للبروتين. بالإضافة إلى ذلك، ضمن إحدى السلسلتين المتحورتين ألفا، يوجد استبدال في الموضعين 114 و118، وهما نقطتان ضمن سلسلة الأحماض الأمينية.[2] قد تسبب هذه الطفرة فقر دم منجلي.[3]
إثر الاكتشاف الأولي للهيموغلوبين، اكتشف باحثان يعملان في مستشفى جونز هوبكنز في منتصف القرن العشرين، وهما إرنست سميث وج. توربرت، طفرة الهيموغلوبين هوبكنز 2.[4] ثم في 1960، جاء عمل هارفي إتانو وإليزابيث روبنسون ليؤكد اكتشاف سميث وتوربرت، ويشدد على أهمية مواقع السلسلة ألفا في الطفرة.[5] وفي وقت لاحق من القرن العشرين، درس صموئيل شاراش، وهو عالم وطبيب آخر في هوبكنز، التأثيرات الفسيولوجية لهذا المتغير على الصحة، وتشير النتائج التي توصل إليها إلى أنه لا يحمل أي تأثير سريري.[6]
لأساس الوراثي
تسبب طفرة محددة إنتاج الهيموغلوبين هوبكنز 2، وعلى وجه التحديد، يتكون هذا البروتين من سلسلتي ألفا. توجد الطفرة الخاصة بالهيموغلوبين هوبكنز 2 على سطح الجزيء. ضمن المتحور هوبكنز 2، يحل حمض الأسبارتيك محل الهيستيدين في الموضع 112 على السلسلة ألفا. فحص الدكتور ماكس بيروتس حمض الأسبارتيك في في الموضع 112 على السلسلة ألفا، وقال إن مجموعة الكربوكسيل من الحمض الأميني تشكل رابطة هيدروجينية مع الفينوليكس هيدروكسيل، وهذا بدوره يعمل على استقرار بنية الجزيء ويزيد الألفة للأكسجين. يحتوي الهيموغلوبين هوبكنز 2 على مستويات عالية من الأكسجين، ويعوض عوز الأكسجين ضمن خلايا الدم الحمراء. يشبه المتحور هوبكنز 2 الهيموغلوبين الكهلي، وهو هيموغلوبين طبيعي يحتوي أيضًا على سلسلتي ألفا. يوضح ذلك كيفية ارتباط المتحور هوبكنز 2 بأعراض فقر الدم المنجلي.[7][8]
قد يتفاعل الهيموغلوبين هوبكنز 2 مع الهيموغلوبين المنجلي تحديدًا. يعتبر الهيموغلوبين المنجلي أكثر أنواع الهيموغلوبين الشاذة شيوعًا. يسبب متحور الهيموغلوبين المنجلي فقر الدم المنجلي، وهو اضطراب تنحل فيه خلايا الدم الحمراء وتأخذ شكل شاذ. يحتوي الهيموغلوبين المنجلي على سلسلتي بيتا، بينما يحتوي الهيموغلوبين هوبكنز 2 على سلسلتي ألفا. يشكل هوبكنز 2 22٪ من الحلالات الدموية في الزيجوت الفردي المتغاير. وبهذا الشكل، يوجد نسخة طبيعية من الجين لدى هؤلاء المرضى، والحلالة الدموية هي نتاج انحلال خلايا الدم الحمراء. يشكل المتحور هوبكنز 2 أيضًا 11٪ من الحلالات في الزيجوت المزدوج المتغاير، وهي الحالات التي يحتوي فيها الجين على الهيموغلوبين هوبكنز 2 والهيموغلوبين المنجلي.[9]
يوجد حاليًا العديد من التفسيرات المحتملة حول كيفية نشوء المتحور هوبكنز 2. ينشأ هوبكنز 2، وفقًا لأحد التفسيرات التي توصل إليها العلماء، بسبب طفرة نقطية تؤدي إلى استبدال الهيستيدين بحمض الأسبارتيك. يدعي تفسير آخر حدوث تقاطع غير متكافئ بين جينتي ألفا، وهو ما يفسر استبدال الهيستيدين بحمض الأسبارتيك، ما يؤدي لحدوث حذف ضمن الكروموسوم الحامل للمتحور هوبكنز 2. يزيل هذا الحذف منطقة النهاية الأمينية في السلسلة الرئيسية ألفا ومنطقة النهاية الكربوكسيلية في السلسلة الثانوية ألفا. يؤدي حذف النهاية الأمينية إلى تعطيل الإنزيمات وإيقاف قدرتها على قطع السلاسل في مناطق معينة، ما يؤدي حتمًا إلى إتلاف السلسلة.[10]
المراجع
- ^ Clegg JB، Charache S (1978). "The structure of hemoglobin Hopkins-2". Hemoglobin. ج. 2 ع. 1: 85–8. DOI:10.3109/03630267808999194. PMID:646867.
- ^ Rucknagel DL، Winter WP (نوفمبر 1974). "Duplication of structural genes for hemoglobin alpha and beta chains in man". Annals of the New York Academy of Sciences. ج. 241 ع. 1: 80–92. Bibcode:1974NYASA.241...80R. DOI:10.1111/j.1749-6632.1974.tb21868.x. hdl:2027.42/73379. PMID:4611311. S2CID:83499229.
- ^ Bloom M (1995). Understanding Sickle Cell Disease. United States: University Press of Mississippi. ص. 3–6. ISBN:978-0878057450.
- ^ Hill RL، Swenson RT، Schwartz HC (نوفمبر 1960). "Characterization of a chemical abnormality in hemoglobin G". The Journal of Biological Chemistry. ج. 235 ع. 11: 3182–7. DOI:10.1016/S0021-9258(20)81333-7. PMID:13714317.
- ^ Sugg DK (31 يناير 1995). "Hopkins Finds Sickle Cell Treatment". The Baltimore Sun. مؤرشف من الأصل في 2017-05-18. اطلع عليه بتاريخ 2017-03-08.
- ^ Charache S، Ostertag W، von Ehrenstein G (ديسمبر 1971). "Clinical studies and physiological properties of Hopkins-2 haemoglobin". Nature. ج. 234 ع. 51: 248–51. DOI:10.1038/newbio234248a0. PMID:5288820.
- ^ Weatherall، D. J. (2001). "Towards molecular medicine; reminiscences of the haemoglobin field, 1960-2000". British Journal of Haematology. ج. 115 ع. 4: 729–738. DOI:10.1046/j.1365-2141.2001.03227.x. PMID:11843803.
- ^ "What is Thalassemia?". UCSF Benioff Children's Hospital. مؤرشف من الأصل في 2022-04-07. اطلع عليه بتاريخ 2017-03-08.
- ^ "Symptoms and causes - Mayo Clinic". Mayo Clinic (بEnglish). Archived from the original on 2017-10-10. Retrieved 2017-04-15.
- ^ Brewer DB (مايو 2006). "Max Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet". British Journal of Haematology. ج. 133 ع. 3: 251–8. DOI:10.1111/j.1365-2141.2006.06036.x. PMID:16643426.