|
تضامنًا مع حق الشعب الفلسطيني |
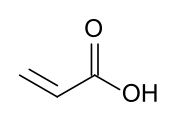
حمض الأكريليك
| حمض الأكريليك[1] | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
حمض البروبانويك[2] |
|
| تسمية الاتحاد الدولي للكيمياء | |
حمض الأكريليك[2] |
|
| أسماء أخرى | |
|
|
| المعرفات | |
| رقم CAS | 79-10-7 |
| بوب كيم (PubChem) | 6581 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C3H4O2 |
| كتلة مولية | 72.06 غ.مول−1 |
| المظهر | شفاف، سائل عديم اللون |
| الرائحة | مرة ولاذعة[3] |
| الكثافة | 1.051 غ/مل |
| نقطة الانصهار | 14 °س، 287 °ك، 57 °ف |
| نقطة الغليان | 141 °س، 414 °ك، 286 °ف |
| الذوبانية في الماء | قابل للامتزاج |
| log P | 0.28[4] |
| ضغط البخار | 3 ملم زئبقي[3] |
| حموضة (pKa) | 4.25 (H2O)[5] |
| اللزوجة | 1.3 بواز عند 20 °م (68 °ف) |
| المخاطر | |
| رمز الخطر وفق GHS |     |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H226, H302, H312, H314, H332, H400 |
| بيانات وقائية وفق GHS | P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P301+312 |
| NFPA 704 |
|
| حدود الاشتعال | %2.4 إلى 8.02%[3] |
| حد التعرض المسموح به U.S | لا شيء[3] |
| مركبات متعلقة | |
| أنيونات أخرى | أكريلات |
| أحماض كربوسكيلية ذات علاقة | حمض الخليك حمض البروبيونيك حمض اللبنيك 3-حمض هيدروكسي بروبانيك حمض المالونيك حمض الزبدة حمض الكروتونيك |
| مركبات ذات علاقة | كحول أليل بروبانال أكرولين ميثيل أكريليت |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض الأكريليك[6] أو حمض البروبانويك[بحاجة لمصدر] (بالإنجليزية: Acrylic acid) هو مركب عضوي يحمل الصيغة CH2=CHCOOH، وهو أبسط حمض كربوكسيلي غير مشبع، ويتكون من مجموعة فينيل متصلة مباشرة بنهاية الحمض الكربوكسيلي، كما أنه سائل عديم اللون وله رائحة مميزة مُرَّة أو لاذعة، وهو قابل للامتزاج والذوبان بالماء والكحول والإيثرات والكلوروفورم، ويتم إنتاجه بأكثر من مليون طن سنويًا.[7]
التاريخ
تمت صياغة كلمة «أكريليك» في عام 1843، لمشتق كيميائي من مادة الأكرولين الذي وهو زيت ذو رائحة مُرَّة مشتق من الجليسرين.
الإنتاج
ينتج حمض الأكريليك عن طريق أكسدة البروبيلين الذي هو منتج ثانوي لإنتاج الإيثيلين ووقود السيارات:
الأساليب التاريخية
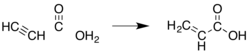
تم تطوير العديد من الطرق الأخرى عبر التاريخ؛ نظرًا لأن حمض الأكريليك والإسترات الخاصة به كانت ذات قيمة تجارية منذ فترة طويلة، ولكن بعد ذلك تم التخلي عن معظم تلك الطرق لأسباب اقتصادية أو بيئية. إحدى الطريقة المبكرة كانت عبر إضافة الكربونيل إلى الأسيتيلين («كيمياء ريبه»):
هذه الطريقة تتطلب كربونيل النيكل، وضغوط عالية من أول أكسيد الكربون، والأسيتيلين، وهي مكلفة نسبيًا مقارنة بالبروبيلين.
تم تصنيع حمض الأكريليك مرة واحدة عن طريق التحلل المائي لمادة الأكريلونتريل التي مادة مشتقة من البروبيلين بواسطة الأموكسدة (باستخدام الأمونيا والأكسجين)، ولكن تم التخلي عن هذه الطريقة لأنها تولد بطريقة مشتركة منتجات جانبية من الأمونيوم التي يجب التخلص منها. وهناك طرق أخرى لإنتاج حمض الأكريليك تم التخلي عنها حاليًا كانت عبر مركبات طليعية تشمل الإيثينون وسيانوهيدرين الإيثيلين.[7]
الأبحاث
يعتبر البروبان مادة خام وهو أرخص بكثير من البروبيلين، لذا فإن أحد الطرق البديلة التي يتم استكشافها هو الأكسدة الاختيارية للبروبان من خطوة واحدة.[8]
يمكن بطريقة ديناميكية حرارية إضافة الكربوكسيل إلى الإيثيلين لإنتاج حمض الأكريليك تحت ظروف ثاني أكسيد الكربون فوق الحرج، ولكن لم يتم حتى الآن تطوير محفزات فعالة.[9] يمكن إنتاج 3-حمض هيدروكسي بروبانيك (3HP) (طليع حمض الأكريليك) من السكريات عبر إزالة الماء، لكن هذه العملية ليست بأفضل من عمليات أخرى لإنتاج هذا الحمض.[10][11]
التفاعل والاستخدامات
يخضع حمض الأكريليك للتفاعلات النموذجية لحمض الكربوكسيل. عندما يتفاعل مع الكحول، فإنه يشكل إسترًا مطابقًا. تُعرف إسترات وأملاح حمض الأكريليك مجتمعة باسم أكريلات (أو بروبينوات). أكثر إسترات الألكيل شيوعًا لحمض الأكريليك هي ميثيل أكريلات، وبيوتيل أكريلات، وإيثيل أكريلات، و2-إيثيل هكسيل أكريلات.
يتحد حمض الأكريليك والإسترات الخاصة به بسهولة مع أنفسهم (لتكوين حمض بولي أكريليك) أو مونومرات أخرى (مثل الأكريلاميدات، والأكريلونيتريل، ومركبات الفينيل، والستايرين، والبوتادين) عن طريق التفاعل عند الرابطة المزدوجة، وذلك لتشكيل البوليمرات المتجانسة أو البوليمرات المشتركة، والتي تُستخدم في التصنيع من مختلف أنواع البلاستيك، والطلاء، والمواد اللاصقة، والبوليمرات المرنة، والورق، وأحبار الطباعة، وكذلك ملمعات ودهانات الأرضيات.[12]
يستخدم حمض الأكريليك في العديد من الصناعات مثل صناعة الحفاظات، أو صناعة معالجة المياه، أو صناعة المنسوجات. وقد تم التوقع أن يصل معدل استهلاك حمض الأكريليك على نطاق عالمي إلى أكثر من 8000 كيلو طن بحلول عام 2020. هذه الزيادة في الاستهلاك تعدُّ نتيجةً لاستخدام هذا المنتج في تطبيقات جديدة، بما في ذلك منتجات العناية الشخصية، والمنظفات، والمنتجات التي تستخدم لسلس البول عند البالغين.[13] كما يعدُّ حمض الأكريليك أيضًا أحد مكونات دخان التبغ.[14]
البدائل
يمكن العثور على حمض أكريليك بديل كمجموعة أسيل أو مجموعة كربوكسي ألكيل، اعتمادًا على إزالة المجموعة من الجزيء. هذه المجموعات المنزوعة تشمل:
- 1. مجموعة الأكريلويل، مع إزالة الجزء −OH من الكربون-1
- 2. مجموعة 2-كربوكسي فينيل، مع إزالة الجزء −H من الكربون-3. تم العثور على هذه المجموعة البديلة في الكلوروفيل.
الأمان
يُخفظ حمض الأكريليك في درجة حرارة 14°س، وعلى الرغم من أن التعرض المنخفض لحمض الأكريليك يؤدي إلى آثار صحية طفيفة أو معدومة، إلا أنه يجب الانتباه بأن هذا الحمض مهيج للغاية، ويسبب تآكل الجلد والجهاز التنفسي. يمكن أن يؤدي ملامسته للعين إلى إصابة شديدة قد لا يمكن علاجها. قد يؤدي التعرض له بكميات كبيرة إلى الوذمة الرئوية. الجرعة المميتة الوسطية له هي 340 مغم/كغم لعينة جرذ (أي 340 ميليغرام لكل كيلوغرام واحد من جسم العينة)، وذلك عن طريق الفم. يمكن معالجة الإصابة بالغسل عن طريق الماء والصابون بشكل جيد ثم تعالج المناطق المصابة بالمراهم، أو بالماء إذا كانت على العينين. كما أنه قابل للاشتعال، وهو يتبلمر بسرعة عند رفع درجة الحرارة، ويكون متفجرًا إذا تمازجت أبخرته مع الهواء.[12]
انظر أيضًا
مراجع
- ^ Merck Index, 11th Edition, 124.
- ^ أ ب International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. ص. 746. DOI:10.1039/9781849733069. ISBN:978-0-85404-182-4.
- ^ أ ب ت ث "NIOSH Pocket Guide to Chemical Hazards #0013". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
- ^ "Acrylic acid_msds". مؤرشف من الأصل في 2018-05-21.
- ^ Dippy، J. F. J.؛ Hughes، S. R. C.؛ Rozanski، A. (1959). "The dissociation constants of some symmetrically disubstituted succinic acids". Journal of the Chemical Society: 2492–2498. DOI:10.1039/JR9590002492.
- ^ Q113378673، ص. 12، QID:Q113378673
- ^ أ ب Ohara، Takashi؛ Sato، Takahisa؛ Shimizu، Noboru؛ Prescher، Günter؛ Schwind، Helmut؛ Weiberg، Otto؛ Marten، Klaus؛ Greim، Helmut (2005)، "Acrylic Acid and Derivatives"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.a01_161.pub2
- ^ Naumann d'Alnoncourt، Raoul؛ Csepei، Lénárd-István؛ Hävecker، Michael؛ Girgsdies، Frank؛ Schuster، Manfred E.؛ Schlögl، Robert؛ Trunschke، Annette (2014). "The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts" (PDF). Journal of Catalysis. ج. 311: 369–385. DOI:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5. مؤرشف من الأصل (PDF) في 2016-02-15. اطلع عليه بتاريخ 2017-07-15.
- ^ Sakakura، Toshiyasu؛ Choi، Jun-Chul؛ Yasuda، Hiroyuki (13 يونيو 2007). "Transformation of Carbon dioxide". Chemical Reviews. ج. 107 ع. 6: 2365–2387. DOI:10.1021/cr068357u. PMID:17564481.
- ^ Sweet Deal: Dow and Partner Cook up Sugar-to-Acrylic Plan. Durabilityanddesign.com. Retrieved on 2012-05-24. نسخة محفوظة 2018-09-04 على موقع واي باك مشين.
- ^ Better Bugs to Make Plastics, Technology Review, September 20, 2010, retrieved January 9, 2012. Technologyreview.com (2010-09-20). Retrieved on 2012-05-24. نسخة محفوظة 2012-01-31 على موقع واي باك مشين.
- ^ أ ب حمض الأكريليك - الموسوعة العربية نسخة محفوظة 2021-07-01 على موقع واي باك مشين.
- ^ "Acrylic acid market". مؤرشف من الأصل في 2020-10-29. اطلع عليه بتاريخ 2018-05-30.
- ^ Talhout، Reinskje؛ Schulz، Thomas؛ Florek، Ewa؛ Van Benthem، Jan؛ Wester، Piet؛ Opperhuizen، Antoon (2011). "Hazardous Compounds in Tobacco Smoke". International Journal of Environmental Research and Public Health. ج. 8 ع. 12: 613–628. DOI:10.3390/ijerph8020613. ISSN:1660-4601. PMC:3084482. PMID:21556207.
وصلات خارجية
- حمض الأكريليك - الموسوعة العربية
- حمض الأكريليك - مصادر الكيمياء للأستاذ أكرم أمير العلي
- إنتاج حمض الأكريليك من درجة الإستر - Air Liquid
- National Pollutant Inventory: Acrylic acid
- CDC – NIOSH Pocket Guide to Chemical Hazards – Acrylic acid
| حمض الأكريليك في المشاريع الشقيقة: | |