|
تضامنًا مع حق الشعب الفلسطيني |
تحفيز حيوي

التحفيز الحيوي (بالإنجليزية: Biocatalysis) هو استخدام أنظمة حية (حيوية) أو والأجزاء التي تعمل على تسريع (تحفيز) التفاعلات الكيميائية. في عمليات التحفيز الحيويية، تقوم المحفزات الطبيعية، مثل الإنزيمات، بإجراء تحويلات كيميائية على المركبات العضوية. كلا الانزيماتيت يتم استخدامها سواء كانت معزولة أو انزيمات لاتزال حية داخل الخلايا.والتِّكنولوجيا البَيولوجِيَّة الحديثة تعمل على تطور الموجه وتختص بإنتاج الإنزيمات المعدلة أومن الممكن أن تكون إنزيمات غير الطبيعية.[1][2][3] ومن الممكن تطوير إنزيمات يمكن لها تحفيز جزيئات صغيرة جديدة قد تكون صعبة أو مستحيلة باستخدام الكيمياء العضوية القديمة.يسمى استخدام الإنزيمات الطبيعية أو المعدلة وراثيًا بالتخليق الكيميائي الأنزيمي ؛ تصنف التفاعلات التي يؤديها الإنزيم على أنها تفاعلات كيميائية.
التاريخ التحفيز الحيوي
يدعم التحفيز الحيوي بعض من أقدم التحولات الكيميائية المعروفة للإنسان، وهو تخمر الأشياء التي انتهت صلاحيتها.ويعود أقدم تخمير إلى حوالي 6000 عام ويعود للسومارين.
كان توظيف الأنزيمات والخلايا الكاملة مهمًا للعديد من الصناعات لعدة قرون. وكانت الاستخدامات الأكثر شيوعًا في مجال الأغذية حيث يعتمد إنتاج النبيذ والبيرة والجبن ووغيرها على تأثيرات الكائنات الحية الدقيقة.
منذ أكثر من مائة عام، تم استخدام التحفيز الحيوي لإجراء تحولات كيميائية على المركبات العضوية غير الطبيعية التي يصنعها الإنسان، وشهدت السنوات الثلاثين الماضية زيادة ملحوظة في استخدام التحفيز الحيوي لإنتاج مواد كيميائية دقيقة، وخاصة في صناعة الأدوية.[4] نظرًا لأن التحفيز الحيوي يقوم على الإنزيمات والكائنات الدقيقة، وهي مصنفة تاريخياً إلى «التحفز المتجانس» و «التحفيز غير المتجانس». ومن الناحية الميكانيكية، يشكل الغسيل الكلوي الحيوي ببساطة حالة خاصة من حالات التحفيز غير المتجانس.[5]
مزايا التخليق الكيميائي الأنزيمي
- الأنزيمات جيدة بيئيًا، حيث تتحلل تمامًا في البيئة.
- تعمل معظم الأنزيمات عادة في ظروف معتدلة أو بيولوجية، مما يقلل من مشاكل التفاعلات الجانبية غير المرغوب فيها مثل التحلل والمُصاوَغَة وتَرَوْسُم ومُراتَبَة التي كثيراً ما تبتلي المنهجية التقليدية.
- يمكن تجميد الإنزيمات المختارة للتخليق الأنزيمي الكيميائي على دعامة صلبة. تُظهر هذه الإنزيمات المجمدة ثباتًا عاليًا وقابلية لإعادة الاستخدام ويمكن استخدامها الوضع المستمر في المولدات النووية الصغيرة.[6][7]
- من خلال تطوير هندسة البروتين، وتحديدًا الطفرات الموجهة للموقع والتطور الموجه، يمكن تعديل الإنزيمات لتمكين التفاعل غير الطبيعي. قد تسمح التعديلات أيضًا بمدى أوسع من الركيزة، وتعزز معدل التفاعل أو معدل دوران المحفز.
- تعرض الإنزيمات إنتقائية شديدة تجاه ركائز المادة. تعرض الإنزيمات عادةً ثلاثة أنواع رئيسية من الانتقائية:
- الانتقائية الكيميائية: نظرًا لأن الغرض من الإنزيم هو العمل على نوع واحد من المجوعات الوظيفية، فإن الوظائف الحساسة الأخرى، والتي التفاعلات تحت التحفيز الكيميائي تبقى نشطة. نتيجة لذلك، تميل تفاعلات التحفيز الحيوي إلى أن تكون «أنظف» ويمكن تجاهل التنقية الشاقة لتنقية المنتجات من الشوائب الناتجة من التفاعلات الجانبية.
- انتقائية رجعية ومقابل غير ضوئي: نظرا للهيكل ثلاثي الأبعاد المعقدة، ويمكن تمييز الإنزيمات من بين المجموعات الوظيفية التي تقع كيميائيا في مناطق مختلفة من جزيء.
- الانتقائية التماثلية: نظرًا لأن جميع الإنزيمات تقريبًا مصنوعة من الأحماض الأمينية، فإن الإنزيمات عبارة عن محفزات مراوان كيميائية. نتيجة لذلك، يتم «التعرف» على أي نوع من المحفزات الموجود في جزيء عند تكوين مركب من مجموعة من الانزيمات. وبالتالي يمكن تحويل الناقل إلى منتج نشط بصريًا وقد يتفاعل مع كل من الناقل المتبلور ووالناقل الرسمي بمعدلات مختلفة.
ولهذه الأسباب، وخاصة السبب الأخير، وهو السبب الرئيسي وراء اهتمام الكيميائيين للإنتاج بالحفز الحيوي. ويرجع هذا الاهتمام بشكل أساسي إلى الحاجة لتركيب مركبات مضادة كالأدوية العلاجية و والمواد الكيميائية الزراعية.
التحفيز الحيوي الغير متماثل
يمكن تقسيم استخدام التحفيز الحيوي للحصول على مركبات دوائية إلى طريقتين مختلفتين:
- انحلال حركي لمزيج عديم الفعالية.
- تركيب غير متماثل للمحفز بيولوجيًا.
انحلال حركي لمزيج عديم الفعالية، يحول وجود جسم مرن (الأنزيم) أحد الأيزومرات الفراغية للمادة المتفاعلة إلى إنتاج ناتج نتيجة تفاعل عدد كبير من المتفاعلات.يتم تحويل الخليط الكيميائي المتجانس إلى مزيج من مركبين مختلفين، مما يجعلهما قابلين للفصل بالمنهجية المعتادة.
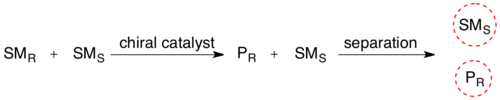
يتم استخدام الدقة الحركية المحفزة بيولوجيًا على نطاق واسع في تنقية المخاليط الأمينية الاصطناعية. هناك العديد من طرق أنتاج الأحماض الأمينية الشائعة، مثل تركيب البروتينات وينتج عن ذلك المزيج ر، س.
يمكن لتنقية الخلط عن طريق أسليك أمين باستخدام الالديهايد بشكل انتقائي فقط نزع الصبغي باستخدام أسيليز الكلى.[8] عادة ما تكون هذه الإنزيمات الانتقائية ذات مصطلح واحد مما يؤدي إلى اختلافات كبيرة جدًا في المعدل، مما يسمح بالبستلة الانتقائية.[9] أخيرًا، يمكن الآن فصل المنتجين عن طريق تقنية البستلة، مثل الكروماتوغرافيا (الاستشراب).

يبلغ أقصى عائد لهذه حركية حوالي 50٪، نظرًا لأن العائد الذي يزيد عن 50٪ يعني أن بعض التفاعلات النووية الخاطئة قد تفاعل أيضًا، مما يعطي فائضًا أقل. لذلك يجب إنهاء ردود الفعل هذه قبل الوصول إلى نقطة التعادل. إذا كان من الممكن تنفيذ مثل هذه القرارات في ظل ظروف يكون فيها المركبان متماثلان لمتسلسلة بشكل مستمر، فيمكن من الناحية النظرية تحويل كل الركيزة إلى منتج دواء. هذا يسمى الدقة الديناميكية.
إدخال غير متماثل للمحفز بيولوجيًا، تصبح الوحدة غير اللولبية مراوان بطريقة تتشكل فيها الأيزومرات الفراغية المختلفة الممكنة بكميات مختلفة. يتم إدخالها في الركيزة عن طريق تأثير الإنزيم، وهو الهرمون.وتعد الخميرة هي المحفز الحيوي للتقليل من انتقائية للكيتونات.
يتم إدخال الانزيم في النواة عن طريق تأثير الإنزيم، وهو مراوان. الخميرة هي محفز حيوي لتقليل انتقائي للكيتونات.

تعد أكسدة فيليجر مثالًا آخر على تفاعلات التحفيز الحيوي. في إحدى الدراسات، وجد المتغير «المبيضة» وهي نوع من الفطريات لتكون محفزًا فعالًا حيث أضاف مايكل للأكرولين مع الأسيتيل أسيتون في 20 درجة مئوية في حالة عدم وجود مذيب إضافي.[10]
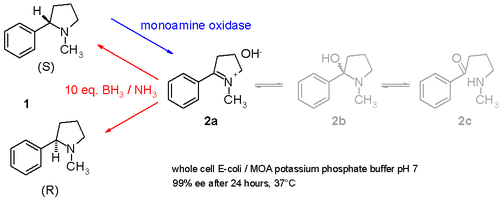
حيث توضح دراسة أخرى كيف لمادة النيكوتين (خليط من س والمقابلات الضوئية 1 في مخطط 3) يمكن أخذ عينة دم في وعاء واحد الإجراء الدراسة ويحتوي على أوكسيديز أحادي الأمين معزولة عن رشاشيىة سوداء وهي نوع من الفطريات التي هي قادرة على أكسدة فقط أمينس -جزيئي ل إمين (2) والتي تنطوي على الأمونيا بوران (مركب كيميائي) مختزل من الزوجين التي يمكن أن تقلل من إمين 2 إلى أمين 1. [11] وبهذه الطريقة، سيستهلك الإنزيم س -متماثل باستمرار بينما يتراكم ر-متماثل.ومن الممكن حتى تحويل س إلى ر نقية.
التحفيز الحيوي الضوئي
في الآونة الأخيرة، يتم تطبيق التحفيز الحيوي الضوئي للتحفيز الكيميائي، ويعد هذا النوع من التحفيز فريد من نوعه، وتحدث بعض التفاعلات التي يتعذر الحصول عليها سابقا. يعتمد التحفيزالكيميائي على الضوء لتوليد وسيط الحرة.[12] هذه المواد الوسيطة الجذرية وبالتالي يتم الحصول على خليط للمنتج عندما لا يتم توفير بيئة لولبية خارجية. يمكن أن توفر الإنزيمات هذه البيئة اللولبية داخل الموقع النشط وتثبّت شكلًا معينًا وتفضل تكوين منتج واحد.[13] تنقسم تفاعلات التحفيز الحيوي الضوئية إلى فئتين:
- أنزيم مساعد داخلي / محفز ضوئي داخلي
- محفز ضوئي خارجي
يمكن لبعض العوامل المساعدة المشتركة لنقل ذرة الهيدروجين مع وصلة ناقلة مثل فوسفات ثنائي نيوكليوتيد الأدينين وأميد النيكوتين ومجموعة الفلافين وقد تعمل ككواشف أحادية لنقل الإلكترون.[13][14][15] على الرغم من أن هذا النوع النواقل قادرة دون تشعيع، فإن إمكانات الأكسدة والاختزال الخاصة بها تتعزز بنحو 2.0 فولت عند تشعيع الضوء المرئي.[16] عند إقترنها بالإنزيمات الخاصة بكل منها (اختزال)، يتم استخدام هذه الظاهرة من قبل الكيميائيين لتطوير منهجيات الاختزال الانتقائي. على سبيل المثال، يمكن تصنيع اللاكتام ذات الحجم التوسط في البيئة اللولبية من اختزال الإنزيم من خلال التدوير الجذري المختزل، الانزيم الناقل من سفات ثنائي نيوكليوتيد الأدينين وأميد النيكوتين.[17] تستخدم الفئة الثانية من تفاعلات التحفيز الحيوي الممكّنة من المحفز ضوئي خارجي. يمكن استخدام العديد من أنواع المحفزات التي تحتوي على مجموعة كبيرة من إمكانيات الأكسدة والاختزال، مما يسمح بضبط التفاعل مقارنة باستخدام عامل مساعد. روز البنغال(مركب كيميائي)، والمحفز الخارجي، بالاضافه إلى استخدام أوكسيدوروكتازمع كيتونات ألفا أسيل متوسطة الحجم غير انتقائية.[18]
استخدام المحفز الخارجي له بعض الجوانب السلبية. على سبيل المثال، عادةً ما تعقد أجهزة التحفيز الخارجية في تصميم التفاعل لأنالمحفز الخارجي قد يتفاعل مع كل من مادة متعاعلة سواء كانت مرتبطة وغير مرتبطة. في حال حدوث تفاعل بين المواد المتفاعلة غيرمقيدة والمحفز الخارجي، يتم فقد الانتقائية التناسلية وقد تحدث تفاعلات جانبية أخرى.
انظر أيضًا
مراجع
- ^ Anthonsen، Thorlief (2000). "Reactions Catalyzed by Enzymes". في Adlercreutz, Patrick؛ Straathof, Adrie J. J. (المحررون). Applied Biocatalysis (ط. 2nd). Taylor & Francis. ص. 18–59. ISBN:978-9058230249.
- ^ Faber، Kurt (2011). Biotransformations in Organic Chemistry (ط. 6th). Springer. ISBN:9783642173936.[بحاجة لرقم الصفحة]
- ^ Jayasinghe، Leonard Y.؛ Smallridge, Andrew J.؛ Trewhella, Maurie A. (1993). "The yeast mediated reduction of ethyl acetoacetate in petroleum ether". Tetrahedron Letters. ج. 34 ع. 24: 3949–3950. DOI:10.1016/S0040-4039(00)79272-0.
- ^ Liese, Andreas؛ Seelbach, Karsten؛ Wandrey, Christian، المحررون (2006). Industrial Biotransformations (ط. 2nd). John Wiley & Sons. ص. 556. ISBN:978-3527310012.
- ^ Rothenberg، Gadi (2008). Catalysis: Concepts and green applications. Wiley. ISBN:9783527318247.[بحاجة لرقم الصفحة]
- ^ Bhangale، Atul؛ Kathryn L. Beers؛ Richard A. Gross (2012). "Enzyme-Catalyzed Polymerization of End-Functionalized Polymers in a Microreactor". Macromolecules. ج. 45 ع. 17: 7000–7008. Bibcode:2012MaMol..45.7000B. DOI:10.1021/ma301178k.
- ^ Bhangale، Atul؛ Santanu Kundu؛ William E. Wallace؛ Kathleen M. Flynn؛ Charles M. Guttman؛ Richard A. Gross؛ Kathryn L. Beers (2010). "Continuous Flow Enzyme-Catalyzed Polymerization in a Microreactor". JACS. ج. 133 ع. 15: 6006–6011. DOI:10.1021/ja111346c. PMID:21438577.
- ^ Wade, L. G., 1947- (2013). Organic chemistry (ط. 8th). Boston: Pearson. ISBN:978-0-321-76841-4. OCLC:752068109.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Shviadas، V. Iu؛ Galaev، I. Iu؛ Galstian، N. A.؛ Berezin، I. V. (أغسطس 1980). "[Substrate specificity of acylase I from pig kidney]". Biokhimiia (Moscow, Russia). ج. 45 ع. 8: 1361–1364. ISSN:0320-9725. PMID:7236787.
- ^ Svedendahl، Maria؛ Hult, Karl؛ Berglund, Per (ديسمبر 2005). "Fast Carbon-Carbon Bond Formation by a Promiscuous Lipase". Journal of the American Chemical Society. ج. 127 ع. 51: 17988–17989. DOI:10.1021/ja056660r. PMID:16366534.
- ^ Dunsmore، Colin J.؛ Carr, Reuben؛ Fleming, Toni؛ Turner, Nicholas J. (2006). "A Chemo-Enzymatic Route to Enantiomerically Pure Cyclic Tertiary Amines". Journal of the American Chemical Society. ج. 128 ع. 7: 2224–2225. DOI:10.1021/ja058536d. PMID:16478171.
- ^ Prier، Christopher K.؛ Rankic، Danica A.؛ MacMillan، David W. C. (10 يوليو 2013). "Visible Light Photoredox Catalysis with Transition Metal Complexes: Applications in Organic Synthesis". Chemical Reviews. ج. 113 ع. 7: 5322–5363. DOI:10.1021/cr300503r. ISSN:0009-2665. PMID:23509883.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب Nakano، Yuji؛ Biegasiewicz، Kyle F؛ Hyster، Todd K (أبريل 2019). "Biocatalytic hydrogen atom transfer: an invigorating approach to free-radical reactions". Current Opinion in Chemical Biology. ج. 49: 16–24. DOI:10.1016/j.cbpa.2018.09.001. PMID:30269010.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Sandoval، Braddock A.؛ Meichan، Andrew J.؛ Hyster، Todd K. (23 أغسطس 2017). "Enantioselective Hydrogen Atom Transfer: Discovery of Catalytic Promiscuity in Flavin-Dependent 'Ene'-Reductases". Journal of the American Chemical Society. ج. 139 ع. 33: 11313–11316. DOI:10.1021/jacs.7b05468. ISSN:0002-7863. PMID:28780870.
- ^ Li، Zhining؛ Wang، Zexu؛ Meng، Ge؛ Lu، Hong؛ Huang، Zedu؛ Chen، Fener (أبريل 2018). "Identification of an Ene Reductase from Yeast Kluyveromyces Marxianus and Application in the Asymmetric Synthesis of ( R )-Profen Esters". Asian Journal of Organic Chemistry. ج. 7 ع. 4: 763–769. DOI:10.1002/ajoc.201800059.
- ^ Emmanuel، Megan A.؛ Greenberg، Norman R.؛ Oblinsky، Daniel G.؛ Hyster، Todd K. (14 ديسمبر 2016). "Accessing non-natural reactivity by irradiating nicotinamide-dependent enzymes with light". Nature. ج. 540 ع. 7633: 414–417. Bibcode:2016Natur.540..414E. DOI:10.1038/nature20569. ISSN:1476-4687. PMID:27974767.
- ^ Biegasiewicz، Kyle F.؛ Cooper، Simon J.؛ Gao، Xin؛ Oblinsky، Daniel G.؛ Kim، Ji Hye؛ Garfinkle، Samuel E.؛ Joyce، Leo A.؛ Sandoval، Braddock A.؛ Scholes، Gregory D. (21 يونيو 2019). "Photoexcitation of flavoenzymes enables a stereoselective radical cyclization". Science. ج. 364 ع. 6446: 1166–1169. Bibcode:2019Sci...364.1166B. DOI:10.1126/science.aaw1143. ISSN:0036-8075. PMID:31221855.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Biegasiewicz، Kyle F.؛ Cooper، Simon J.؛ Emmanuel، Megan A.؛ Miller، David C.؛ Hyster، Todd K. (يوليو 2018). "Catalytic promiscuity enabled by photoredox catalysis in nicotinamide-dependent oxidoreductases". Nature Chemistry. ج. 10 ع. 7: 770–775. Bibcode:2018NatCh..10..770B. DOI:10.1038/s41557-018-0059-y. ISSN:1755-4330. PMID:29892028.
قراءة متعمقة
- Mortison، JD؛ Sherman، DH (2010). "Frontiers and opportunities in chemoenzymatic synthesis". J Org Chem. ج. 75 ع. 21: 7041–51. DOI:10.1021/jo101124n. PMID:20882949.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)
روابط خارجية
- المركز النمساوي للتكنولوجيا الحيوية الصناعية - acib
- مركز التميز للتحفيز الحيوي - CoEBio3
- جامعة اكستر - مركز التحفيز الحيوي
- مركز التحفيز الحيوي والمعالجة الحيوية - جامعة أيوا
- TU Delft - التحفيز الحيوي والكيمياء العضوية (BOC)
- KTH ستوكهولم - مجموعة أبحاث التحفيز الحيوي
- معهد التحفيز الحيوي التقني بجامعة هامبورغ للتكنولوجيا (TUHH)
- مشروع Biocascades