|
تضامنًا مع حق الشعب الفلسطيني |
بيريلين
| بيريلين[1] | |
|---|---|
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Perylene |
|
| أسماء أخرى | |
peri-Dinaphthalene; Perilene; Dibenz[de,kl]anthracene |
|
| المعرفات | |
| رقم CAS | 198-55-0 |
| بوب كيم (PubChem) | 9142 |
| الخواص | |
| الصيغة الجزيئية | C20H12 |
| الكتلة المولية | 252.32 غ/مول |
| المظهر | صلب أصفر-بني |
| نقطة الانصهار | 273–278 °س |
| الذوبانية في الماء | غير منحل في الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
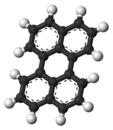
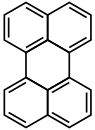
بيريلين هو هيدروكربون عطري متعدد الحلقات له الصيغة الكيميائية C20H12، ويكون على شكل بلورات صفراء إلى بنية اللون.
يمكن اعتبار مركب تتراسين بنيوياً على أنه اندماج بين أربع حلقة بنزين تجمع بينها حلقة سداسية خامسة في المنتصف.
الوفرة الطبيعية والتحضير
يوجد البيريلين طبيعياً في قطران الفحم؛ كما عثر عليه في المستحاثات وفي الخث وفي الترسبات الجيولوجية على ضفاف بعض الأنهار، وكذلك في النفط الخام.
يمكن تحضير البيريلين مخبرياً من تفاعل نزع كربوكسيل من مركب ثنائي أنهيدريد بيريلين رباعي الكربوكسيليك (PTCDA)، وهو خضاب معروف، وذلك بتفاعل يجرى بوجود أشعة ميكرويف وحفاز من النحاس في وسط من الكينولين.[2]
الخواص

يوجد المركب في الحالة العادية على شكل بلورات صفراء إلى بنية اللون، عديمة الانحلالية في الماء، لكنها ذوابة بشكل جيد في كل من ثنائي كلورو الميثان والتولوين والكلوروفورم؛ لكنها ضعيفة في الكحولات مثل الميثانول والإيثانول.
يبدي البيريلين خاصة فلورية ذات لون أزرق عند تعريضه للأشعة فوق البنفسجية. يمكن اعتبار بنية البيريلين على أنها ارتباط بين حلقتي نفثالين في الموقعين 1 و 8. خضعت بنية البيريلين لدراسة مكثفة بتقنية دراسة البلورات بالأشعة السينية.[3]
الاستخدامات
يستخدم البيريلين كمادة مصدرة للضوء الأزرق في الصمامات الثنائية العضوية الباعثة للضوء.

المراجع
- ^ Perylene at Sigma-Aldrich نسخة محفوظة 12 مارس 2020 على موقع واي باك مشين.
- ^ Liu, Huibiao et al.: Synthesis of Organic One-Dimensional Nanomaterials by Solid-Phase Reaction. In: Journal of the American Chemical Society. Volume 125, Issue 36, 2003, S. 10794–10795, دُوِي:10.1021/ja036697g.
- ^ Donaldson, D. M.؛ Robertson, J. M.؛ White, J. G. (1953). "The crystal and molecular structure of perylene". وقائع الجمعية الملكية. ج. 220 ع. 1142: 311–321. DOI:10.1098/rspa.1953.0189. JSTOR:99329.
| في كومنز صور وملفات عن: بيريلين |