درونيدارون
درونيدارون (بالإنجليزية: Dronedarone) ، هو دواء من شركة سانوفي، يستخدم لعلاج عدم انتظام ضربات القلب، الرجفان الأذيني والرفرفة الأذينية أو الذين خضعوا للعلاج الدوائي أو العلاج بالصدمة الكهربائية.[2] [3][4]
| درونيدارون | |
|---|---|
| الاسم النظامي | |
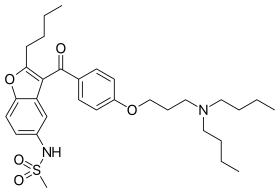
| N-(2-Butyl-3-(p-(3-(dibutylamino)propoxy)benzoyl)-5-benzofuranyl)methanesulfonamide | |
| اعتبارات علاجية | |
| اسم تجاري | Multaq |
| مرادفات | SR33589 |
| ASHPDrugs.com | أفرودة |
| مدلاين بلس | a609034 |
| الوضع القانوني | وكالة الأدوية الأوروبية:وصلة، ديلي مد:وصلة |
| فئة السلامة أثناء الحمل | D (أستراليا) X (الولايات المتحدة) |
| طرق إعطاء الدواء | عن طريق الفم |
| بيانات دوائية | |
| توافر حيوي | 15% (مع وجبة غنية بالدهون)[1] |
| ربط بروتيني | 98% |
| استقلاب (أيض) الدواء | كبد (بشكل رئيسي بواسطة) |
| عمر النصف الحيوي | 13–19 ساعة |
| إخراج (فسلجة) | براز (84%), بول (~6%) |
| معرّفات | |
| CAS | 141626-36-0 |
| ك ع ت | C01C01BD07 BD07 |
| بوب كيم | CID 208898 |
| IUPHAR | 7465 |
| درغ بنك | DB04855 |
| كيم سبايدر | 180996 |
| المكون الفريد | JQZ1L091Y2 |
| كيوتو | D02537 |
| ChEBI | CHEBI:50659 |
| ChEMBL | CHEMBL184412 |
| ترادف | SR33589 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C31H44N2O5S |
| تعديل مصدري - تعديل | |
التجارب
أعلنت التجارب أن الدرونيدارون لديه القدرة على تقليل الرجفان الأذيني، وتقليل الوفيات بشكل عام، وتأثيراته الضارة، بما في ذلك الوفيات الزائدة، [2] [5] درونيدارون هو دواء مضاد لاضطراب النظم من الدرجة الثالثة خالي من اليود ويساعد المرضى على العودة إلى إيقاع الجيوب الأنفية الطبيعي.[6] [7][3] [8]
المراجعة التنظيمية
تم تقديم درونيدارون كعقار جديد للأدوية في عام 2005 ، وتمت مراجعته والتوصية بالموافقة عليه في 18 مارس 2009 من قبل اللجنة الاستشارية التابعة لإدارة الغذاء والدواء الأمريكية.
كانت وزارة الصحة الكندية ثاني هيئة تنظيمية رئيسية توافق على الدواء ، حيث أعطت موافقتها في 12 أغسطس 2009.[9]
أصدرت وكالة الأدوية الأوروبية ملخصًا للرأي الإيجابي بشأن الدرونيدارون في 24 سبتمبر 2009 ، في 27 سبتمبر 2009 أصدرت وكالة الأدوية الأوروبية أصدرت تصريح بتسويق درونيدارون داخل الاتحاد الأوروبي. [10]
المراجع
- ^ "Multaq- dronedarone tablet, film coated". DailyMed. 15 أكتوبر 2020. مؤرشف من الأصل في 2015-09-14. اطلع عليه بتاريخ 2020-11-18.
- ^ أ ب Zimetbaum، PJ (2009). "Dronedarone for atrial fibrillation--an odyssey". The New England Journal of Medicine. ج. 360 ع. 18: 1811–3. DOI:10.1056/NEJMp0902248. PMID:19403901.
- ^ أ ب "Increased mortality after dronedarone therapy for severe heart failure". N Engl J Med. ج. 358 ع. 25: 2678–87. يونيو 2008. DOI:10.1056/NEJMoa0800456. PMID:18565860.
- ^ "FDA Drug Safety Communication: Severe liver injury associated with the use of dronedarone (marketed as Multaq). Safety Announcement". U.S. إدارة الغذاء والدواء (FDA). 14 يناير 2011. مؤرشف من الأصل في 2021-01-26.
- ^ Guillemare E, Marion A, Nisato D, Gautier P, “Inhibitory effects of dronedarone on muscarinic K+ current in guinea pig atrial cells,” in Journal of Cardiovascular Pharmacology, 2000. 7
- ^ Connolly SJ, Crijns HJ, Torp-Pedersen C, van Eickels M, Gaudin C, Page RL, Hohnloser SH; ATHENA Investigators, “Analysis of stroke in ATHENA: a placebo-controlled, double-blind, parallel-arm trial to assess the efficacy of dronedarone 400 mg BID for the prevention of cardiovascular hospitalization or death from any cause in patients with atrial fibrillation/atrial flutter,” in Circulation, 2009.8
- ^ "Dronedarone for maintenance of sinus rhythm in atrial fibrillation or flutter". N Engl J Med. ج. 357 ع. 10: 987–999. سبتمبر 2007. DOI:10.1056/NEJMoa054686. PMID:17804843.
- ^ Connolly SJ؛ Crijns HJGM؛ Torp-Pedersen C؛ van Eyckels M؛ Gaudin C؛ Page RL؛ Hohnloser SH (سبتمبر 2009). "Analysis of Stroke in ATHENA: A Placebo-Controlled, Double-Blind, Parallel-Arm Trial to Assess the Efficacy of Dronedarone 400 mg BID for the Prevention of Cardiovascular Hospitalization or Death From Any Cause in Patients With Atrial Fibrillation/Atrial Flutter". Circulation. ج. 120 ع. 13: 1174–80. DOI:10.1161/CIRCULATIONAHA.109.875252. PMID:19752319. مؤرشف من الأصل في 2011-06-08.
- ^ "Archived copy". مؤرشف من الأصل في 2011-07-18. اطلع عليه بتاريخ 2009-08-13.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) - ^ Summary of Positive Opinion (retrieved 1 December 2009) نسخة محفوظة 23 فبراير 2021 على موقع واي باك مشين.
روابط خارجية
- "درونيدارون". بوابة المعلومات الدوائية. المكتبة الوطنية الأمريكية للطب. مؤرشف من الأصل في 2020-10-25.
- "هيدروكلوريد درونيدارون". بوابة المعلومات الدوائية. المكتبة الوطنية الأمريكية للطب.
| درونيدارون في المشاريع الشقيقة: | |