حماض أيضي
الحماض الأيضي (بالإنجليزية: Metabolic acidosis) في الطب هو ارتفاع في حموضة الدم والجسم (حماض)،[1] والتي تحدث إما نتيجة لارتفاع في كمية البروتونات الناتجة عن عملية الأيض في الجسم أو تنيجة لنقص البيكربونات في الدم.[2]
| حماض أيضي | |
|---|---|
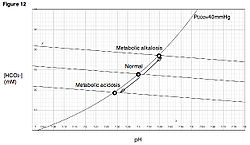
رسم بياني للحماض الأيضي
| |
| تعديل مصدري - تعديل |
الأسباب
أغلب الأسباب التي تؤدي إلى الحماضي الأيضي (في حال لم يكن السبب سوء التغذية المزمن) هي:
- مرض الكلى المزمن مع تبولن الدم أو ارتفاع الحموضة في الأنابيب البعيدة ويسمى (Retention acidosis).
- مرض السكر مع انحفاض نسبة الإنسولين في الدم ويسمى الحماض الكيتوني السكري (Ketoacidosis)ويعتبر السبب الأكثر شيوعاً،حيث يتحصل مريض السكري على حاجته من الطاقة عند انخفاض الإنسولين عن طريق زيادة هدم الأحماض الدهنية ، أثناء هذه العملية تنتج كميات كبيرة من الكيتونات ، التي بدورها ترتبط بالمحلول المنظم في الدم (بيكربونات)، مما يؤدي إلى نقص البيكربونات في الدم وزيادة حموضته.
- التسمم بمواد حمضية مثل حامض الأسبرين. أو ارتفاع نسبة اللاكتات في الدم بعد القيام بمجهود عضلي كبير (lactic acidosis)
- فقدان كميات من أيونات البيكربونات في الأنابيب القريبة في الكلية ،[3] أو في حالة الإصابة بالاسهال.
التشخيص
أبرز أعراض الحماض الأيضي هو تنفس كوسماول ( تنفس جهدي عميق ) ، عند المرضى بالحماض الكيتوني السكري يمكن للمرء أن يشم رأئحة الأسيتون في هواء الزفير . تحليل غازات الدم يعتبر الشيء الرئيس في تشخيص الحماض الأيضي.
العلاج
لعلاج الحماض الأيضي يجب علاج الأسباب المؤدية إليه، فمثلاً إعطاء الإنسولين لمرضى السكري المصابين بالحماض الأيضي يؤدي إلى تحسن سريع في حموضة الدم( يجب التأكد قبل ذلك بأن هناك نسبة كافية من السوائل والإلكتروليت في الدم )، في حالة الحماض نتيجة لتبولن الدم عندها يكون العلاج عن طريق الغسيل الكلوي لمرضى الكلى المزمن، في حالات الحماض الأيضي الشديد يعطى المريض بيكربونات الصوديوم من أجل تحسَن مؤقت في حموضة الدم.[4]
العواقب
الحماض الأيضي الحاد
يحدث الحماض الأيضي الحاد في أثناء فترات الاستشفاء وفي الحالات الحرجة الحادة، ويرتبط غالبًا بسوء الإنذار؛ إذ يصل معدل الوفيات إلى نحو 57% إن بقي الأس الهيدروجيني عند قيمة 7.20 دون علاج. عند الوصول إلى مستويات حموضة أدنى من ذلك، قد يؤدي الحماض الأيضي الحاد إلى إضعاف الدورة الدموية وإيصال الأجهزة إلى حالات فشل نهائية.
الحماض الأيضي المزمن
يحدث الحماض الأيضي المزمن بشكل شائع لدى الأشخاص الذين يعانون من مرض الكلى المزمن والذين يملكون معدل رشح كبي تقديري أقل من 45 مل/ دقيقة/1.73 م2، ولكنه يكون غالبًا خفيفًا إلى متوسط الشدة. ومع ذلك، قد يظهر الحماض الأيضي باكرًا في سياق مرض الكلى المزمن. أظهر العديد من الدراسات التي أُجريت على الحيوانات والبشر أن الحماض الأيضي في مرض الكلى المزمن يملك تأثيرًا سلبيًا على الوظيفة الخلوية بالنظر إلى طبيعته المزمنة، وأنه يساهم عمومًا في ارتفاع معدلات المراضة لدى هؤلاء المرضى.
يضر الحماض الأيضي الذي يحدث في سياق الفشل الكلوي بالعظام والعضلات، وخاصةً في الحالات النهائية من الفشل الكلوي. تسبب عملية تعديل الحماض (الدرء) إلى فقدان كثافة العظام، ما يؤهب لحدوث الكسور العظمية، والحثل العظمي الكلوي، والأمراض العظمية الأخرى؛ بالإضافة إلى ذلك، يؤدي الهدم المتزايد للبروتين إلى ضياع العضلات. يرتبط الحماض الأيضي في مرض الكلى المزمن أيضًا بانخفاض معدل الرشح الكبي التقديري؛ فهو من مضاعفات مرض الكلى المزمن، وأيضًا من الأسباب الكامنة وراء تقدمه.
العلاج
يعتمد علاج الحماض الأيضي على السبب الكامن وراء حدوثه، ويجب أن يستهدف العلاج عكس العملية الرئيسية المسببة. عند التفكير في مسار العلاج، من المهم التمييز بين الأشكال الحادة والأشكال المزمنة للحماض.
الحماض الأيضي الحاد
يبدأ العلاج بالبيكربونات بشكل عام في حالات المرضى الذين يعانون من الحماض الشديد (أس هيدروجيني أقل من 7.11)، أو لدى من يعانون من حماض أقل شدة (أس هيدروجيني بين 7.1- 7.2) مرافق لإصابة حادة في الكليتين. لا يُنصح بالعلاج بالبيكربونات عند الأشخاص الذين يعانون حماضًا أقل شدة (أس هيدروجيني ≥ 7.1) إلا في حال وجود أذية كلوية حادة شديدة. لم يملك العلاج بالبيكربونات بهدف الحفاظ على أس هيدروجيني أعلى من 7.3 أيّ تأثير إجمالي على معدل الوفاة الناجم عن جميع الأسباب أو على تطور فشل عضو واحد على الأقل في اليوم السابع. ومع ذلك، انخفضت درجة الإنذار الأولي المركب، ومعدل الوفيات خلال 28 يوم، والحاجة للتحال الدموي عند معالجة مرضى الأذية الكلوية الحادة الشديدة بالبيكربونات.[5]
الحماض الأيضي المزمن
يبطئ علاج الحماض الأيضي تطور مرض الكلى المزمن لدى المصابين به، ويشمل ذلك تدخلات غذائية تتعلق بالفواكه والخضروات المحفزة لإطلاق الأسس. أشارت الأبحاث الحديثة أيضًا إلى أن تحديد البروتين في النظام الغذائي، من خلال اتباع نظام غذائي نباتي منخفض البروتين مشابه للكيتو، يُعد خيارًا غذائيًا آمنًا لتصحيح الحماض الأيضي لدى الأشخاص المصابين بمرض الكلى المزمن.[6]
تبقى البيكربونات الفموية حاليًا العلاج الأكثر شيوعًا للحماض الأيضي المزمن. توصي الإرشادات التوجيهية ببدء العلاج عندما تكون مستويات بيكربونات المصل أقل من 22 ميلي مكافئ/الليتر للحفاظ على مستويات أعلى من تلك القيمة أو تساويها. أثبتت الدراسات التي تبحث في آثار العلاج القلوي الفموي تحسّنَ مستويات بيكربونات المصل؛ الأمر الذي يساهم بإبطاء تدهور الوظيفة الكلوية وانخفاض البيلة البروتينية؛ ما يؤدي إلى انخفاض خطر التقدم نحو فشل الكلى. ومع ذلك، تشمل الآثار الجانبية للعلاج القلوي الفموي ما يلي: عدم التحمل الهضمي، وتفاقم الوذمات، وارتفاع ضغط الدم. علاوةً على ذلك، يتطلب العلاج القلوي الفموي تناول كميات كبيرة من الحبوب لعلاج الحماض الأيضي؛ وهذا يؤدي في النهاية إلى سوء التزام المرضى بالدواء.[7][8]
يوجد حاليًا دواء استقصائي واعد يُسمى فيفيريمير مصمم لعلاج الحماض الأيضي عن طريق الارتباط مع الحمض في الجهاز الهضمي وإطراحه من الجسم عبر البراز، وبالتالي تقليل كمية الحموض في الجسم وزيادة مستوى البيكربونات في الدم. استمرت التجربة السريرية ضمن المرحلة الثالثة لاختبار الدواء 12 أسبوعًا وخضعت للتعشية ثنائية الجانب واستخدمت مجموعة ضبط مُعالَجة بالدواء الغفل. أثبتت التجربة السابقة أن الفيفيريمير ساهم في تصحيح الحماض الأيضي بشكل فعال وآمن على المدى القصير، وأن التجربة التي امتدت 40 أسبوعًا لتقييم السلامة على المدى الطويل أظهرت استمرار تحسن الوظيفة البدنية، والنقاط النهائية العامة للوفاة وغسيل الكلى وانفاض معدل الرشح الكبي بنسبة 50%.[9][10]
انظر ايضاً
المراجع
- ^ كم كنت تعرف عن الحماض الأيضي نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين.
- ^ Metabolic Acidosis نسخة محفوظة 17 يونيو 2017 على موقع واي باك مشين.
- ^ secondary - الحماض الأيضي في الفشل الكلوي نسخة محفوظة 29 نوفمبر 2017 على موقع واي باك مشين.
- ^ الحماض الأيضي - صفحات - 1 - العالم المعرفة الموسوعية نسخة محفوظة 10 يناير 2014 على موقع واي باك مشين.
- ^ Jaber، Samir؛ Paugam، Catherine؛ Futier، Emmanuel؛ Lefrant، Jean-Yves؛ Lasocki، Sigismond؛ Lescot، Thomas؛ Pottecher، Julien؛ Demoule، Alexandre؛ Ferrandière، Martine؛ Asehnoune، Karim؛ Dellamonica، Jean (7 يوليو 2018). "Sodium bicarbonate therapy for patients with severe metabolic acidaemia in the intensive care unit (BICAR-ICU): a multicentre, open-label, randomised controlled, phase 3 trial". The Lancet. ج. 392 ع. 10141: 31–40. DOI:10.1016/S0140-6736(18)31080-8. ISSN:0140-6736. PMID:29910040.
- ^ Goraya, Nimrit; Wesson, Donald E. (2019). "Clinical evidence that treatment of metabolic acidosis slows the progression of chronic kidney disease". Current Opinion in Nephrology and Hypertension (بen-US). 28 (3): 267–277. DOI:10.1097/MNH.0000000000000491. ISSN:1062-4821. PMC:6467553. PMID:30681417.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ Chen، Wei؛ Abramowitz، Matthew K. (2019). "Advances in management of chronic metabolic acidosis in chronic kidney disease". Current Opinion in Nephrology and Hypertension. ج. 28 ع. 5: 409–416. DOI:10.1097/MNH.0000000000000524. ISSN:1473-6543. PMC:6677263. PMID:31232712.
- ^ Garneata, Liliana; Stancu, Alexandra; Dragomir, Diana; Stefan, Gabriel; Mircescu, Gabriel (1 Jul 2016). "Ketoanalogue-Supplemented Vegetarian Very Low–Protein Diet and CKD Progression". Journal of the American Society of Nephrology (بEnglish). 27 (7): 2164–2176. DOI:10.1681/ASN.2015040369. ISSN:1046-6673. PMC:4926970. PMID:26823552. Archived from the original on 2019-12-31.
- ^ Wesson, Donald E.; Mathur, Vandana; Tangri, Navdeep; Stasiv, Yuri; Parsell, Dawn; Li, Elizabeth; Klaerner, Gerrit; Bushinsky, David A. (3 Aug 2019). "Long-term safety and efficacy of veverimer in patients with metabolic acidosis in chronic kidney disease: a multicentre, randomised, blinded, placebo-controlled, 40-week extension". The Lancet (بالإنجليزية). 394 (10196): 396–406. DOI:10.1016/S0140-6736(19)31388-1. ISSN:0140-6736. PMID:31248662. Archived from the original on 2020-02-14.
- ^ Wesson, Donald E.; Mathur, Vandana; Tangri, Navdeep; Stasiv, Yuri; Parsell, Dawn; Li, Elizabeth; Klaerner, Gerrit; Bushinsky, David A. (6 Apr 2019). "Veverimer versus placebo in patients with metabolic acidosis associated with chronic kidney disease: a multicentre, randomised, double-blind, controlled, phase 3 trial". The Lancet (بالإنجليزية). 393 (10179): 1417–1427. DOI:10.1016/S0140-6736(18)32562-5. ISSN:0140-6736. PMID:30857647. Archived from the original on 2020-02-14.
وصلات إضافية
- http://www.patient.co.uk/doctor/metabolic-acidosis
- http://www.nlm.nih.gov/medlineplus/ency/article/000335.htm
- http://emedicine.medscape.com/article/242975-overview
- http://emedicine.medscape.com/article/768268-overview
- http://www.healthline.com/health/acidosis
| في كومنز صور وملفات عن: حماض أيضي |