اللاعطشية
اللاعطشية: أو ما تعرف أيضًا بنقص العطش هو عبارة عن الامتناع التام أو نقص غير طبيعي في الشعور بالعطش أو الرغبة في شرب المياه. [1] [2] وهو يتضمن زيادة تركيز الأملاح في البول، الذي يحفز إفراز الهرمون المضاد لإدرار للبول (ADH) من تحت المهاد إلى الكلى. وهذا ما يجعل الشخص يحتفظ بالماء في جسمه ويصبح غير قادر في نهاية المطاف على الشعور بالعطش. وبسبب ندرة هذا الاضطراب، لم يكن موضوعاً للعديد من الدراسات البحثية.
| اللاعطشية | |
|---|---|
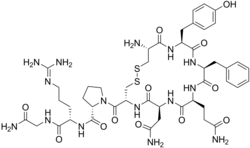
التركيب الجزيئي للفسوبريسين, يرتبط هذا الهرمون بنوع أ ونوع ب من اللاعطشية
| |
| تسميات أخرى | hypodipsia |
| تعديل مصدري - تعديل | |
يمكن رؤية اللاعطشية في حالات مثل مرض السكري الكاذب [3] ويمكن أن يؤدي إلى الهايبرناترميا . [4] ويمكن أن يحدث نتيجة مشاكل في تحت المهاد، الغدة النخامية أو الجسم الصلب، [5] وكذلك بعد جراحة الغدة النخامية/تحت المهاد. [6]
من الممكن أن يكون الخلل الوظيفي في تحت المهاد الذي قد يؤدي إلى حدوث اللاعطشية غير مصاحب لوجود أي إصابات في نقص المهاد، على الرغم من أنه لا توجد سوى أربع حالات تم الإبلاغ عنها من هذا. [7] وهناك أيضا بعض حالات المرضى الذين يعانون من اللاعطشية بسبب مرض نفسي. وفي هذه الحالات النفسية النادرة يكون لدى المرضى مستويات طبيعية من تركيز البول وكذلك نشاط طبيعي من الهرمون المضاد لإدرار البول (ADH). [8]
السبب
الدوبامين
يرتبط الناقل العصبي الذي يعرف باسم الدوبامين بأنماط التغذية. في إحدى التجارب، قام العلماء بقياس كمية الغذاء والماء المستهلكة بالنسبة الفئران عندما يولدوا بدون دوبامين في أجسامهم. وقد وجدوا أنه بدون الدوبامين، فإن الفئران سوف تتضور جوعًا وعطشًا إلى حد الموت. ثم حقن العلماء الفئران بالدوبامين وبسلائفه، فبدأت الفئران في تناول الطعام من جديد. وعلى الرغم من أن الفئران ولدت من دون الدوبامين في أنظمتها، فإنها لا تزال تتمتع بالقدرة على التحكم في سلوكيات التغذية والشرب، وهو ما يشير إلى أن الدوبامين لا يلعب دوراً في تطوير هذه الدوائر العصبية. وبدلاً من ذلك فإن الدوبامين يرتبط ارتباطاً وثيقاً بالدافع إلى الجوع والعطش. وعلى الرغم من أن نقص الدوبامين قد أدى إلى ظهور اللاعطشية في هذه الفئران، إلا أن انخفاض مستويات الدوبامين لا يسبب بالضرورة حدوث هذا المرض. [9]
ومن بين النتائج الأخرى التي تم التوصل إليها دعماً لدور الدوبامين في تنظيم الظمأ تتضمن المسار العصبي الأسود. بعد ضمور المسار تمامًا، يفقد الحيوان رغبته في الشراب والطعام ويفقد اهتمامه بالاستكشاف. وعلى الرغم من أن الدوبامين يلعب دوراً في اللاعطشية، إلا أنه لا يوجد بحث يوضح بالخصوص العلاقة بين الدوبامين واللاعطشية، حيث أن التغيرات في الدوبامين تؤدي في الوقت نفسه إلى تغيرات في تناول الطعام والفضول، بالإضافة إلى العطش. [10]
الغدة النخامية
تقع منطقة التي تنظم العطش في الدماغ في الجزء الأمامي من تحت المهاد. يقع الجزيء الأمامي من تحت المهاد بالقرب من المستقبلات الأسموزية التي تنظم إفراز الهرمون المضاد للإدرار للبول (ADH). فإفراز هذا الهرمون هو أحد الآليات الرئيسية التي يتم من خلالها تنظيم الصوديوم والاتزان الداخلي لتركيزات الأملاح، كما يتم إفراز ADH عند وجود زيادات صغيرة في تركيز الأملاح في الدم. فيتم تحفيز العطش من خلال زيادة تركيز الأملاح في الدم بالإضافة إلى زيادة إفراز ADH. تحافظ كل من تركيزات الأملاح في الدم والهرمون المضاد لإدرار البول (ADH) على مستويات طبيعية من أسمولية الدم.
يمكن أن تنتج اللاعطشية من إصابات في منطقة تحت المهاد المسئولة عن تنظيم العطش. هذه الإصابات يمكن أن تكون خلقية، مكتسبة، صدمات، أو حتى حراجية. تؤدي الإصابات التي تتضمن تلك المناطق من تحت المهاد إلى الإصابة بداء اللاعطشية لأنها تتسبب في عيوب في مركز تنظيم العطش. الإصابات في تلك المنطقة يمكن أيضا أن تسبب في اللاعطشية بسبب القرب شديد من بين تحت المهاد والمستقبلات الاسموزية المتحكمة في إفراز الهرمون المضاد لإدرار البول (ADH). [8]
التشخيص
الأعراض
تشخيص اللاعطشية يمكن أن يكون صعبا حيث أنه لا توجد مجموعة من العلامات المحددة المخصصة لهذا المرض. وتشمل التغيرات في الدماغ التي تشير إلى حدوث اللاعطشية سرعة التنفس، وضعف العضلات، والأرق، والفتور، والتشنجات (على الرغم من أنها غير شائعة إلا في الحالات القصوى من الإماهة السريعة جدًا). المرضى الذين لديهم تاريخ من أورام الدماغ، أو التشوهات الخلقية، قد يكون لديهم إصابات في تحت المهاد، والتي يمكن أن تكون مؤشرا على اللاعطشية. [4] بعض البالغين مع النوع الأولي من اللاعطشية قد يعانون من فقدان الشهية بالإضافة إلى الأعراض الأخرى . [11]
الاختبار
ييتضمن الاختبار المبدئي للاعطشية مستويات الكهارل ونيتروجين اليوريا (BUN) ومستويات الكرياتينين، الأسمولية ومصل الدم والبول، ومستويات هرمون الدم، مثل فاسوبريسين (AVP). المرضى الذين يعانون من عيوب في تنظيم العطش وإفراز فاسوبريسين يتكون لديهم مستويات منخفضة أو منعدمة من فاسوبريسين المصل. [12] تعد قياسات الشوارد البولية والسمولية مهمة في تحديد طبيعة الخلل في التوازن المائي، وليس الكلوي. في الشحوم، يكون إفراز الصوديوم الكسري أقل من 1 ٪، ما لم يكن هناك عيب في إفراز الAVP. في التسمم بالملح، تكون تركيزات صوديوم البول مرتفعة للغاية، والإفراز الكسري للصوديوم أكبر من 1٪. نتائج الاختبار الأولية قد تكون تشير بمرض السكري . تميل مستويات الAVP المنتشرة إلى أن تكون عالية، مما يشير إلى استجابة مناسبة من الغدة النخامية لفرط حجم الدم. قد يكون لدى المرضى ارتفاعات مستقرة خفيفة لتركيزات الصوديوم في الدم، إلى جانب ارتفاعات في مستويات الBUN والكرياتينين وفي نسب الBUN / كرياتينين. [4]
الخاصيات
نوع أ
يشتمل النوع أ (متلازمة فرط صوديوم الدم الأساسية) على زيادة في المستوى الذي يمكن أن تمر فيه جزيئات المذيبات عبر أغشية الخلايا (العتبة التناضحية) لإطلاق فاسوبريسين وتفعيل الشعور بالعطش. هذا هو النوع الفرعي الأكثر وضوحا من اللاعطشية، ومع ذلك، لا يوجد سبب معروف لاللاعطشية من النوع أ. هناك جدل حول ما إذا كانت إعادة ضبط المستشعرات يمكن أن تؤدي إلى زيادة في العتبة. أظهرت دراسات أخرى أن فقدان المستشعرات، وليس إعادة الضبط، هو الذي يسبب التغير في العتبة. [13] يمكن للمرضى الذين يعانون من الشحوم من النوع أ أن يتعرضوا لخطر النوبات إذا عاودوا ترطيب بسرعة أو إضافة كمية كبيرة من الصوديوم بسرعة إلى أجسامهم. إذا لم يتم علاجها، فقد تؤدي الشحوم من النوع أ إلى انخفاض حجم المخ ونزيف فيه. [11]
النوع ب
ياللاعطشية من النوع ب تحدث عندما تكون استجابات الفاسوبريسين في مستويات منخفضة مع وجود محفزات تناضحية. على الرغم من الحد الأدنى، لا يزال هناك بعض الإفراز للAVP. هذا النوع قد يكون بسبب حد ما من التخلص من مستقبلات التناضج. [13]
النوع ج
مسارات الدوبامين في الدماغ. يتركز إنتاج الدوبامين في الغشائية البطنية. ومنطقة البستانيا نيجرا. تتضمن النوعية ج من اللاعطشية (اختلال وظيفي في جهاز استشعار التذبذب من النمط ج) التخلص التام من المستشعرات، ونتيجة لذلك، لا يكون هناك إفراز فاسوبريسين على عكس الوضع الطبيعي. النوع ج عمومًا هو نوع الشحوم الموجود في مرضى السكري الدهني . [13]
النوع د
النوع (د) هو النوع الأقل شيوعًا الذي يتم تشخيصه والبحث فيه. الAVP المفرز في هذا النوع الفرعي يحدث مع مستويات وظيفية عادة من تنظيم التناضج. [13]
التدبير
يفتقر الأشخاص المصابون باللاعطشية إلى القدرة على الشعور بالعطش، وبالتالي يجب تذكيرهم بالشرب. قد يتلقى الأشخاص المصابون باللاعطشية تدريباً لمعرفة ما إذا كان من الضروري شرب الماء. حاليا، لا يوجد دواء متاح لعلاج اللاعطشية . بالنسبة للأشخاص الذين يعانون اللاعطشية بسبب تلف المهاد، لا يوجد خيار جراحي أو طبي لإصلاح الضرر. في بعض الحالات التي تكون فيها اللاعطشية نتيجة للنمو في مراكز العطش في الدماغ، نجحت الإزالة الجراحية للنمو في علاج اللاعطشية. على الرغم من أنه يجب على الأشخاص المصابون باللاعطشية الحفاظ على جدول زمني صارم لاستهلاك المياه، فإن وجباتهم الغذائية ومشاركتهم في الأنشطة البدنية ليست محدودة. الأشخاص المصابون بداء السكري المزيف لديهم خيار استخدام هرمون ديزموبريسين عن طريق الفم أو أسيتات (DDAVP) ، والذي يشبه جزئياً بما فيه الكفاية لالفاسوبريسين لأداء وظيفته. في هذه الحالة، يساعد الديزموبريسين الكلى على تعزيز امتصاص الماء. [4] أبلغ بعض الأطباء عن نجاحهم في علاج مرضى اللاعطشية النفسيين بالعلاج بالصدمات الكهربائية، على الرغم من أن النتائج مختلطة ولا يزال سبب نجاحها مجهولًا. [8] بالإضافة إلى ذلك، قد يحتاج بعض المرضى الذين لم يكملوا بنجاح العلاج السلوكي إلى أنبوب أنفي معدي للحفاظ على مستويات صحية من السوائل. [8] بالإضافة إلى ذلك، قد يحتاج بعض المرضى الذين لم يكملوا بنجاح العلاج السلوكي إلى أنبوب أنفي معدي للحفاظ على مستويات صحية من السوائل.
المراجع
- ^ "adipsia | pathology". Encyclopædia Britannica. مؤرشف من الأصل في 2017-11-12. اطلع عليه بتاريخ 2016-04-26.
- ^ Lin، M؛ Liu، SJ؛ Lim، IT (أغسطس 2005). "Disorders of water imbalance". Emergency Medicine Clinics of North America. ج. 23 ع. 3: 749–70, ix. DOI:10.1016/j.emc.2005.03.001. PMID:15982544.
- ^ Crowley، R. K.؛ Sherlock، M.؛ Agha، A.؛ Smith، D.؛ Thompson، C. J. (2007). "Clinical insights into adipsic diabetes insipidus: a large case series". Clinical Endocrinology. ج. 66 ع. 4: 475–82. DOI:10.1111/j.1365-2265.2007.02754.x. PMID:17371462.
- ^ أ ب ت ث Dharnidharka، V.R.؛ Langman، C.B. (2014). "Adipsia treatment and management". EMedicine. مؤرشف من الأصل في 2019-07-25.
- ^ Kim، Boo Gyoung؛ Kim، Ka Young؛ Park، Youn Jeong؛ Yang، Keun Suk؛ Kim، Ji Hee؛ Jung، Hee Chan؛ Nam، Hee Chul؛ Kim، Young Ok؛ Yun، Yu Seon (2012). "A Case of Adipsic Hypernatremia Associated with Anomalous Corpus Callosum in Adult with Mental Retardation". Endocrinology and Metabolism. ج. 27 ع. 3: 232–6. DOI:10.3803/EnM.2012.27.3.232.
- ^ Sherlock، M.؛ Agha، A.؛ Crowley، R.؛ Smith، D.؛ Thompson، C. J. (2006). "Adipsic diabetes insipidus following pituitary surgery for a macroprolactinoma". Pituitary. ج. 9 ع. 1: 59–64. DOI:10.1007/s11102-006-8280-x. PMID:16703410.
- ^ Hayek، A؛ Peake، GT (1982). "Hypothalamic adipsia without demonstrable structural lesion". Pediatrics. ج. 70 ع. 2: 275–8. PMID:6808452. مؤرشف من الأصل في 2019-12-07.
- ^ أ ب ت Harrington، C.؛ Grossman، J.؛ Richman، K. (2014). "Psychogenic adipsia presenting as acute kidney injury: case report and review of disorders of sodium and water metabolism in psychiatric illness". Psychosomatics. ج. 55 ع. 3: 289–295. DOI:10.1016/j.psym.2013.06.013. PMID:24012289.
- ^ Zhou، Q.Y.؛ Palmiter، R.D. (1995). "Dopamine-deficient mice are severely hypoactive, adipsic, and aphagic". Cell. ج. 83 ع. 7: 1197–1209. DOI:10.1016/0092-8674(95)90145-0. PMID:8548806.
- ^ Ungerstedt، U. (2014). "Adipsia and Aphagia after 6-Hydroxydopamine induced degeneration of the nigro-striatal dopamine system". Acta Physiologica. 82(S367): 95–122. DOI:10.1111/j.1365-201X.1971.tb11001.x. PMID:4332694.
- ^ أ ب Braun، Michael؛ Barstow، Craig؛ Pyzocha، Natasha (1 مايو 2015). "Diagnosis and management of sodium disorders: Hyponatremia and hypernatremia". American Family Physician. ج. 91 ع. 5: 299–307. PMID:25822386. مؤرشف من الأصل في 2019-08-05. اطلع عليه بتاريخ 2016-04-26.
- ^ "Adipsia Workup: Laboratory Studies, Imaging Studies, Other Tests". emedicine.medscape.com. مؤرشف من الأصل في 2019-07-25. اطلع عليه بتاريخ 2016-04-10.
- ^ أ ب ت ث Holley، A.D.؛ Green، S.؛ Davoren، P. (2007). "Extreme hypernatraemia: a case report and brief review" (PDF). مؤرشف من الأصل (PDF) في 2019-03-14.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة)