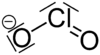
كلوريت
الكلوريت هو أيون صيغته -ClO2 وتسمى المركبات الحاوية على هذا الأيون في تركيبها باسم الكلوريتات. يحتوي هذا الأيون على الكلور في حالة الأكسدة +3؛ وتعد الكلوريتات أملاحاً مشتقة من حمض الكلوروز.
| كلوريت | |
|---|---|
| الاسم النظامي (IUPAC) | |
كلوريت |
|
| المعرفات | |
| رقم CAS | 14998-27-7 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | -ClO2 |
| الكتلة المولية | 67.452 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
من أشهر الأمثلة على أملاح الكلوريتات مركب كلوريت الصوديوم NaClO2، والذي يحضر من تمرير غاز ثنائي أكسيد الكلور في محلول قلوي مؤلف من هيدروكسيد الصوديوم وبيروكسيد الهيدروجين.
الخواص
تعد الكلوريتات أكثر ثباتية واستقراراً من حمض الكلوروز نفسه، وهي الأكثر شهرة من بين أملاح الهالوجينات ذات الصيغة HXO2.[1]
الاستخدمات
يمكن الاستفادة من الخواص المؤكسدة لهذه الأملاح في عمليات التبييض في الصناعات النسيجية.[2]
مراجع
- ^ Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier (ردمك 0-12-352651-5)
- ^ Otto-Albrecht Neumüller (Hrsg.): Römpp Lexikon Chemie Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 466.
| في كومنز صور وملفات عن: كلوريت |