متلازمة زولينجر إيليسون
متلازمة زولينجر-إيليسون (متلازمة زد-إي) (بالإنجليزية: Zollinger-Ellison syndrome) هي مرض تسبب فيه الأورام زيادة إنتاج الحمض في المعدة، ما يؤدي إلى تشكل القرحات الهضمية. تشمل الأعراض الألم البطني والإسهال.
| متلازمة زولينجر إيليسون | |
|---|---|
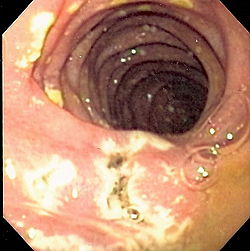
صورة بالتنظير الباطني تظهر عدة قرحات في العفج لمريض مصاب بمتلازمة زولنجر إيليسون
| |
| تعديل مصدري - تعديل |
تنتج المتلازمة عن ورم مفرز للغاسترين (غاسترينوما)، وهو من أورام الغدد العصبية الصماء يفرز هرمون الغاسترين.[1] تؤدي زيادة تركيز الغاسترين في الدم (فرط غاسترين الدم) إلى زيادة إنتاج حمض كلور الماء من قبل الخلايا الجدارية في المعدة. أشيع أماكن ظهور الأورام المفرزة للغاسترين هي العفج والبنكرياس والمعدة.
في 75% من الحالات، تظهر متلازمة زولينجر-إيليسون بشكل عشوائي، في حين تكون في 25% من الحالات جزءًا من متلازمة وراثية جسدية سائدة (غير مرتبطة بالجنس) تعرف باسم النمط الأول من تكون الورم الصماوي المتعدد (متلازمة إم إي إن 1).[2]
الأعراض والعلامات
قد يشكو المصابون بمتلازمة زولينجر-إيليسون من الألم البطني والإسهال.[1] نشك بوجودها أيضًا لدى المرضى المصابين بتقرحات شديدة في المعدة والأمعاء الدقيقة، خصوصًا إذا فشلت محاولات العلاج التقليدي. وتشمل أعراض المتلازمة ما يلي:
الإسهال المزمن والإسهال الدهني.
ألم المريء الذي يشعر به المريض في الصدر والمنطقة الشرسوفية، خصوصًا بين الوجبات وبعد تناول الطعام في الليل.
- الغثيان.
- الوزيز.
- التقيؤ الدموي.
- التغوط الأسود.
- سوء التغذية.
- فقدان الشهية.
- سوء الامتصاص.
قد تظهر الأورام المفرزة للغاسترين كأورام مفردة أو أورام صغيرة متعددة. تكون الأورام المفردة خبيثة بنسبة 50% إلى 67%، وتنتشر بشكل أساسي إلى الكبد والعقد اللمفية قرب البنكرياس والأمعاء الدقيقة.
يملك نحو ربع المصابين بالغاسترينوما أورامًا متعددة في سياق مرض اسمه النمط الأول من تكون الورم الصماوي المتعدد (متلازمة إم إي إن 1). يصاب مرضى هذه المتلازمة بأورام في الغدة النخامية والغدد جارة الدرقية، إضافة إلى أورام البنكرياس مثل الغاسترينوما.[3]
الفيزيولوجيا المرضية
يعمل الغاسترين على الخلايا الجدارية في الغدد المعدية، مؤديًا إلى إفراز المزيد من شوارد الهيدروجين إلى اللمعة. إضافة إلى ذلك، يعمل الغاسترين كعامل نمو للخلايا الجدارية، مؤديًا إلى فرط تنسج الخلايا الجدارية.
في الحالة الطبيعية، يخضع إفراز شوارد الهيدروجين للتحكم بآلية التلقيم الراجع السلبي من خلايا المعدة بغرض الحفاظ على درجة حموضة مناسبة. لكن ورم الغدد العصبية الصماء الموجود لدى مرضى متلازمة زولينجر-إيليسون لا يخضع لأي تقييد، ما يؤدي إلى إفراز كميات كبيرة من الغاسترين.[4][5] وبالتالي تحدث زيادة كبيرة في عدد الخلايا المفرزة للحمض، وتنتج كل منها كميات إضافية. يساهم ارتفاع الحموضة الناتج في إحداث القرحات الهضمية في المعدة والعفج (الجزء الأول من الأمعاء الدقيقة) والصائم (الجزء الثاني من الأمعاء الدقيقة) في بعض الأحيان، وتعرف قرحات الصائم باسم «القرحات غير النموذجية».[6]
التشخيص
يشك الطبيب بوجود متلازمة زولينجر-إيليسون عندما لا تستجيب الأعراض السابقة على العلاج، أو عندما تكون الأعراض موجهة بشكل كبير إلى المتلازمة أو عندما يبدي التنظير الهضمي العلوي مظهرًا وصفيًا للقرحات. يوضع التشخيص اعتمادًا على عدد من الاستقصاءات المخبرية والشعاعية:[7]
- اختبار تحريض الإفراز: والذي يقيس مستويات الغاسترين المحرض. الآلية التي يعتمد عليها هذا الاختبار هي تثبيط الإفراز الفيزيولوجي لهرمون الغاسترين من خلايا جي في المعدة عند إعطاء السيكريتين ، على عكس خلايا الغاسترينوما التي تطلق الغاسترين ردًا على إعطاء السيكريتين،,[8][9] وبالتالي يمكن أن يكون هذا الاختبار حساسًا في التفريق بين الحالتين.
- قياس مستوى الغاسترين الصيامي (على الريق) ثلاث مرات على الأقل.[10]
- الإفراز الحمضي المعدي ودرجة حموضة المعدة (معدل الإفراز الحمضي المعدي الأساسي أقل من 10 ميلي مكافئ في الساعة، أما في متلازمة زولينجر-إيليسون، يكون أكثر من 15 ميلي مكافئ في الساعة).[11]
- ارتفاع مستوى الكروموغرانين أ، وهو واسم ورمي شائع لأورام الغدد العصبية الصماء.
إضافة إلى ذلك، يمكن تحديد مصدر الإنتاج المفرط للغاسترين باستخدام التصوير بالرنين المغناطيسي أو التصوير بالأوكتريوتيد المشع.[12]
العلاج
تُستخدم مثبطات مضخة البروتون (مثل أوميبرازول وبانتوبرازول) ومضادات مستقبلات الهيستامين 2 (مثل فاموتيدين ورانيتيدين) لكبح الإفراز الحمضي. عند كبح إفراز الحمض تتحسن الأعراض عادة. يمكن أخذ العلاج الجراحي لإزالة القرحات الهضمية والأورام المفرزة للغاسترين بعين الاعتبار.[13]
الوبائيات
تؤثر هذه المتلازمة بشكل شائع على الأشخاص بين عمر الثلاثين والستين.[14] معدل الشيوع ليس معروفًا بدقة، لكنه يقدر بنحو واحد من كل 100,000 شخص.[15]
التاريخ
ذكرت تقارير متفرقة حالات غريبة من القرحات الهضمية بوجود الأورام البنكرياسية قبل عام 1955، لكن الجراحين آر إم زولينجر وإي إتش إيليسون من جامعة ولاية أوهايو كانا السباقين لاقتراح علاقة سببية بين هذه الموجودات. شهد اجتماع الجمعية الأمريكية للجراحين في ولاية فيلادلفيا بتاريخ أبريل 1955 أول وصف لهذه المتلازمة، تبع ذلك نشر زولينجر وإيليسون ملاحظاتهما في دورية أنالز أوف سرجري.[16]
مراجع
- ^ أ ب "Zollinger-Ellison syndrome". Mayo Clinic. مؤرشف من الأصل في 2017-10-08. اطلع عليه بتاريخ 2017-02-27.
- ^ Rt, Jensen; B, Niederle; E, Mitry; Jk, Ramage; T, Steinmuller; V, Lewington; A, Scarpa; A, Sundin; A, Perren (2006). "Gastrinoma (Duodenal and Pancreatic)". Neuroendocrinology (بEnglish). 84 (3): 173–82. DOI:10.1159/000098009. PMID:17312377. S2CID:5096249.
- ^ Thakker، Rajesh V. (يونيو 2010). "Multiple endocrine neoplasia type 1 (MEN1)". Best Practice & Research Clinical Endocrinology & Metabolism. ج. 24 ع. 3: 355–370. DOI:10.1016/j.beem.2010.07.003. ISSN:1521-690X. PMID:20833329.
- ^ Cho MS, Kasi A. Zollinger Ellison Syndrome. [Updated 2020 Jun 29]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537344/ نسخة محفوظة 18 مارس 2021 على موقع واي باك مشين.
- ^ Cho، Min S.؛ Kasi، Anup. "Zollinger Ellison Syndrome". In: StatPearls [Internet]. StatPearls Publishing. مؤرشف من الأصل في 2021-03-18. اطلع عليه بتاريخ 2020-12-01.
- ^ Meko, M.D، J. B.؛ Norton, M.D، J. A. (فبراير 1995). "Management of Patients with Zollinger-Ellison Syndrome". Annual Review of Medicine. ج. 46 ع. 1: 395–411. DOI:10.1146/annurev.med.46.1.395. ISSN:0066-4219. PMID:7598474.
- ^ Hennen, Georges (3 Oct 2001). Endocrinologie (بfrançais). De Boeck Supérieur. ISBN:9782804138165. Archived from the original on 2021-03-18.
- ^ Bradley، E L؛ Galambos، J T (1976). "Diagnosis of gastrinoma by the secretin suppression test". Surgery, Gynecology & Obstetrics. ج. 143 ع. 5: 784–8. PMID:982259.
- ^ Chiba، T؛ Yamatani، T؛ Yamaguchi، A؛ Morishita، T؛ Nakamura، A؛ Kadowaki، S؛ Fujita، T (1989). "Mechanism for increase of gastrin release by secretin in Zollinger-Ellison syndrome". Gastroenterology. ج. 96 ع. 6: 1439–44. DOI:10.1016/0016-5085(89)90510-6. PMID:2565843.
- ^ "Zollinger-Ellison Syndrome. Information about ZES Syndrome". Patient.info. مؤرشف من الأصل في 2021-01-15. اطلع عليه بتاريخ 2018-01-14.
- ^ Elizabeth D Agabegi؛ Agabegi, Steven S (2008). Step-Up to Medicine. Step-Up. Hagerstwon, MD: Lippincott Williams & Wilkins. ص. 192. ISBN:978-0-7817-7153-5. مؤرشف من الأصل في 2021-02-27.
- ^ Jensen RT (2004). "Gastrinomas: advances in diagnosis and management". Neuroendocrinology. 80 Suppl 1: 23–7. DOI:10.1159/000080736. PMID:15477712. S2CID:44311651.
- ^ "Zollinger-Ellison syndrome | Genetic and Rare Diseases Information Center (GARD) – an NCATS Program". rarediseases.info.nih.gov. مؤرشف من الأصل في 2020-10-17. اطلع عليه بتاريخ 2018-04-17.
- ^ "Zollinger Ellison Syndrome - NORD (National Organization for Rare Disorders)". Rarediseases.org. مؤرشف من الأصل في 2020-12-08. اطلع عليه بتاريخ 2018-01-14.
- ^ "Orphanet: Zollinger Ellison syndrome". Orpha.net. مؤرشف من الأصل في 2021-02-27. اطلع عليه بتاريخ 2018-01-14.
- ^ Zollinger RM، Ellison EH (1955). "Primary peptic ulcerations of the jejunum associated with islet cell tumors of the pancreas". Ann. Surg. ج. 142 ع. 4: 709–23, discussion, 724–8. DOI:10.1097/00000658-195510000-00015. PMC:1465210. PMID:13259432.
| في كومنز صور وملفات عن: متلازمة زولينجر إيليسون |