|
تضامنًا مع حق الشعب الفلسطيني |
سيتوكروم
تحوي هذه المقالة أو هذا القسم ترجمة آلية. (فبراير 2021) |
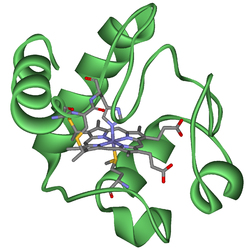
السيتوكرومات (بالإنجليزية: cytochromes) هي بروتينات صبغية موجودة في الخلايا النباتية والحيوانية، تؤدي دوراً رئيسياً في تفاعلات الأكسدة والاختزال،[1] تحتوي على الهيم، في صميمها يوجد ذرة حديد مركزية، كعامل مساعد. كما إنهم يشاركون في سلسلة نقل الإلكترون وحفز الأكسدة والاختزال. تصنف حسب نوع الهيم وطريقة ربطه. يوجد أربعة أصناف تم التعرف عليها في الاتحاد الدولي للكيمياء الحيوية والبيولوجيا الجزيئية (IUBMB)، السيتوكرومات a، السيتوكرومات b، السيتوكرومات c، والسيتوكروم d.[2] ترتبط وظيفة السيتوكروم بتغيير الأكسدة والاختزال العكسي من الحديدوز (Fe (II)) إلى حالة أكسدة الحديد (Fe (III)) للحديد الموجود في لب الهيم.[3] وبجانب تصنيف IUBMB إلى أربع فئات من السيتوكروم، يمكن العثور على العديد من التصنيفات الإضافية مثل السيتوكروم o،[4] والسيتوكروم P450 في الأدبيات الكيميائية الحيوية.
التاريخ
عام 1884 وصف تشارلز ماتمون السيتوكرومات كأصباغ تنفسية (ميوهيماتين أو هيستوهيماتين).[5] في عشرينيات القرن الماضي، تم اكتشاف هذه الصبغات التنفسية من جديد من قبل كيلين وأسماهم السيتوكروم أو «الصبغات الخلوية».[6] قام بتصنيفها على أساس موضع نطاق امتصاصها الأدنى للطاقة في حالتها المخفضة، مثل السيتوكرومات a (650 نانومتر)، سيتوكرومات b (تقريبا 565 نانومتر)، وستوكرومات c (550 نانومتر). ما زالت الأشعة فوق البنفسجية (UV) للتوقيعات الطيفية المرئية للنصوص تستخدم لتحديد نوع الهيم من الحالة المربوطة ثنائية البيريدين المنخفضة، أي طريقة الهيموكروم بيريدين. داخل كل فئة، السيتوكروم a، b ، أو c، يتم ترقيم السيتوكرومات المبكرة على التوالي، مثال: cyt c و cyt c 1 و cyt c 2، مع أمثلة أحدث تم تحديدها بواسطة الحد الأقصى لنطاق R في الحالة المخفض، على سبيل المثال cyt c 559.[7]
التركيب والوظيفة
مجموعة الهيم عبارة عن نظام حلقة مترافق بدرجة عالية (يسمح للإلكترونات أن تتحرك بحرية كبيرة) تحيط بأيون الحديد. يوجد الحديد بالعادة في السيتوكرومات في حالة حديدية (Fe 2+) وحالة حديديك (Fe 3+) مع حالة فيروكسو (Fe 4+) موجودة في وسيطة تحفيزية.[2] وبالتالي، فإن السيتوكرومات قادرة على أداء تفاعلات نقل الإلكترون وتحفيزها عن طريق الأكسدة أو الاختزال لحديد الهيم. يعتمد الموقع الخلوي للسيتوكرومات الخلوية على وظيفتها. يمكن إيجادها كبروتينات كروية وبروتينات غشائية.
في عملية الفسفرة المؤكسدة، يشارك بروتين السيتوكروم cc الكروي في نقل الإلكترون من المركب المرتبط بالغشاء III إلى المركب IV. يتكون المركب الثالث نفسه من عدة وحدات فرعية، أحدها عبارة عن سيتوكروم من النوع b بينما الآخر هو سيتوكروم من النوع c. يشارك كلا المجالين في نقل الإلكترون داخل المركب. يحتوي المركب IV على مجال سيتوكروم a/ a3 ينقل الإلكترونات ويحفز تفاعل الأكسجين مع الماء. يحتوي النظام الضوئي الثاني، وهو أول مركب بروتيني في التفاعلات المعتمدة على الضوء لعملية التمثيل الضوئي الأكسجيني، على وحدة فرعية من السيتوكروم b .Cyclooxygenase 2 (إنزيم الأكسدة الحلقية 2)، وهو إنزيم متورط في الالتهاب، هو بروتين السيتوكروم b.
في أوائل الستينات، تم اقتراح تطور خطي (التطور) للسيتوكرومات من قبل إيمانويل مارغولياش[8] والتي أدت إلى فرضية الساعة الجزيئية. يمكن أن يكون معدل التطور الثابت ظاهريًا للسيتوكرومات الخلوية أداة مفيدة في محاولة تحديد متى قد تكون الكائنات الحية المختلفة قد تباعدت عن سلف مشترك.[9]
أنواع
توجد عدة أنواع من السيتوكروم ويمكن تمييزها عن طريق التحليل الطيفي، والهيكل الدقيق لمجموعة الهيم، وحساسية المانع، وإمكانية الاختزال.[10]
تتميز أربعة أنواع من السيتوكرومات بمجموعاتها الاصطناعية:
| نوع | مجموةه أطراف صناعية |
|---|---|
| السيتوكروم a | الهيم A |
| السيتوكروم b | الهيم B |
| السيتوكروم c | الهيم C (الهيم b التساهمي) [11] |
| السيتوكروم d | الهيم D (Heme B مع γ-سبيرولاكتون)[12] |
لا يوجد «السيتوكروم e»، ولكن السيتوكروم f الموجود في مركب السيتوكروم b 6 وهو السيتوكروم من النوع c.[13]
في الميتوكوندريا والبلاستيدات الخضراء، غالبًا ما يتم دمج هذه السيتوكرومات في نقل الإلكترون والمسارات الأيضية ذات الصلة:[14]
| السيتوكرومات | مزيج |
|---|---|
| a و 3a | أوكسيديز السيتوكروم سي ("المركب الرابع") مع إلكترونات يتم توصيلها إلى المركب بواسطة السيتوكروم ج القابل للذوبان (ومن هنا جاء الاسم) |
| b و c1 | الإنزيم المساعد Q - اختزال السيتوكروم سي ("المركب الثالث") |
| b6 و f | بلاستوكينول - اختزال بلاستوسيانين |
عائلة مميزة من السيتوكرومات هي عائلة السيتوكروم P450، سميت بهذا الاسم نسبة إلى ذروة سورت المميزة التي تشكلت بسبب امتصاص الضوء عند أطوال موجية قريبة من 450 نانومترو هذا يحدث عندما يتم اختزال الحديد الهيم (مع ثنائي ثيونيت الصوديوم) ويتحول إلى أول أكسيد الكربون. تشارك هذه الإنزيمات بشكل أساسي في تكوين الستيرويد وإزالة السموم.[10][15]
المراجع
- ^ Q113378673، ص. 119، QID:Q113378673
- ^ أ ب "Nomenclature Committee of the International Union of Biochemistry (NC-IUB). Nomenclature of electron-transfer proteins. Recommendations 1989". Journal of Biological Chemistry (بEnglish). 267 (1): 665–677. 5 Jan 1992. ISSN:0021-9258. PMID:1309757. Archived from the original on 2019-12-21.
- ^ L.، Lehninger, Albert (2000). Lehninger Principles of Biochemistry (ط. 3rd). New York: Worth Publishers. ISBN:978-1572591530. OCLC:42619569. مؤرشف من الأصل في 2020-07-27.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Puustinen, A.; Wikström, M. (15 Jul 1991). "The heme groups of cytochrome o from Escherichia coli". Proceedings of the National Academy of Sciences (بEnglish). 88 (14): 6122–6126. DOI:10.1073/pnas.88.14.6122. ISSN:0027-8424. PMID:2068092.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help) - ^ Mac Munn, C. A (1886). "Researches on Myohaematin and the Histohaematins". Philosophical Transactions of the Royal Society of London. ج. 177: 267–298. DOI:10.1098/rstl.1886.0007. JSTOR:109482.
- ^ Keilin, D. (1 Aug 1925). "On cytochrome, a respiratory pigment, common to animals, yeast, and higher plants". Proc. R. Soc. Lond. B (بEnglish). 98 (690): 312–339. DOI:10.1098/rspb.1925.0039. ISSN:0950-1193.
- ^ Reedy, C. J.؛ Gibney, B. R. (فبراير 2004). "Heme protein assemblies". Chem Rev. ج. 104 ع. 2: 617–49. DOI:10.1021/cr0206115. PMID:14871137.
- ^ Margoliash، E. (1963). "Primary Structure and Evolution of Cytochrome C". Proceedings of the National Academy of Sciences of the United States of America. ج. 50 ع. 4: 672–679. DOI:10.1073/pnas.50.4.672. ISSN:0027-8424. PMID:14077496.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Kumar، Sudhir (2005). "Molecular clocks: four decades of evolution". Nature Reviews. Genetics. ج. 6 ع. 8: 654–662. DOI:10.1038/nrg1659. ISSN:1471-0056. PMID:16136655.
- ^ أ ب "Investigation of biological oxidation, oxidative phosphorylation and ATP synthesis. Inhibitor and Uncouplers of oxidative phosphorylation". مؤرشف من الأصل في 2020-06-28. اطلع عليه بتاريخ 2020-02-02.
- ^ Cytochrome+c+Group في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH). .
- ^ Murshudov، G.؛ Grebenko، A.؛ Barynin، V.؛ Dauter، Z.؛ Wilson، K.؛ Vainshtein، B.؛ Melik-Adamyan، W.؛ Bravo، J.؛ Ferrán، J. (1996). "Structure of the heme d of Penicillium vitale and Escherichia coli catalases". The Journal of Biological Chemistry. ج. 271 ع. 15: 8863–8868. DOI:10.1074/jbc.271.15.8863. PMID:8621527.
- ^ Bendall, Derek S. (2004). "The Unfinished Story of Cytochrome f". Photosynthesis Research (بEnglish). 80 (1–3): 265–276. DOI:10.1023/b:pres.0000030454.23940.f9. ISSN:0166-8595. PMID:16328825.
- ^ Doidge، Norman (2015). The brain's way of healing : remarkable discoveries and recoveries from the frontiers of neuroplasticity. Penguin Group. ص. 173. ISBN:978-0-698-19143-3.
- ^ Miller، Walter L.؛ Gucev، Zoran S. (2014)، "Disorders in the Initial Steps in Steroidogenesis"، Genetic Steroid Disorders، Elsevier، ص. 145–164، DOI:10.1016/b978-0-12-416006-4.00011-9، ISBN:9780124160064
| سيتوكروم في المشاريع الشقيقة: | |