|
تضامنًا مع حق الشعب الفلسطيني |
إنثالبي قياسي للتكوين
انثالبي قياسي للتكوين أو الحرارة القياسية للتكوين في الكيمياء (بالإنجليزية: standard enthalpy of formation أو standard heat of formation) .[1][2] الإنثالبي القياسي لتكوين مركب كيميائي هو التغير في الإنثالبي المصاحب لتكوين 1 مول من مركب من العناصر المكونة له . ويحسب هذا التغير في الإنثالبي بين المواد الداخلة في التفاعل والمادة (أو المواد) الناتجة من التفاعل من حالات كل منها تحت الظروف العادية لدرجة الحرارة و الضغط . تحت تلك الظروف نوصف «الحالة القياسية» لأي مادة، وعندما تكون المادة في حالتها القياسية فهي تكون في أكثر حالاتها استقرارا وتحت ظروف 1 ضغط جوي و درجة حرارة 25 درجة مئوية (تعادل 25و298 كلفن) . ونرمز لها بالرمز ΔHfO أو ΔfHO.
على سبيل المثال، يمكن حساب الحرارة القياسية لتكوين ثاني أكسيد الكربون من تغير الإنثالبي في المعادلة التالية مع افتراض الحالة القياسية لكل من المواد طبقا للظروف العادية المذكورة أعلاه :
- C(s,graphite) + O2(g) → CO2(g)
يقاس الإنثالبي القياسي للتكوين بوحدة طاقة لكمية معينة من المادة . ونستخدم في معظم الأحوال وحدة كيلوجول/مول ، ويمكن أن نصادفها في الكتب كيلوجول/كيلوجرام.
ونظرا لأن تلك الوحدة كبير جدا عندما نتعامل مع الذرات و الأيونات و الجزيئات فيستخدم الفيزيائيون وحدة أصغر من ذلك وهي وحدة إلكترون فولت للجسيم الواحد وهي تعادل نحو 100 كيلوجول مول−1 ، وهذه هي كمية الطاقة التي تنطبق على 1 مول من الجسيمات أي ل عدد أفوجادرو من الجسيمات .
طبقا لتعريف الإنثالبي القياسي فإننا نعتبر جميع العناصر في حالتها القياسية (25 درجة مئوية و 1 ضغط جوي) ، فيكون الأكسجين في حالة غازية (g) و الكربون في حالة صلبة (s) فهو في هيئة جرافيت ، وهما في تلك الحالة لهم انثالبي قياسي للتكوين مساويا للصفر . أما ثاني أكسيد الكربون (g) الناتج فقد نشأ عن ترابط الكربون بالأكسجين وهو تغير للإنثالبية حيث أصبح مركبا .
خطوات التفاعل
الإنثالبي القياسي للتكوين يساوي مجموع تغيرات الطاقة في عمليات منفردة تتلو الواحدة الأخرى حتي نحصل على المركب الناتج من المواد الداخلة في التفاعل طبقا لدورة بورن-هابر للتفاعل . فعلى سبيل المثال سنقوم بحساب الإنثالبي القياسي لتكوين كلوريد الصوديوم ، ويسير التفاعل كالآتي:
- ( Na(s) + (1/2)Cl2(g) → NaCl(s
تعني ( s ) الحالة الصلبة و (g) غاز .
يسير هذا التفاعل على خطوات تتضمن تأين المواد الداخلة في التفاعل وأنفصال إلكترونات عن ذرات ثم اتحاد أيونات لتشكيل المركب الناتج المتعادل كهربيا . وخطوات التفاعل تسير كالآتي بالتفصيل :
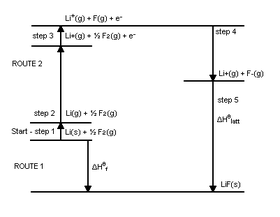
- إنثالبي قياسي لتكوين ذرات منفصلة (من مادة الصوديوم البلورية أصلا)،
- طاقة التأين الأولى للصوديوم الغازي،
- إنثالي قياسي لتكوين ذرات منفصلة لغاز الكلور،
- التقاط ذرة الكلور لإلكترون،
- إنثالبي المشبك (البلوري) لكلوريد الصوديوم .
وبجمع جميع طاقات تلك الخطوات نحصل على الإنثالبي القياسي لتكوين كلوريد الصوديوم.
ويبين لنا تطبيق قانون هس أن مجموع الخطوات المتتالية للتفاعل المعادلة إلى التغير في أنثالبي التكوين لكل عنصر في التفاعل تساوي التغير في الإنثالبي للتفاعل ككل، بصرف النظر عن عدد الخطوات أو التفاعلات الوسطية . وفي مثالنا هنا يكون الإمثالبي القياسي لتكوين كلوريد الصوديوم مساويا لمجموع تغيرات الإنثالبي القياسي لكل خطوة من خطوات التفاعل. تفيدنا هذه الطريقة بصفة خاصة لتحليل التفاعلات المعقدة التي تمر عبر عدة من النواتج الوسطية حتى نحصل على المركب المرغوب .
يستخدم الكيميائيون الإنثالبي القياسي للتكوين حتى لدراسة أي تفاعل افتراضي . وعلى سبيل المثال، تفاعل الكربون و الهيدروجين فهما لن يتفاعلا من تلقاء نفسهما لتكوين الميثان ، وإنما عُيّن الإنثالبي القياسي للتكوينه الذي يبلغ -8و74 كيلوجول/مول عن طريق استخدام الإنثالبي القياسي من تفاعلات أخرى بواسطة قانون هس. وتبين الإشارة السالبة لهذا الإنثالبي أن التفاعل تفاعل ناشر للحرارة ، أي أن مركب الميثان هو أكثر استقرارا من وجهة الإنثالبية عن غاز الهيدروجين و الكربون.
الإنثالبي القياسي للتفاعل
يستخدم الإنثالبي القياسي للتكوين في الكيمياء الحرارية بغرض الحصول على تغير الإنثالبي القياسي لتفاعل ما . ونجري ذلك عن طريق طرح مجموع الإنثالبي القياسي للتكوين لكل من المواد الداخلة في التفاعل ( وكل منها يضرب في معامل نسبتها ν (حساب العناصر المتفاعلة ) ) من مجموع الإنثالبي القياسي لتكوين المواد الناتجة من التفاعل (وهذه أيضا نضربها في معامل نسبة وجودها في التفاعل ) طبقا للمعادلة التالية.
نفترض تفاعل الميثان و الأكسجين حيث ينتج عن التفاعل غاز أول أكسيد الكربون و الماء (بخار):
- CH4 + 2 O2 → CO2 + 2 H2O:
- ( ΔHr° = [(1 × ΔHf°(CO2)) + (2 × ΔHf°(H2O))] (products) - [(1 × ΔHf°(CH4)) + (2 × ΔHf°(O2))] (reactants
فإذا كان مجموع الإنثالبي القياسي لتكوين النواتج أقل من مجموع الإنثالبي القياسي لتكوين المواد الداخلة في التفاعل فسيكون الإنثالبي القياسي للتفاعل سالب الإشارة . وهذ يعني أن التفاعل يكون تفاعلا ناشرا للحرارة. بالعكس إذا كان الأنثالبي القياسي للتفاعل موجب الإشارة فهدا معناه أن التفاعل يكون تفاعلا ممتصا للحرارة ، أي لا يسير مثل هذا التفاعل إلا بتسخينه من الخارج .
تفاعلات مشابهة
- انثالبي قياسي للتعادل وهو التغير في الإنثالبي عند تعادل حمض و قاعدة وتكوين 1 مول من الماء تحت الظروف القياسية، الموصوفة أعلاه .
- الإنثالبي القياسي للتسامي وهو الإنثالبي اللازم لتسامي 1 مول من المادة تحت الظروف القياسية سالفة الذكر،
- انثالبي قياسي للذوبان وهو تغير الإنثالبي بتفكك الجزيئات المصاحب لذوبان مركب في سائل تحت ضغط ثابت والظروف القياسية المعرفة أعلاه .
- الإنثالبي القياسي لإضافة هيدروجين : وهو تغير الإنثالبي الناشيئ عن إضافة هيدروجين إلى مركب غير مشبع بالهيدروجين حتى يصبح مشبعا بالهيدروجين تحت الظروف القياسية سالفة الذكر.
الإنثالبي القياسي لبعض العناصر والمركبات
- تنطبق تلك القيم عند 25 درجة مئوية، و 1 ضغط جوي.
| مركب كيميائي | طور (مادة) | صيغة كيميائية | Δ Hf0 كيلو جول/مول |
|---|---|---|---|
| أمونيا (هيدروكسيد الأمونيا ) | aq | NH3 (NH4OH) | -80.8 |
| أمونيا | g | NH3 | -46.1 |
| سلفات النحاس | aq | CuSO4 | -769.98 |
| كربونات الصوديوم | s | Na2CO3 | -1131 |
| كلوريد الصوديوم (ملح الطعام) | aq | NaCl | -407 |
| كلوريد الصوديوم (ملح الطعام) | s | NaCl | -411.12 |
| كلوريد الصوديوم(ملح الطعام) | l | NaCl | -385.92 |
| كلوريد الصوديوم(ملح الطعام) | g | NaCl | -181.42 |
| هيدروكسيد الصوديوم | aq | NaOH | -469.6 |
| هيدروكسيد الصوديوم | s | NaOH | -426.7 |
| نترات الصوديوم | aq | NaNO3 | -446.2 |
| نترات الصوديوم | s | NaNO3 | -424.8 |
| ثاني أكسيد الكبريت | g | SO2 | -297 |
| حمض الكبريتيك | l | H2SO4 | -814 |
| السيليكا | s | SiO2 | -911 |
| ثاني أكسيد النيتروجين | g | NO2 | +33 |
| أول أكسيد النيتروجين | g | NO | +90 |
| الماء | سائل | H2O | -285.8 |
| ماء | غاز | H2O | -241.82 |
| ثاني أكسيد الكربون | g | CO2 | -393.5 |
| الهيدروجين | g | H2 | 0 |
| الفلور | g | F2 | 0 |
| الكلور | g | Cl2 | 0 |
| البروم | l | Br2 | 0 |
| البروم | g | Br2 | +31 |
| اليود | s | I2 | 0 |
| اليود | g | I2 | +62 |
| سلفات الزنك | aq | ZnSO4 | -980.14 |
- (طور المادة: g = غاز; l = سائل ; s = صلب ; aq = محلول مائي)
- ^ "معلومات عن انثالبي قياسي للتكوين على موقع zthiztegia.elhuyar.eus". zthiztegia.elhuyar.eus. مؤرشف من الأصل في 2019-12-13.
- ^ "معلومات عن انثالبي قياسي للتكوين على موقع jstor.org". jstor.org. مؤرشف من الأصل في 2020-01-26.