|
تضامنًا مع حق الشعب الفلسطيني |
فورمات الأمونيوم
| فورمات الأمونيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
فورمات الأمونيوم |
|
| أسماء أخرى | |
نملات الأمونيوم |
|
| المعرفات | |
| رقم CAS | 540-69-2 |
| الخواص | |
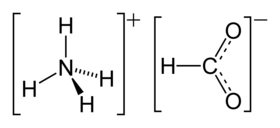
| الصيغة الجزيئية | NH4HCO2 |
| الكتلة المولية | 63.0559 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 1.280 غ/سم3 |
| نقطة الانصهار | 116 °س |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | 143 غ/100 مل ماء |
| الذوبانية | الكحولات والإيثر |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
فورمات الأمونيوم أو نملات الأمونيوم مركب كيميائي له الصيغة NH4HCO2 ، وهو ملح الأمونيوم لحمض الفورميك (حمض النمل) ، ويكون على شكل بلورات عديمة اللون .
الخواص
- انحلالية مركب فورمات الأمونيوم عالية جداً في الماء، حيث تبلغ 102 غ لكل 100 مل ماء عند الدرجة 0°س. تزداد الانحلالية بشكل ملحوظ بارتفاع درجة الحرارة حيث تبلغ 531 غ لكل 100 مل ماء عند الدرجة 80°س.
- ينحل مركب فورمات الأمونيوم أيضاً في الكحولات وفي الإيثر الإيثيلي.
- يؤدي تسخين المركب إلى حدوث تفكك حراري للمركب حيث يحرر الأمونياك وثنائي أكسيد الكربون بالإضافة إلى الماء.
التحضير
يحضر مركب فورمات الأمونيوم من تفاعل غاز الأمونياك مع حمض الفورميك حسب المعادلة:
- NH3 + HCOOH → HCOONH4
أو من تفاعل فورمات الميثيل مع الأمونياك حيث نحصل على أمين الميثيل
- 2NH3 + HCOOCH3 → HCOONH4 + CH3NH2
الاستخدامات
يستخدم مركب فورمات الأمونيوم في الكيمياء التحليلية لفصل الفلزات القاعدية (فلزات غير نبيلة) من أملاح الفلزات النبيلة.
المصادر
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
المراجع
- ^ Ammonium formate for mass spectrometry, ≥99.0% | Sigma-Aldrich نسخة محفوظة 9 سبتمبر 2020 على موقع واي باك مشين.
| في كومنز صور وملفات عن: فورمات الأمونيوم |