|
تضامنًا مع حق الشعب الفلسطيني |
داء الريسوس
| Rh disease | |
|---|---|
| تعديل مصدري - تعديل |
داء الريسوس المعروف أيضا باسم المناعة المتماثلة لريسوس (بالإنجليزية: rhesus isoimmunisation)، داء (دي) ريسوس، عدم توافق عامل ريسوس، ومرض ريسوس، المرض الانحلالي ريسوس (دي) لحديثي الولادة، المرض الانحلالي آر اتش دي لحديثي الولادة) هو نوع من المرض الانحلالي عند حديثي الولادة. ويتراوح هذا المرض من البسيط إلى الحاد، يحدث عادة في بعض حالات الحمل الثاني أو ما بعده عند النساء سلبية العامل ريسوس (ره-) حيث والد الجنين إيجابي عامل ريسوس (ره+)، مما يؤدي إلى جنين إيجابي عامل ريسوس (ره+). أثناء الولادة، قد تتعرض الأم إلى دم الرضيع، مما يتسبب في تكوين أجسام مضادة، والتي قد تؤثر على صحة الحمل التالي الموجب العامل ريسوس. في الحالات الخفيفة، قد يعاني الجنين من فقر دم خفيف مع كثرة الشبكيات. في الحالات المتوسطة أو الشديدة قد يعاني الجنين من فقر دم ملحوظ وكثرة أرومات الحمر الجنينية (المرض الانحلالي لحديثي الولادة). عندما يكون المرض شديدا جدا فإنه قد يسبب موه الجنين أو ولادة جنين ميت.
مرض ريسوس يمكن الوقاية منه بشكل عام عن طريق علاج الأم أثناء فترة الحمل أو خلال وقت قصير بعد الولادة مع الحقن العضلي بالغلوبولين المناعي المضاد (ره) دي الجلوبيولين المناعي). يتم ترميز البروتين RHD بواسطة الجينات RHD.
علم الأمصال
خلال أي حمل يمكن لكمية صغيرة من دم الطفل أن تدخل الدورة الدموية للأم. إذا كانت الأم سلبية العامل ريسوس (ره -) والطفل إيجابي العامل ريسوس (ره +)، تنتج الأم الأجسام المضادة (بما في ذلك الجلوبيولين المناعي جي) ضد العامل D ريسوس على خلايا الدم الحمراء للطفل. خلال هذا والأحمال اللاحقة يكون الجلوبيولين المناعي جي قادر على المرور عبر المشيمة إلى الجنين وإذا كان بكمية كافية، فإن ذلك سيكون سببا في تدمير خلايا الدم الحمراء للجنين الإيجابية العامل ريسوس (دي)، مما يؤدي إلى حدوث داء الريسوس. وبالتالي يمكن اعتبار أن التحمّل المناعي غير كافي في الحمل. عموما مرض الريسوس يصبح أسوأ مع كل حمل إضافي عوامل ريسوس به غير متوافقة.
الحدث المحفز الرئيسي والأكثر شيوعا هو ولادة الطفل (حوالي 86٪ من حالات الإصابة)، ولكن دم الجنين قد يمر إلى الدورة الدموية للأم في وقت سابق أثناء الحمل (حوالي 14٪ من الحالات الإصابة).[1] وتشمل الأحداث المحفزة خلال فترة الحمل الولادة القيصرية والإجهاض، والإجهاض العلاجي، بزل السلى، والحمل خارج الرحم، الاصطدام في منطقة البطن والتحويل الرأسي الخارجي. مع ذلك، في كثير من الحالات لم يكن هناك حدث محفز واضح.
يعتمد معدل الإصابة بداء الريسوس في شريحة ما من السكان يعتمد على النسبة السالبة العامل ريسوس. كثير من الشعوب غير القوقازية لديها نسبة منخفضة جدا من سالبي العامل ريسوس، وبالتالي فإن نسبة حدوث مرض الريسوس منخفضة جدا في هؤلاء السكان.بينما في شعوب القوقاز حوالي 1 من 10 من جميع حالات الحمل هي امرأة سلبية ريسوس مع جنين إيجابي ريسوس. ومن النادر جدا أن يتأثر الطفل الأول الإيجابي الريسوس لامرأة سلبية الريسوس بمرض الريسوس. الحمل الأول بطفل إيجابي ريسوس مهم بالنسبة للمرأة السلبية ريسوس لأنها يمكن أن تتحفز ضد العامل ريسوس الموجب. في شعوب القوقاز نحو 13٪ من الأمهات سلبية الريسوس تتحفز من أول حمل لها بطفل إيجابي ريسوس. لولا وجود الوقاية والعلاج الحديث، لوجدنا أن حوالي 5٪ من الأحمال الثانية موجبة العامل ريسوس من النساء السلبية الريسوس تتعرض إلى موت الجنين داخل الرحم أو ولادة رضيع في غاية المرض أو كثير من الأطفال الذين يتمكنون من البقاء على قيد الحياة في حالات مرضية شديدة. وسترتفع معدلات المرض أكثر في الرضع إيجابية ريسوس في الحمل الثالث وما بعده من النساء سلبية الريسوس. انخفضت معدلات الإصابة بشكل كبير بعد استخدام الجلوبيولين المناعي المضاد RHD (رو (دي) الجلوبيولين المناعي).
تزداد احتمالية حدوث داء الريسوس حوالي 10 مرات إذا كان الجنين متوافق من حيث فصيلة الدم (ABO) مع الأم من إذا كانا الأم والجنين غير متوافقين في فصيلة الدم.
الوقاية
معظم حالات مرض الريسوس يمكن منعها عن طريق علاج الأم أثناء الحمل أو على وجه السرعة (خلال 72 ساعة) بعد الولادة. تحصل الأم على حقن عضلي من الأجسام المضادة لعامل ريسوس (رو (دي) الجلوبيولين المناعي). يتم ذلك عن طريق تدمير كريات الدم الحمراء الإيجابية الريسوس دي القادمة من الجنين قبل أن يكتشفها الجهاز المناعي للأم. هذه هي المناعة السلبية وسوف يزول التاثير المناعي بعد حوالي 4-6 أسابيع (أو أكثر اعتمادا على جرعة الحقن)، حيث تخنفض الأجسام المضادة لعامل الريسوس تدريجيا إلى الصفر في دم الأم.
جزء من الرعاية الحديثة قبل الولادة إعطاء كل النساء الحوامل السلبية العامل ريسوس حقن من الجلوبيولين المناعي (جي) المضاد لـRHD في حوالي 28 أسبوعا من الحمل (مع أو بدون جرعة منشطة في 34 أسبوعا من الحمل). وهذا يقلل من تأثير الغالبية العظمى من الأحداث المحفزة للمرض، والتي تحدث في الغالب بعد 28 أسبوعا من الحمل. يمكن إعطاء مضاد-دي لجميع النساء الحوامل سلبية الريسوس يعني إعطائها للأمهات الذين لا يحتجن إليها (حيث يكون طفلها سلبي الريسوس أو أن دمائهما لا تختلطان).[2] العديد من البلدان تعطي بشكل روتيني مضاد (دي) للنساء السلبية الريسوس في الحمل. في بلدان أخرى، يمكن أن مخزون المضاد لل (دي) قليل أو حتى نافد.[2] فقبل أن يصبح إعطاء مضاد (دي) روتينيا في هذه البلدان، ينبغي أن يكون المخزون متاح بسهولة بحيث يكون متاحا للنساء اللائي يحتجن مضاد (دي) في حالة الطوارئ.[2]
تبين من استعراض الأبحاث الحديثة أن إعطاء مضاد-دي لجميع النساء الحوامل السلبية ريسوس له فائدة ضئيلة.[2] إلا أن الأبحاث أشارت إلى أن خطر إنتاج الأم لأجسام مضادة لمهاجمة عامل ريسوس في خلايا الجنين الإيجابية كان أقل لدى الأمهات الذين تلقوا مضاد (دي) أثناء الحمل.[2] كان هناك أيضا عدد أقل من الأمهات مع نتائج موجبة لاختبار كلايهاور (الذي يظهر إذا اختلط دم الأم ودم الطفل الذي لم يولد بعد).[2] وأيضا يُعطى مضاد RHD المناعي للنساء السلبية ريسوس غير المحفزة للمرض فورا (في غضون 72 ساعة، الأسرع أفضل) بعد المحتمل الأحداث التي قد تكون محفزة في وقت سابق من الحمل.
اختبارات الدم
دم الأم
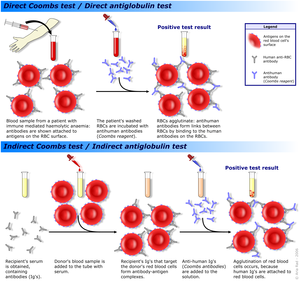
- اختبار كلايهاور- بتكي أو قياس التدفق الخلوي على عينة دم الأم بعد الولادة يمكن أن يؤكد أن دم الجنين قد مر في الدورة الدموية للأم ويمكن أيضا أن يستخدم لتقدير كمية دم الجنين الذي اجتاز الدورة الدموية للأم.
- يستخدم اختبار كومبس غير المباشر لفحص الدم من النساء قبل الولادة عن الأجسام المضادة للجلوبيولين المناعي (جي) التي قد تمر عبر المشيمة وتسبب المرض الانحلالي عند الوليد.
دم الجنين (أو دم الحبل السري)
- يستخدم اختبار كومبس المباشر للتأكد من أن الجنين أو الوليد لديه فقر الدم الانحلالي الناتج عن المناعة.
- مستوى الهيموجلوبين في عد الدم الكامل وعدد الصفائح الدموية مهمة كذلك.
- البيليروبين (الكلي وغير المباشر)
العلاج
مرحلة ما قبل الولادة
- سلسلة فحوصات الموجات فوق الصوتية والدوبلر: للكشف عن علامات فقر دم الجنين مثل زيادة سرعات تدفق الدم ومراقبة تموه الجنين
- التحليل الكمي للأجسام المضادة RHD عند الأم: ارتفاع المستوى علامة على مرض الريسوس لدى الجنين
- نقل الدم داخل الرحم:
- نقل الدم داخل الغشاء البريتوني ــ نقل الدم في بطن الجنين
- نقل الدم داخل الأوعية: الدم المنقول إلى الوريد السُرّي للجنين وهذا هو الأسلوب المفضل منذ أواخر 1980s، وأكثر فعالية من النقل داخل الغشاء البريتوني. يمكن أخذ عينة من دم الجنين من الوريد السري قبل نقل الدم.
- الولادة المبكرة (عادة بعد حوالي 36 أسبوعا من الحمل)
بعد الولادة
- العلاج اليرقان الوليدي بالضوء في المرض البسيط
- تبديل الدم إذا كان الوليد يعاني من مرض متوسط أو شديد (الدم المستخدم في نقل الدم يجب أن يكون عمره أقل من أسبوع، سالب العامل ريسوس، فصيلة الدم متوافقة مع كل من الجنين والأم، ويجب أن يتوافق عكس بلازما الأم)
تاريخ التقدم الطبي في داء الريسوس
تم اكتشاف فصيلة الدم ريسوس لأول مرة في عام 1937 على يد كارل لاندشتاينر والكسندر س. وينر، [3] اللذان أدرجاها وجنبا إلى جنب مع جداول فصائل الدم، والتوافق بين الفصائل.
في عام 1939 نشر كلا من فيليب ليفين وروفوس إ.استيتسون النتائج التي توصلا إليها حول الأسرة التي شهدت ولادة طفل ميت حيث لقى حتفه إثر مرض انحلالي في حديثي الولادة.[4] كانت الأم في عمر 25 وكان هذا هو الحمل الثاني لها وعانت من فقدان الدم أثناء الولادة. وكان كلا الوالدين من فصيلة الدم O، واستخدم دم الزوج للأم خلال عملية نقل الدم، ولكن الأم عانت من ردة فعل حادة بسبب نقل الدم. درس الباحثون رد الفعل الناتج عن نقل الدم. وبما أن الأم والأب من نفس فصيلة الدم O، خلصوا إلى أنه يجب أن يكون هناك مستضد لفصيلة الدم غير مكتشف سابقا موجود في كرات الدم الحمراء عند الزوج (خلايا الدم الحمراء)، ولكن لم يكن حاضرا في كرات الدم الحمراء للأم وأن الأم قد شكلت أجسام مضادة للمستضد الجديد في فصيلة الدم. اقترح هذا لأول مرة أن الأم يمكن أن تكون الأجسام المضادة لفصيلة الدم بسبب التحفيز المناعي ضد كرات الدم الحمراء للجنين. لم يقوموا بتسمية مستضد فصيلة الدم، ولكن تبين فيما بعد أنه العامل ريسوس.
كان العلاج الأول لداء الريسوس هو تبديل الدم، الذي اخترعه الكسندر س. وينر. وقد تم تطوير هذا العلاج من قبل هاري والرشتاين، [5] وهو طبيب نقل دم. على الرغم من أن الأسلوب الأكثر فعالية لعلاج المشكلة في ذلك الوقت، كان فقط تحسينا جزئيا في حالات قد تحقق بها ضررا للوليد بالفعل. كان يمكن أن ينتج عنه أطفال عانون من تلف حركي شديد و / أو تخلف. ومع ذلك، تشير التقديرات إلى أنه خلال عقدين تم إنقاذ ما يقرب من 200,000 شخص، والغالبية العظمى لم تتعرض لتلف في الدماغ.
قام رونالد فين، في ليفربول، إنجلترا بتطبيق تقنية مجهرية للكشف عن الخلايا الجنينية في دم الأم. والتي أدت به إلى اقتراح أنه يمكن منع المرض عن طريق حقن الأم المعرضة للخطر بأجسام مضادة لخلايا الدم الحمراء للجنين. وقدم هذه التقنية للجمهور لأول مرة في 18 فبراير، بعد عام 1960. وبعد بضعة أشهر، وكشف في اجتماع لجمعية علم الوراثة البريطانية أن هذه الأجسام المضادة هي «مضادـ RHD».
تقريبا في وقت واحد معه، وليام بولاك، ثم شركة أورثو الدوائية، والباحثين جون جورمان وفنسنت فريدا من مركز كولومبيا - بريسبيتيريان الطبي في مدينة نيويورك، [6] توصلوا جميعا إلى النتيجة ذاتها، وقاموا بإثبات ذلك عن طريق حقن مجموعة من السجناء الذكور في مرفق سينغ سينغ الإصلاحي بالأجسام المضادة التي قدمتها أورثو، التي حصلت علي تقنية تجزئة وضعها بولاك (الذي قدم أيضا لفين عدة قوارير من الأجسام المضادة خلال زيارة فين لشركة أورثو).
سبق أن أجريت دراسات على الحيوانات ووثقها وليام بولاك، وذلك باستخدام نموذج أرنب عنده ريسوس. وكان هذا النموذج، الذي سُمي الأرنب نظام HGA-F، نموذج حيواني مثالي من عامل ريسوس الموجود عند الإنسان، وتمكن فريق بولاك من اكتساب الخبرة في الوقاية من مرض الدم الانحلالي في الأرانب عن طريق إعطاء الأجسام المضادة المتخصصة HGA، وهو ما حدث في وقت لاحق مع الأمهات سالبة العامل ريسوس. كان واحدا من الاحتياجات هو تجربة الجرعات التي يمكن أن تستخدم لتحديد مستوى انتشار الخلايا إيجابية الريسوس القادمة من الجنين موجب الريسوس (ر ه +) في الإناث الحوامل السلبية (ر ه -). وقد تم ذلك لأول مرة في نظام الأرانب، ولكن أكدت الاختبارات التي تمت لاحقا على الإنسان في جامعة مانيتوبا والتي أجريت في إطار توجيهات بولاك أن هذه النتيجة مطابقة للجرعات التي تنطبق على الإنسان تماما. الجرعة هي 20 ميكروجرام من الأجسام المضادة 1 مللي من خلايا الدم الحمراء الإيجابية الريسوس (ر ه +).
قام السير وليام لايلي بأول عملية نقل دم داخل الرحم بنجاح في عام 1963.
كانت شقيقة جورمان في القانون هي أول امرأة في خطر الإصابة حصلت على حقن وقائي في 31 يناير، عام 1964. أجريت التجارب السريرية على يد بولاك في 42 مركزا علاجيا في الولايات المتحدة وبريطانيا وألمانيا والسويد وإيطاليا، أكدت أستراليا على قبول النظرية، وأخيرا تم قبول اللقاح في إنجلترا والولايات المتحدة في عام 1968. وافقت إدارة الأغذية والعقاقير على قبول اللقاح تحت اسم «رو GAM»، بجرعة ثابتة هي 300 ميكرو جرام، على أن تعطى للأم في غضون ثلاثة أيام بعد الولادة. لم يكن هناك أي ضرر من المعروف حدوثه عند تأخير الجرعة لمدة أسبوع أو أكثر بعد الولادة، طلبت أورثو من إدارة الأغذية والدواء منح الإذن أن يعطى اللقاح دون قيود زمنية فيما بعد الولادة. بالإضافة إلى ذلك، دفعت جون م. بومان، وهو أحد الباحثين في جامعة مانيتوبا، وفريدا للسماح بالاستخدام قبل الولادة. منح كل هذا بشكل متلاحق. في غضون عام أو نحو ذلك، تم حقن الأجسام المضادة بنجاح كبير لأكثر من 500,000 امرأة. اختارته مجلة تايم كواحد من أكبر عشر إنجازات طبية في العقد 1960. وبحلول عام 1973، تشير التقديرات إلى أنه في الولايات المتحدة وحدها، تم إنقاذ حياة أكثر من 50,000 رضيع. أصبح استخدام الجلوبيولين المناعي (ره) للوقاية من المرض في أطفال الأمهات السلبية الريسوس هو الإجراء المعتاد، والمرض، الذي كان يودي بحياة 10,000 طفل سنويا في الولايات المتحدة وحدها، تم القضاء عليه تقريبا في دول العالم المتقدم. وجاء هذا الإنجاز بشكل كامل تقريبا دون دعم من المعاهد الوطنية للصحة «في الولايات المتحدة»، الذين رفضوا اقتراح مجموعة نيويورك مرتين. بالمقابل حصلت المجموعة على منحة صغيرة (329765 $ على مدى أكثر من 10 عاما) من مدينة نيويورك. بينما بلغت التكلفة الإجمالية لعبء المرض بضعة ملايين من الدولارات، وهي عبارة عن تكلفة الرعاية مدى الحياة لنصف دزينة من الأطفال المصابين بتلف دماغي لا يمكن إصلاحه. في عام 1980، تلقى كل من سيريل كلارك، رونالد فين، جون جورمان، فنسنت فريدا، ووليام بولاك جائزة ألبرت لاسكر للأبحاث الطبية السريرية لعملهم على فصائل الدم ريسوس والوقاية من مرض الريسوس.
قام اثنان من الباحثين الكنديين من جامعة مانيتوبا، بروس كوان، جون م. بومان وتحت قيادة رئيس معهد ره وينيبيغ، البروفيسور ألبرت د فريزين، بترخيص نسخة من اللقاح، والمعروفة باسم «وين رو»، في عام 1980. بيع اللقاح في 35 بلدا من قبل شركة أبحاث تابعة لجامعة مانيتوبا- كانجين، المدرجة في بورصة تورونتو مع بقيمة حوالي 175 مليون $. تم شراء كانجين من قبل معهد ره وينيبيغ، الذي أسسه كوان وبومان وكرساه لإجراء البحوث في الأمراض المتصلة بالدم. تم تكريم كوان من قاعة الشهرة الطبية الكندية لعمله مدى الحياة على مرض كثرة أرومات الحمر الجنينية.
جيمس هاريسون، المعروف أيضا باسم الرجل ذو الذراع الذهبية، هو متبرع ببلازما دم من أستراليا. لقد قدم أكثر من 1000 تبرع طوال حياته، وتقدر هذه التبرعات بكونها أنقذت أكثر من مليون طفل لم يولدوا بعد من هذه الحالة. حتى عام 2015، صُنعت كل دفعة من المضاد دي في أستراليا من دمه.[7]
انظر أيضا
المصادر
- ^ Bowman، J.؛ Chown، B.؛ Lewis، M.؛ Pollock، J. M. (1978). "Rh-immunization during pregnancy: antenatal prophylaxis". Canadian Med Ass Journal. ج. 118 ع. 6: 623–627. PMC:1818025. PMID:77714.
- ^ أ ب ت ث ج ح McBain، RD؛ Crowther، CA؛ Middleton، P (3 سبتمبر 2015). "Anti-D administration in pregnancy for preventing Rhesus alloimmunisation". The Cochrane database of systematic reviews. ج. 9: CD000020. DOI:10.1002/14651858.CD000020.pub3. PMID:26334436.
- ^ Landsteiner، K.؛ Weiner، A. (1940). "An Agglutinable Factor in Human Blood Recognized by Immune Sera for Rhesus Blood". Exp Biol Med. ج. 43 ع. 1: 223. DOI:10.3181/00379727-43-11151.
- ^ Levine، P.؛ Stetson، R. E. (1939). "An Unusual Case of Intra-group Agglutination". دورية الجمعية الطبية الأمريكية. ج. 113 ع. 2: 126–127. DOI:10.1001/jama.1939.72800270002007a.
- ^ Wallerstein، H. (1946). "Treatment of Severe Erythroblastosis by Simultaneous Removal and Replacement of the Blood of the Newborn Infant". ساينس. ج. 103 ع. 2680: 583–584. DOI:10.1126/science.103.2680.583. PMID:17779885.
- ^ Freda، V.؛ Gorman، J.؛ Pollack، W. (1964). "Successful Prevention of Experimental Rh Sensitization in Man with an Anti-Rh Gamma2-Globulin Antibody Preparation: A Preliminary Report". Transfusion. ج. 4 ع. 1: 26–32. DOI:10.1111/j.1537-2995.1964.tb02824.x.
- ^ This man's blood has saved the lives of two million babies, Samantha Bresnahan, CNN, June 9, 2015 نسخة محفوظة 28 يناير 2018 على موقع واي باك مشين.
- Friesen A.D., Bowman J.M., Price H.W. (1981). "Column Ion Exchange Preparation and Characterization of an Rh Immune Globulin (WinRho) for Intravenous Use". J. Appl. Biochem. ج. 3: 164–175.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)