|
تضامنًا مع حق الشعب الفلسطيني |
ميثيل إيثانولامين-N
هذه مقالة غير مراجعة. (ديسمبر 2021) |
ميثيل إيثانولامين-N |
| الأسماء | |
|---|---|
| اسم IUPAC المفضل
2- (ميثيلامينو) إيثان -1- أول | |
اسماء اخرى
| |
| معرفات | |
| CAS رقم |
|
| نموذج ثلاثي الأبعاد ( JSmol ) |
|
| مرجع بيلشتاين | 1071196 |
| تشيبي |
|
| شيمبل |
|
| كيم سبايدر |
|
| ECHA InfoCard | 100.003.374 |
| رقم EC |
|
| MeSH | N- ميثيل أمين الإيثانول |
| PubChem إدارة البحث الجنائي |
|
| رقم RTECS |
|
| UNII |
|
| رقم الأمم المتحدة | 2735 |
| لوحة معلومات CompTox ( EPA ) |
|
| تبين
إنشي | |
| تبين
الابتسامات | |
| الخصائص | |
| صيغة كيميائية | C 3 H 9 N O |
| الكتلة المولية | 75.111 جم · مول −1 |
| مظهر خارجي | سائل عديم اللون |
| رائحة | نشادر |
| كثافة | 0.935 جم مل −1 |
| نقطة الانصهار | −4.50 درجة مئوية ؛ 23.90 درجة فهرنهايت ؛ 268.65 ك |
| نقطة الغليان | 158.1 درجة مئوية ؛ 316.5 درجة فهرنهايت ؛ 431.2 ك |
| الذوبان في الماء | امتزاج |
| تسجيل P | 1.062 |
| ضغط البخار | 70 باسكال (عند 20 درجة مئوية) |
| معامل الانكسار ( ن د ) | 1.439 |
| المخاطر | |
| الرسوم التوضيحية GHS | |
| كلمة إشارة GHS | خطر |
| بيانات مخاطر GHS | H302 ، H312 ، H314 |
| البيانات التحذيرية GHS | P280 ، P305 + P351 + P338 ، P310 |
| نقطة الوميض | 76 درجة مئوية (169 درجة فهرنهايت ، 349 كلفن) |
| درجة حرارة الاشتعال الذاتي | 350 درجة مئوية (662 درجة فهرنهايت ، 623 كلفن) |
| حدود التفجير | 1.6 - 19.8٪ |
| المركبات ذات الصلة | |
| الكانولات ذات الصلة |
|
| المركبات ذات الصلة | ديثيل هيدروكسي أمين |
| ما لم يُذكر خلاف ذلك ، يتم تقديم البيانات للمواد في حالتها القياسية (عند 25 درجة مئوية [77 درجة فهرنهايت] ، 100 كيلو باسكال). | |
| تحقق ( ما هو ؟) | |
| مراجع Infobox | |
ميثيل إيثانول أمين -N: هو كحو أميني مع الصيغة CH 3 NHCH 2 CH 2 OH، وهي قابل للاشتعال، أكال، عديم اللون، لزج السائل [2]، وهو وسيط في الإصطناع الحيوي للكولين.
مع كل من المجموعات الوظيفية للأمين والهيدروكسيل ، فهو وسيط مفيد في التخليق الكيميائي للمنتجات المختلفة بما في ذلك البوليمرات والمستحضرات الصيدلانية. كما أنها تستخدم بمثابة مذيب ، على سبيل المثال في تجهيز الغاز الطبيعي ، حيث يتم استخدامه جنبا إلى جنب مع النظير في إيثانولامين وإيثانول أمين .
إنتاج
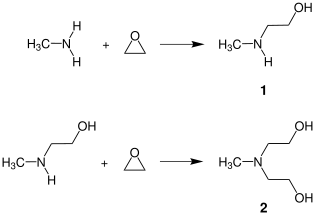
يتم إنتاج N -Methylethanolamine صناعيًا عن طريق تفاعل أكسيد الإيثيلين مع الميثيل أمين الزائد في محلول مائي. ينتج عن هذا التفاعل خليط من منتج الإضافة 1: 1 NMEA ( 1 ) و - عن طريق إضافة أخرى من أكسيد إيثيلين آخر - منتج الإضافة 1: 2 ميثيل ثنائي إيثانول أمين (MDEA) ( 2 ):
من أجل الحصول على عوائد عالية من المنتج المستهدف المطلوب ، يتم تغذية المواد المتفاعلة باستمرار إلى مفاعل التدفق وتتفاعل مع زيادة مضاعفة من ميثيل أمين.[3] في خطوات عملية المصب ، تتم إزالة الميثيلامين الزائد والماء و NMEA (bp.160 °C) و MDEA (BP 243 °C) من خليط المنتج عن طريق التقطير التجزيئي. يتكون البولي (ميثيل - إيثانولامين) من إضافة المزيد من أكسيد الإيثيلين إلى ميثيل إيثانول أمين في قيعان التقطير.
الخصائص
N- ميثيل إيثانول أمين هو سائل رائحته شبيهة بالأمين ، عديم اللون ، ماصة للرطوبة ، يمكن مزجه مع الماء والإيثانول بأي نسبة. تتفاعل المحاليل المائية بشكل أساسي بشدة وبالتالي فهي تآكل. المادة قابلة للتحلل الحيوي بسهولة وليس لديها إمكانية للتراكم البيولوجي بسبب قابليتها للامتزاج في الماء. NMEA ليست مطفرة ، ولكن في وجود النتريت ، يمكن تكوين النتروزامين المسرطنة من المركب ، لأنه أمين ثانوي.[4]
يستخدم
مثل ألكيل ألكانولامينات وأخرى، ويستخدم ميثيل إيثانول أمين -N في الدهانات والطلاءات القائمة على الماء والمذيبات كمذيب للذوبان لمكونات أخرى مثل: الأصباغ وكمثبت.
في الطلاء بالغمس الكاثودي يعمل ميثيل إيثانول أمين -N كمعادل كاتيوني للمعادلة الجزئية لراتنج الإيبوكسي، كما أنه يعمل كموسع سلسلة في تفاعل البولي إيبوكسيدات ذات الوزن الجزيئي العالي مع البوليولات.
كونه أساسًا ، يشكل ميثيل إيثانول أمين -N أملاحًا محايدة مع الأحماض الدهنية، والتي تستخدم كمواد خافضة للتوتر السطحي (صابون) بخصائص استحلاب جيدة وتجد تطبيقات في منتجات تطهير المنسوجات والعناية الشخصية، عند تبييض مزيج القطن والبوليستر ، يتم استخدام (NMEA) كمنير.[5]
بواسطة مثيلة من -methylaminoethanol، N dimethylaminoethanol والكولين [(2-هيدروكسي) كلوريد -trimethyl الأمونيوم] يمكن تحضير.
في تفاعل N -methylaminoethanol مع الأحماض الدهنية ، يتم تكوين أميدات N -methyl- N - (2-hydroxyethyl) طويلة السلسلة عند التخلص من الماء. هذه تستخدم كمواد خافضة للتوتر السطحي. تعمل هذه الأميدات أيضًا كمحسّنات للتدفق وتصب مثبطات النقطة في الزيوت الثقيلة ونواتج التقطير الوسطى .[6] عن طريق الأكسدة التحفيزية لـ N -methylaminoethanol ، يتم الحصول على ساركوزين الأحماض الأمينية غير البروتينية. [7]
N -methylaminoethanol يلعب دورا بمثابة لبنة لتركيب مركبات حماية المحاصيل والمواد الصيدلانية، كما هو الحال في المرحلة الأولى من تسلسل رد الفعل على مضادات الهيستامين و مضادات الاكتئاب ميانسيرين (Tolvin) وإلى غير مسكن نيفوبام (اجان).
قياسا مع غيرها من aziridines ، N -methylaziridine يمكن الحصول عليها عن طريق تركيب Wenker من N -methylaminoethanol. يتم ذلك إما عن طريق إستر حامض الكبريتيك أو بعد استبدال مجموعة الهيدروكسي بذرة كلور (على سبيل المثال بواسطة كلوريد الثيونيل أو حمض [8] ) إلى N -methyl-2-chloroethylamine ثم باستخدام قاعدة قوية (الانقسام من حمض الهيدروكلوريك) في استبدال جزيئي نووي :
يتفاعل مع ثاني كبريتيد الكربون لإعطاء <i id="mwcw">N</i> -methyl-2-thiazolidinethione .
انظر أيضًا
مراجع
- ^ Merck Index, 12th Edition, 6096.
- ^ Matthias Frauenkron, Johann-Peter Melder, Günther Ruider, Roland Rossbacher, Hartmut Höke "Ethanolamines and Propanolamines" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a10_001
- ^ Miura Trading & Finvest Pvt. Ltd.: Methyl Ethanolamines Technology نسخة محفوظة 2016-03-06 على موقع واي باك مشين. (PDF; 152 kB).
- ^ Product Safety Assessment, DOW N-Methylethanolamine, The Dow Chemical Company, Version vom 24. März 2010.
- ^ The Dow Chemical Company: Alkyl Alkanolamines نسخة محفوظة 2018-01-28 على موقع واي باك مشين., March 2003.
- ^ [1]
- ^ US-Patent US 8,227,638, Process for preparing creatine, creatine monohydrate and guanidinoacetic acid, Inventor: F. Thalhammer, T. Gastner, Anmelder: Alzchem Trostberg GmbH, 24. July 2012. نسخة محفوظة 2017-01-02 على موقع واي باك مشين.
- ^ J.H. Drese, The design, synthesis, and characterization of aminosilica adsorbants for CO2 capture from dilute sources (PDF; 5,3 MB), Ph.D. Thesis, Georgia Institute of Technology, Dezember 2010, S. 175. نسخة محفوظة 4 نوفمبر 2021 على موقع واي باك مشين.
| ميثيل إيثانولامين-N في المشاريع الشقيقة: | |