|
تضامنًا مع حق الشعب الفلسطيني |
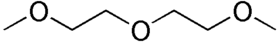
مضاعف (2-ميثوكسي إيثيل) الإيثر
| مضاعف (2-ميثوكسي إيثيل) الإيثر | |
|---|---|
| الاسم النظامي (IUPAC) | |
مضاعف (2-ميثوكسي إيثيل) الإيثر أو |
|
| أسماء أخرى | |
ديغلايم Diglyme |
|
| المعرفات | |
| رقم CAS | 111-96-6 |
| بوب كيم (PubChem) | 8150 |
| الخواص | |
| الصيغة الجزيئية | C6H14O3 |
| الكتلة المولية | 134.18 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.94 غ/سم3 |
| نقطة الانصهار | - 64 °س |
| نقطة الغليان | 160 °س |
| الذوبانية في الماء | يمتزج مع الماء |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
مضاعف (2-ميثوكسي إيثيل) الإيثر عبارة عن مركب عضوي له الصيغة المجملة C6H14O3. ينتمي المركب إلى الإيثرات كما يشير الاسم، وهو إيثر ثنائي إيثيلين غليكول. يعد المركب من المذيبات العضوية المعروفة، وهو سائل شفاف عديم اللون. يسمى المركب أيضاً باسم ديغلايم (Diglyme)، وهي نحت من diglycol methyl ether، أي ثنائي غليكول ميثيل الإيثر.
الخصائص
- يمتزج الديغلايم المركب مع الماء، كما يمتزج مع الكحولات وثنائي إيثيل الإيثر والمذيبات الهيدروكربونية.
- يمتاز المركب بارتفاع نقطة غليانه نسبياً بالمقارنة مع المحلات العضوية الأخرى حيث تبلغ 160°س، كما يمتاز بثباتيته، حتى في أوساط ذات قيمة أس هيدروجيني مرتفعة، مما يجعله مذيباً ممتازاً للتفاعلات التي تتطلب درجات حرارة مرتفعة، وللتي تتطلب وسطاً قاعدياً.
الاستعمالات

يستعمل الديغلايم بشكل رئيسي كمذيب في التفاعلات العضوية، خاصة أن لديه القدرة على التمخلب مع الأيونات الموجبة (الكاتيونات) الصغيرة، مما يجعل الأيونات السالبة المرتبطة معها أكثر فعالية. جرى تطبيق ذلك في التفاعلات الحاوية على كواشف عضوية فلزية مثل تفاعل غرينيار أو اختزال هيدريد الفلز، حيث وجد أن التفاعل أصبح لديه معدل سرعة أفضل بكثير.
يستعمل الديغلايم كمحل في تفاعل أكسدة هيدروبورونية مع ثنائي البوران.
اقرأ أيضاً
المراجع
- ^ صفحة بيانات السلامة الكيميائية من Merck نسخة محفوظة 22 يونيو 2020 على موقع واي باك مشين.
| مضاعف (2-ميثوكسي إيثيل) الإيثر في المشاريع الشقيقة: | |