|
تضامنًا مع حق الشعب الفلسطيني |
كلوريد السكانديوم
| كلوريد السكانديوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
كلوريد السكانديوم الثلاثي |
|
| أسماء أخرى | |
ثلاثي كلوريد السكانديوم |
|
| المعرفات | |
| رقم CAS | 10361-84-9 |
| بوب كيم (PubChem) | 82586 |
| الخواص | |
| الصيغة الجزيئية | ScCl3 |
| الكتلة المولية | 151.31 غ/مول |
| المظهر | بلورات بيضاء رمادية |
| الكثافة | 2.39 غ/سم3 |
| نقطة الانصهار | 960 °س [1] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |

كلوريد السكانديوم الثلاثي مركب كيميائي له الصيغة ScCl3 ، ويكون على شكل بلورات بيضاء رمادية سهلة التسيل.
الخواص
- إن مركب كلوريد السكانديوم عبارة عن مركب أيوني، له انحلالية كبيرة في الماء.[2] ويوجد منه شكل لامائي وشكل سداسي الهيدرات (ScCl3 • 6H2O).
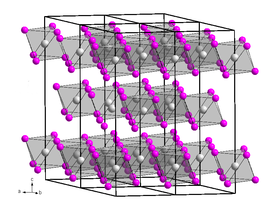
- البنية البلورية للمركب تشبه بنية يوديد البزموت BiI3 الطبقية، بحيث تتساند ست أيونات من السكانديوم.[3] بالطور البخاري عند درجات حرارة تصل إلى 900 كلفن (627°س) فإن كلوريد السكانديوم يكون على شكل أحادي (مونومر)، في حين أن الشكل الثنائي Sc2Cl6 (ديمر) تكون نسبته 8% تقريباً.[4] يظهر طيف حيود الإلكترونات أن بنية الشكل ScCl3 هي بنية مستوية، في حين أن الحسابات تشير إلى أن Sc2Cl6 له أربع روابط Sc-Cl في بنيته .[4]
التحضير
يحضر الشكل المائي من كلوريد السكانديوم بتفاعل أكسيد السكانديوم مع حمض الهيدروكلوريك حسب المعادلة:
- Sc2O3 + 6 HCl → 2 ScCl3 + 3 H2O
أما للحصول على الشكل اللامائي فينبغي حل أكسيد السكانديوم في زيادة من حمض الهيدروكلوريك وبإضافة هيدروكسيد الأمونيوم إلى المحلول الناتج المبرّد بشكل محسوب بحيث نحصل على نسبة من كلوريد الأمونيوم إلى كلوريد السكانديوم مقدارها 9.1، وبحيث تكون قيمة الأس الهيدروجيني النهائي للمحلول حوالي 3. بإجراء عملية تبخير لهذه المحاليل إلى الجفاف على صفيحة جهاز تسخين، متبوعة بعملية تجفيف تحت الفراغ عند درجة حرارة الغرفة لمدة 6 ساعات، فإننا نحصل على صلب أبيض من كلوريد السكانديوم اللامائي.[5]
الاستخدامات
- استعمل كلوريد السكانديوم الثلاثي في عملية التحضير الأولى لفلز السكانديوم عام 1937، [6] عندما قام فيشر Fischer ومعاونوه بتحضير الفلز وذلك بالتحليل الكهربائي لمزيج أصهري Eutectic لكلوريد السكانديوم الثلاثي مع أملاح أخرى عند درجات حرارة تتراوح بين 700-800°س.
- يؤدي تفاعل كلوريد السكانديوم الثلاثي مع رباعي هيدرو الفوران إلى تشكل بلورات بيضاء من ScCl3(THF)3، والذي يستعمل كمركب وسيطي مهم في الاصطناع العضوي.[7]
المراجع
- ^ Frederikse, H.P.R.; Lide, David R. (1998). CRC Handbook of Chemistry and Physics (78th Edition) نسخة محفوظة 30 أبريل 2018 على موقع واي باك مشين.
- ^ Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-08-037941-9
- ^ Crystal Structure of ScCl3 Refined from Powder Neutron Diffraction Data, Fjellvåg, H., Karen, P., Acta Chemica Scandinavica, 48, 294-297, دُوِي:10.3891/acta.chem.scand.48-0294
- ^ أ ب Haaland A., Martinsen K-G, Shorokhov D.J, Girichev G.V., Sokolov V.I, J. Chem. Soc., Dalton Trans., 1998, 2787 - 2792, دُوِي:10.1039/a803339k
- ^ Robert W. Stotz, Gordon A. Melson (1972). "Preparation and mechanism of formation of anhydrous scandium(III) chloride and bromide". Inorg. Chem. ج. 11 ع. 7: 1720–1721. DOI:10.1021/ic50113a058.
- ^ Fischer، Werner (1937). "Über das metallische Scandium". Zeitschrift für anorganische und allgemeine Chemie. ج. 231 ع. 1–2: 54–62. DOI:10.1002/zaac.19372310107.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Manzer, L. E., "Tetrahydrofuran Complexes of Selected Early Transition Metals", Inorganic Syntheses, 1982, volume 21, page 135-40.