|
تضامنًا مع حق الشعب الفلسطيني |
فلوريد الحديد الثنائي
| فلوريد الحديد الثنائي | |
|---|---|
| الاسم النظامي (IUPAC) | |
فلوريد الحديد الثنائي |
|
| أسماء أخرى | |
فلوريد الحديدوز |
|
| المعرفات | |
| رقم CAS | 7789-28-8 13940-89-1 (رباعي هيدرات) |
| بوب كيم (PubChem) | 522690 |
| الخواص | |
| الصيغة الجزيئية | FeF2. |
| الكتلة المولية | 93.842 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 4.09 غ/سم3 (لا مائي) 2.20 غ/سم3 (رباعي هيدرات) |
| نقطة الانصهار | 1100 °س |
| نقطة الغليان | °س |
| الذوبانية في الماء | ضعيفة |
| الذوبانية | ينحل في حمض هيدروفلوريك الممدد |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
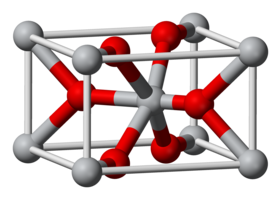
فلوريد الحديد الثنائي مركب كيميائي له الصيغة FeF2، ويكون على شكل بلورات بيضاء. يوجد فلوريد الحديد الثنائي على شكل مائي حيث يرتبط مع أربعة جزيئات ماء (رباعي هيدرات) FeF2.4H2O.
الخواص
- ينحل فلوريد الحديد الثنائي بشكل ضعيف في الماء، إلا أنه ينحل بشكل جيد في حمض هيدروفلوريك الممدد.
- تتبع بلورات فلوريد الحديد الثنائي بالشكل اللامائي النظام البلوري الرباعي، وذلك على شاكلة ثنائي أكسيد التيتانيوم، في حين أن الشكل المائي رباعي الهيدرات له شكل سداسي.
- يختزل أيون الحديد في فلوريد الحديد الثنائي إلى فلز الحديد الحر في حال تسخينه مع الهيدروجين:
FeF2 + H2 → Fe + 2HF
التحضير
يحضر فلوريد الحديد الثنائي من تمرير غاز فلوريد الهيدروجين على فلز الحديد عند درجات حرارة مرتفعة:
- 2HF + Fe → FeF2 + H2
يمكن أيضاً أن يحضر باختزال فلوريد الحديد الثلاثي باستخدام غاز الهيدروجين:
2FeF3 + H2 → 2FeF2 + 2HF
أو بتمرير غاز الفلور على كلوريد الحديد الثنائي على البارد:
- FeCl2 + F2 → FeF2 + Cl2
أما الشكل المائي من فلوريد الحديد الثنائي (رباعي الهيدرات) فيحصل عليه من حل فلز الحديد في حمض هيدروفلوريك الممدد.
الاستخدامات
- يستخدم كحفاز في تفاعلات الفلورة العضوية، وفي تحضير مركبات الفلور العضوية. فهو على سبيل المثال يستعمل كحفاز في تحضير مركب رباعي فلورو الهيدرازين N2F4 من ثلاثي فلوريد النيتروجين NF3 بمردود جيد.[2]
- يستخدم من أجل تحضير أملاح الفلوريد الأخرى.
المصادر
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
المراجع
- ^ Iron(II) fluoride 98% | Sigma-Aldrich نسخة محفوظة 1 أكتوبر 2012 على موقع واي باك مشين.
- ^ Toshiyuki Takagi,، Masanori Tamura, Motonari Shibakami, Heng-dao Quan, Akira Sekiya (2000). "Preparation of tetrafluorohydrazine from nitrogen trifluoride with iron or iron(II) fluoride". Journal of Fluorine Chemistry. ج. 105 ع. 1: 45–47. DOI:10.1016/S0022-1139(00)00266-9.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)