|
تضامنًا مع حق الشعب الفلسطيني |
فروسين
| فِرُّوسين | |
|---|---|
 |
 |
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Ferrocene[1] |
|
| أسماء أخرى | |
Dicyclopentadienyl iron |
|
| الخواص | |
| الصيغة الجزيئية | C10H10Fe |
| الكتلة المولية | 186.04 غ/مول |
| المظهر | مسحوق بلوري برتقالي فاتح |
| الكثافة | 1.49 غ/سم3 |
| نقطة الانصهار | 173–174 °س |
| نقطة الغليان | 249 °س |
| الذوبانية في الماء | غير منحل قي الماء |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
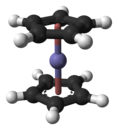
الفِرُّوسين هو مركب عضوي فلزي للحديد صيغته Fe(C5H5)2 وهو معقد تناسقي وشكل خاص من المركبات الشطيرية التي تدعى الميتالوسينات. في هذا المركب تحاط بذرة الحديد المركزية حلقتان من أنيون حلقي البنتاديينيل، ويوجد في الشروط القياسية على شكل مسحوق برتقالي فاتح.
التحضير
توجد عدة طرق لتحضير الفروسين. وحضر أول مرة سنة 1951 وفق تفاعل حسب آلية تفاعل غرينيار:[2]
كما يمكن التحضير من تفاعل الحديد الفلزي مع بخار حلقي البنتاديين:[3]

الخواص

يوجد الفروسين في الشروط القياسية على شكل مسحوق بلوري برتقالي، وهو عملياً غير منحل في الماء؛ لكنه ينحل في المذيبات العضوية مثل التولوين. يتميز المركب بأنه ثابت ومستقر حرارياً حتى درجة حرارة تصل إلى 400 °س.[4]
يتسامى الفروسين، خاصة تحت التفريغ، إذ تبلغ قيمة ضغط البخار عند الدرجة 25 °س مقدار 1 باسكال.[5][6]
الاستخدامات
للفروسين العديد من التطبيقات البحثية والعملية؛ وخاصة في مجال التحفيز فعلى سبيل المثال يستخدم الفروسين ومشتقاته على شكل حفازات لتسريع تفاعلات الاحتراق لوقود الصواريخ المعتمد على بيركلورات الأمونيوم (Ammonium perchlorate composite propellant).[7]
طالع أيضاً
المراجع
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Society of Chemistry. ص. 1041. DOI:10.1039/9781849733069. ISBN:978-0-85404-182-4.
- ^ Pauson، Peter L. (2001). "Ferrocene—how it all began". Journal of Organometallic Chemistry. 637–639: 3–6. DOI:10.1016/S0022-328X(01)01126-3.
- ^ Miller، S. A.؛ Tebboth، J. A.؛ Tremaine، J. F. (1952). "114. Dicyclopentadienyliron". Journal of the Chemical Society: 632–635. DOI:10.1039/JR9520000632.
- ^ Solomons، Graham؛ Fryhle، Craig (2006). Organic Chemistry (ط. 9th). USA: John Wiley & Sons.
- ^ Monte، Manuel J. S.؛ Santos، Luís M. N. B. F.؛ Fulem، Michal؛ Fonseca، José M. S.؛ Sousa، Carlos A. D. (2006). "New Static Apparatus and Vapor Pressure of Reference Materials: Naphthalene, Benzoic Acid, Benzophenone, and Ferrocene". J. Chem. Eng. Data. ج. 51 ع. 2: 757. DOI:10.1021/je050502y.
- ^ Fulem، Michal؛ Růžička، Květoslav؛ Červinka، Ctirad؛ Rocha، Marisa A. A.؛ Santos، Luís M. N. B. F.؛ Berg، Robert F. (2013). "Recommended vapor pressure and thermophysical data for ferrocene". Journal of Chemical Thermodynamics. ج. 57: 530–540. DOI:10.1016/j.jct.2012.07.023.
- ^ "Ferrocene Burn Rate Catalyst". www.rocketmotorparts.com. مؤرشف من الأصل في 2021-07-16. اطلع عليه بتاريخ 2020-01-13.
| فروسين في المشاريع الشقيقة: | |
