|
تضامنًا مع حق الشعب الفلسطيني |
سرطانة قنوية لابدة موضعية
| السرطانة القنوية اللابدة الموضعية | |
|---|---|
قنوات الغدد الثديية. موقع السرطانة القنوية
| |
| تسميات أخرى | سرطانة داخل القناة |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| تعديل مصدري - تعديل | |
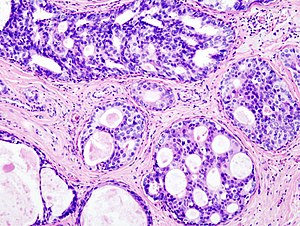
السرطانة القنوية اللابدة الموضعية[1] المعروفة أيضًا باسم السرطانة داخل القناة[2] (بالإنجليزية: Ductal carcinoma in situ) هي آفة سرطانية سابقة أو غير غازية لسرطان الثدي،[3][4] تم تصنيف السرطانة القنوية اللابدة على أنها مرحلة 0،[5] نادرًا ما ينتج عنها أعراض أو ورم في الثدي يمكن للمرأة أن تشعر به، وعادة ما يتم اكتشافه من خلال فحص التصوير الشعاعي للثدي.[6][7]
توجد في السرطانة القنوية اللابدة خلايا غير طبيعية في بطانة قناة لبنية أو أكثر في الثدي، يعني مُصطلح "In situ" «في مكانه» ويشير إلى حقيقة أن الخلايا غير الطبيعية لم تنتقل من القناة الثديية إلى أي من الأنسجة المحيطة بها في الثدي (بينما يشير مصطلح «ما قبل السرطان» إلى حقيقة أنها لم تصبح بعد سرطان غازي)، في بعض الحالات قد تصبح السرطانة القنوية اللابدة غازية[8] وتنتشر إلى أنسجة أخرى، ولكن لا توجد وسيلة لتحديد الخلايا السرطانية التي ستبقى مستقرة دون علاج والتي سوف تتطور لتصبح غازية، تشمل السرطانة القنوية اللابدة مجموعة واسعة من الأمراض التي تتراوح بين الخلايا السرطانية منخفضة الدرجة التي لا تهدد الحياة إلى الخلايا السرطانية عالية الدرجة (أي التي قد تكون شديدة الانتشار وعدوانية).
تم تصنيف السرطانة القنوية اللابدة وفقًا لـ:
- البناء النمطي للخلايا إلى (صلبة، مصفوية، حليمية، حليمية صغيرة)
- درجة الورم (درجة عالية، متوسطة، منخفضة)
- وجود أو عدم وجود نسيج سرطاني زؤاني.[8]
يمكن اكتشاف السرطانة القنوية اللابدة عن طريق تصوير الثدي بالأشعة السينية عن طريق فحص بقع صغيرة من الكالسيوم المعروفة باسم «التكلُّس المجهري»، نظرًا للشك في أن التكلس المجهري يمكن أن يظهر حتى في غياب السرطانة القنوية اللابدة فقد يلزم إجراء خزعة للتشخيص.
حوالي 20-30% من أولئك الذين لا يتلقون علاج يصابون بسرطان الثدي[9][10]، هذا هو النوع الأكثر شيوعًا للسرطان من قبل النساء، هناك بعض الاختلاف حول ما إذا كان ينبغي اعتباره سرطانًا -لأغراض إحصائية- أم لا حيثُ يشمل البعض السرطانة القنوية اللابدة عند حساب إحصائيات سرطان الثدي بينما لا يفعل آخرون.[11][12]
علم المصطلحات
تعني السرطانة القنوية اللابدة الموضعية حرفيًا مجموعات من الخلايا الطلائية «السرطانية» التي ظلت في مكانها الطبيعي (في الموقع) داخل القنوات والشحمات في الغدة الثديية[13]، سريريًا يعتبر هذا المرض في مرحلة قبل الخبث (أي من المحتمل أن يكون خبيثًا) لأن الخلايا البيلوجية غير الطبيعية لم تعبر بعد الغشاء القاعدي لغزو الأنسجة المحيطة[13][14]، عندما تتواجد آفات متعددة (تُعرف باسم «بؤر» السرطانة القنوية اللابدة) في الأرباع المختلفة من الثدي يُشار إلى هذا باسم المرض «متعدد المراكز»[8]
لأغراض إحصائية يعتبر البعض السرطانة القنوية اللابدة الموضعية «سرطانًا»، في حين أن البعض الآخر لا يعتبرها سرطانًا[12][15]، عندما يصنف على أنه سرطان فإنه يشار إليه على أنه شكل غير غازٍ أو ما قبل الغازي.[13][16] يصفه المعهد الوطني للسرطان بأنه «حالة غير غازية».
العلامات والأعراض



معظم النساء اللائي يصبن بـ السرطانة القنوية اللابدة لا يعانين من أي أعراض، يتم اكتشاف غالبية الحالات (80-85٪) من خلال فحص الثدي بالأشعة، قد تظهر العلامات والأعراض الأولى إذا تقدم السرطان بسبب نقص الأعراض المبكرة، كما يتم اكتشاف السرطانة القنوية اللابدة غالبًا في فحص التصوير الشعاعي للثدي.
في بعض الحالات قد تؤدي السرطانة القنوية اللابدة:
- كتلة أو سمك في أو بالقرب من الثدي أو تحت الذراع
- تغيير في حجم أو شكل الثدي
- إفرازات من الحلمة أوالم عند لمس الحلمة يمكن أيضًا قلب الحلمة أو سحبها مرة أخرى إلى الثدي
- حواف أو نقر في الثدي (قد يبدو الجلد مثل جلد البرتقالة)
- تغيُّر في شكل جلد الثدي أو الهالة أو الحلمة[17] مثل ارتفاع درجة حرارتها أو التورم أو الاحمرار أو القشور.[18]
الأسباب
لا تزال الأسباب المحددة لـ السرطانة القنوية اللابدة غير معروفة، عوامل الخطر لتطوير هذه الحالة تشبه تلك الخاصة بسرطان الثدي الغازي[19]، لكن بعض النساء أكثر عرضة من غيرهم لتطور السرطانة القنوية اللابدة، النساء اللائي يعتبرن أكثر عرضة للخطر هم أولئك الذين لديهم تاريخ عائلي من سرطان الثدي أو أولئك اللاتي بدأت دورتهن الشهرية في سن مبكرة أو اللاتي تأخر لديهن انقطاع الطمث، أيضًا فإن النساء اللائي لم ينجبن أطفالًا أو أنجبوهن في سن متأخر أكثر عرضة للإصابة بهذا المرض.
قد يساهم في تطوُّر الحالة الاستخدام طويل الأمد للعلاج البديل لهرمونات الاستروجينوالبروجستين (HRT) لأكثر من خمس سنوات بعد انقطاع الطمث والطفرات الوراثية (جينات BRCA1 أو BRCA2) وفرط التنسج وكذلك التعرض للإشعاع أو التعرض لمواد كيميائية معينة[20]، ومع ذلك يزداد خطر الإصابة بسرطان غير غازي مع تقدم العمر وهو أعلى لدى النساء الأكبر من 45 عامًا.
التشخيص
يتم تشخيص 80% من الحالات في الولايات المتحدة عن طريق فحص التصوير الشعاعي للثدي.[21]
العلاج
هناك آراء مختلفة حول أفضل علاج للسرطانة القنوية اللابدة الموضعية[22]، ويُعد الاستئصال الجراحي مع أو بدون علاج مساند كـ علاج إشعاعي أو تاموكسيفين هو العلاج الموصى به لـهذا المرض من قبل المعهد الوطني للسرطان، قد تكون الجراحة إما استئصال الورم الذي يحافظ على الثدي أو استئصال الثدي (الإزالة الكاملة أو الجزئية للثدي المصاب)، إذا تم استخدام استئصال الورم فغالبًا ما يتم دمجه مع العلاج الإشعاعي، كما يمكن استخدام عقار تاموكسيفين كعلاج هرموني إذا أظهرت الخلايا إيجابية تجاه مستقبلات هرمون الاستروجين، العلاج الكيميائي ليس ضروريًا للـسرطانة القنوية اللابدة الموضعية لأن المرض غير منتشر.[23]
في حين أن الجراحة تقلل من خطر الإصابة بالسرطان لاحقاً فإن الكثير من الناس لا يصابون بالسرطان أبدًا حتى بدون علاج والآثار الجانبية المرتبطة به[24]، لا يوجد دليل يقارن العملية الجراحية مع الانتظار اليقظ والبعض يشعر بأن الانتظار اليقظ قد يكون خيارًا معقولًا في بعض الحالات.[24]
العلاج الإشعاعي
يوفر استخدام العلاج الإشعاعي بعد استئصال الورم معدلات بقاء معادلة لاستئصال الثدي على الرغم من وجود خطر أعلى قليلاً من الإصابة بانتكاسة المرض في نفس الثدي في شكل مزيد من السرطانة القنوية اللابدة الموضعية أو سرطان الثدي الغازي، تشير المراجعات المنهجية (بما في ذلك مراجعة كوكرين) إلى أن إضافة العلاج الإشعاعي لاستئصال الورم يقلل من تكرار السرطانة القنوية اللابدة الموضعية أو في وقت لاحق ظهور سرطان الثدي الغازي مقارنة بجراحة الحفاظ على الثدي وحده دون التأثير على الوفيات[25][26][27]، لم تجد مراجعة كوكرين أي دليل على أن العلاج الإشعاعي كان له أي آثار سامة طويلة الأجل[25]، بينما يحذر المؤلفون من أن المتابعة لفترة أطول ستكون مطلوبة قبل الوصول إلى استنتاج نهائي بشأن السمية طويلة الأجل، إلا أنهم يشيرون إلى أن التحسينات التقنية المستمرة متوقع أن تقيد التعرض للإشعاع في الأنسجة السليمة[25]، كما يعِدون بإعطاء معلومات شاملة عن الآثار الجانبية المحتملة للنساء اللائي يتلقين هذا العلاج[25]، يبدو أن إضافة العلاج الإشعاعي لاستئصال الورم يقلل من خطر التكرار الموضعي إلى حوالي 12٪، نصفهم تقريبًا سيكون من السرطانة القنوية اللابدة الموضعية والنصف الآخر سيكون سرطان الثدي الغازي، خطر التكرار هو 1% للنساء الخاضعات لاستئصال الثدي.[28]
استئصال الثدي
لا يوجد دليل على أن استئصال الثدي يقلل من خطر الوفاة عن استئصال الورم، ومع ذلك فإن استئصال الثدي قد يقلل من معدل الإصابة بالـسرطانة القنوية اللابدة الموضعية أو السرطان الغازي الذي يحدث في نفس المكان.
يبقى استئصال الثدي توصية شائعة لدى من يعانون من التواجد المجهري المستمر للحواف بعد الاستئصال الموضعي أو مع تشخيص السرطانة القنوية اللابدة وأدلة على وجود التكلسات المجهرية المنتشرة[29]، بعض المؤسسات التي واجهت معدلات عالية من السرطانات الغازية المتكررة بعد استئصال الثدي للسرطانة القنوية اللابدة قد أيد خزعة عقدة خافرة (SNB)[30]، يستخدم آخرون خزعة العقدة الخافرة لأشخاص معينين فقط، يتفق معظمهم على أن خزعة العقدة الخافرة يجب أن تؤخذ بعين الاعتبار عند تشخيص أنسجة السرطانة القنوية اللابدة الموضعية عالية الخطورة (الدرجة الثالثة مع كتلة واضحة أو حجم أكبر عند التصوير) وكذلك في الأشخاص الذين يخضعون لاستئصال الثدي بعد تشخيص الخزعة للسرطانة القنوية اللابدة الموضعية.[31]
المآل
مع العلاج يصبح المآل ممتازًا مع بقاء أكثر من 97% على المدى الطويل، أما إذا لم يتم علاجه تتطور السرطانة القنوية اللابدة الموضعية إلى سرطان غازي في حوالي ثلث الحالات وعادة ما يحدث ذلك في نفس الثدي والربع الذي حدثت به السرطانة القنوية اللابدة سابقًا[32]، حوالي 2% من النساء المصابات بهذه الحالة وتلقين العلاج توفين في غضون 10 سنوات، يمكن أن تحدد المؤشرات الحيوية أي النساء اللائي تم تشخيصهن في البداية بـالسرطانة القنوية اللابدة الموضعية معرضات لخطر كبير أو منخفض للإصابة بالسرطان الغازي.[33][34]
علم الأوبئة

غالبًا ما يتم الكشف عن الثدي باستخدام التصوير الإشعاعي للثدي لكن نادراً ما يمكن الشعور به، مع ازدياد استخدام فحص التصوير الشعاعي للثدي يتم تشخيص السرطانات غير الغازية بشكل متكرر وتشكل الآن ما بين 15% إلى 20% من جميع سرطانات الثدي.[29]
زادت حالات الإصابة بـ السرطانة القنوية اللابدة الموضعية بمقدار 5 أضعاف بين عامي 1983 و2003 في الولايات المتحدة بسبب إدخال التصوير الشعاعي للثدي، وفي عام 2009 تم تشخيص حوالي 62000 حالة.[35]
المراجع
- ^ Al-Qamoos القاموس | English Arabic dictionary / قاموس إنجليزي عربي نسخة محفوظة 26 يناير 2020 على موقع واي باك مشين.
- ^ "Al-Qamoos القاموس | English Arabic dictionary / قاموس إنجليزي عربي". www.alqamoos.org. مؤرشف من الأصل في 2020-01-26. اطلع عليه بتاريخ 2019-11-08.
- ^ Sinn، HP؛ Kreipe، H (مايو 2013). "A Brief Overview of the WHO Classification of Breast Tumors, 4th Edition, Focusing on Issues and Updates from the 3rd Edition". Breast Care (Basel, Switzerland). ج. 8 ع. 2: 149–154. DOI:10.1159/000350774. PMC:3683948. PMID:24415964.
- ^ Seltzer، William H. Hindle, editor; with a foreword by Vicki (1999). Breast care: a clinical guidebook for women's primary health care providers. New York: Springer. ص. 129. ISBN:9780387983486. مؤرشف من الأصل في 2020-01-26.
{{استشهاد بكتاب}}:|الأول1=باسم عام (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Staging, Breastcancer.org نسخة محفوظة 11 أغسطس 2019 على موقع واي باك مشين.
- ^ Welch HG، Woloshin S، Schwartz LM (فبراير 2008). "The sea of uncertainty surrounding ductal carcinoma in situ--the price of screening mammography". J. Natl. Cancer Inst. ج. 100 ع. 4: 228–9. DOI:10.1093/jnci/djn013. PMID:18270336.
- ^ Liberman، Laura (2005). Breast MRI. [New York]: Springer Science+Business Media, Inc. ص. 164. ISBN:9780387219974. مؤرشف من الأصل في 2020-01-26.
- ^ أ ب ت Virnig BA، Shamliyan T، Tuttle TM، Kane RL، Wilt TJ (سبتمبر 2009). "Diagnosis and management of ductal carcinoma in situ (DCIS)". Evidence Report/Technology Assessment. AHRQ Publication No.09-E018. ع. 185: 1–549. PMC:4781639. PMID:20629475. مؤرشف من الأصل في 2014-01-31.
- ^ Rubin's Pathology: clinicopathologic foundations of medicine (ط. 5.). Philadelphia [u.a.]: Wolters Kluwer/Lippincott Williams & Wilkins. 2008. ص. 848. ISBN:9780781795166. مؤرشف من الأصل في 2020-01-26.
{{استشهاد بكتاب}}: الوسيط غير المعروف|المحررين=تم تجاهله (مساعدة) - ^ Early Breast Cancer Trialists' Collaborative Group (EBCTCG)؛ Correa، C.؛ McGale، P.؛ Taylor، C.؛ Wang، Y.؛ Clarke، M.؛ Davies، C.؛ Peto، R.؛ Bijker، N. (2010). "Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast". Journal of the National Cancer Institute. Monographs. ج. 2010 ع. 41: 162–177. DOI:10.1093/jncimonographs/lgq039. ISSN:1745-6614. PMC:5161078. PMID:20956824.
- ^ "Breast Cancer Treatment (PDQ®)". NCI. 11 أبريل 2014. مؤرشف من الأصل في 2015-04-25. اطلع عليه بتاريخ 2014-06-19.
- ^ أ ب "Breast Cancer Treatment (PDQ®)". NCI. يناير 1980. مؤرشف من الأصل في 2015-04-06. اطلع عليه بتاريخ 2014-06-19.
- ^ أ ب ت Allred DC (2010). "Ductal carcinoma in situ: terminology, classification, and natural history". Journal of the National Cancer Institute. Monographs. ج. 2010 ع. 41: 134–8. DOI:10.1093/jncimonographs/lgq035. PMC:5161057. PMID:20956817. مؤرشف من الأصل في 2020-05-08.
- ^ Tjandra، Joe J.؛ Collins، John P. (2006). "Breast surgery". في Tjandra؛ وآخرون (المحررون). Textbook of surgery (ط. 3rd). Malden, Mass.: Blackwell Pub. ص. 282. ISBN:9780470757796.
- ^ Chang، Alfred (2007). Oncology: An Evidence-Based Approach. Springer. ص. 162. ISBN:9780387310565. مؤرشف من الأصل في 2016-04-24.
- ^ J. Saclarides (2008). Common surgical diseases an algorithmic approach to problem solving (ط. 2nd rev.). New York: Springer. ISBN:9780387752464. مؤرشف من الأصل في 2016-05-20.
{{استشهاد بكتاب}}: الوسيط غير المعروف|المحررين=تم تجاهله (مساعدة) - ^ "Breast Cancer". مؤرشف من الأصل في 2012-07-10. اطلع عليه بتاريخ 2010-06-28.
- ^ "Signs and Symptoms". مؤرشف من الأصل في 2010-09-26. اطلع عليه بتاريخ 2010-06-28.
- ^ "After the mammogram". مؤرشف من الأصل في 2010-04-07. اطلع عليه بتاريخ 2010-06-28.
- ^ "Intraductal Carcinoma of the Breast". مؤرشف من الأصل في 2010-06-11. اطلع عليه بتاريخ 2010-06-28.
- ^ "Ductal Carcinoma In Situ". cancer.gov. 9 يناير 2015. مؤرشف من الأصل في 2015-04-09. اطلع عليه بتاريخ 2015-03-05.
- ^ Mannu، Gurdeep S.؛ Bettencourt-Silva، Joao H.؛ Ahmed، Farid؛ Cunnick، Giles (2015). "A Nationwide Cross-Sectional Survey of UK Breast Surgeons' Views on the Management of Ductal Carcinoma In Situ". International Journal of Breast Cancer. ج. 2015: 104231. DOI:10.1155/2015/104231. PMC:4677188. PMID:26697227.
- ^ Ductal Carcinoma in Situ (DCIS), مدرسة طب جامعة جونز هوبكنز "نسخة مؤرشفة". مؤرشف من الأصل في 2015-04-24. اطلع عليه بتاريخ 2019-11-08.
- ^ أ ب "Treatment of ductal carcinoma in situ: an uncertain harm-benefit balance". Prescrire Int. ج. 22 ع. 144: 298–303. ديسمبر 2013. PMID:24600734.
- ^ أ ب ت ث Goodwin A، Parker S، Ghersi D، Wilcken N (2013). "Post-operative radiotherapy for ductal carcinoma in situ of the breast". The Cochrane Database of Systematic Reviews. ج. 11 ع. 11: CD000563. DOI:10.1002/14651858.CD000563.pub7. PMID:24259251.
- ^ Virnig، BA؛ Tuttle، TM؛ Shamliyan، T؛ Kane، RL (2010). "Ductal carcinoma in situ of the breast: a systematic review of incidence, treatment, and outcomes". Journal of the National Cancer Institute. ج. 102 ع. 3: 170–8. DOI:10.1093/jnci/djp482. PMID:20071685.
- ^ Correa، C.؛ McGale، P.؛ Taylor، C.؛ Wang، Y.؛ Clarke، M.؛ Davies، C.؛ Peto، R.؛ Bijker، N.؛ Solin، L.؛ Darby، S.؛ Darby، S (2010). "Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast". Journal of the National Cancer Institute. Monographs. ج. 2010 ع. 41: 162–177. DOI:10.1093/jncimonographs/lgq039. ISSN:1745-6614. PMC:5161078. PMID:20956824.
- ^ "NIH DCIS Consensus Conference Statement". National Institutes of Health. سبتمبر 2009. مؤرشف من الأصل في 2019-11-08.
- ^ أ ب "Intraductal carcinoma". مؤرشف من الأصل في 2016-04-10. اطلع عليه بتاريخ 2010-06-28.
- ^ Tan JC، McCready DR، Easson AM، Leong WL (فبراير 2007). "Role of sentinel lymph node biopsy in ductal carcinoma-in-situ treated by mastectomy". Annals of Surgical Oncology. ج. 14 ع. 2: 638–45. DOI:10.1245/s10434-006-9211-9. PMID:17103256.
- ^ van Deurzen CH، Hobbelink MG، van Hillegersberg R، van Diest PJ (أبريل 2007). "Is there an indication for sentinel node biopsy in patients with ductal carcinoma in situ of the breast? A review". European Journal of Cancer. ج. 43 ع. 6: 993–1001. DOI:10.1016/j.ejca.2007.01.010. PMID:17300928.
- ^ Basic Pathology، Robbins (2018). Breast. Copyright © 2018 by Elsevier Inc. ص. 743. ISBN:978-0-323-35317-5.
- ^ Kerlikowske، K.؛ Molinaro، A. M.؛ Gauthier، M. L.؛ Berman، H. K.؛ Waldman، F.؛ Bennington، J.؛ Sanchez، H.؛ Jimenez، C.؛ Stewart، K.؛ وآخرون (2010). "Biomarker Expression and Risk of Subsequent Tumors After Initial Ductal Carcinoma in Situ Diagnosis". JNCI Journal of the National Cancer Institute. ج. 102 ع. 9: 627–637. DOI:10.1093/jnci/djq101. PMC:2864293. PMID:20427430.
- ^ Witkiewicz AK، Dasgupta A، Nguyen KH، وآخرون (يونيو 2009). "Stromal caveolin-1 levels predict early DCIS progression to invasive breast cancer". Cancer Biology & Therapy. ج. 8 ع. 11: 1071–1079. DOI:10.4161/cbt.8.11.8874. PMID:19502809. مؤرشف من الأصل في 2020-03-27.
- ^ Kerlikowske، K (2010). "Epidemiology of ductal carcinoma in situ". Journal of the National Cancer Institute. Monographs. ج. 2010 ع. 41: 139–41. DOI:10.1093/jncimonographs/lgq027. PMC:5161058. PMID:20956818.
| سرطانة قنوية لابدة موضعية في المشاريع الشقيقة: | |
