|
تضامنًا مع حق الشعب الفلسطيني |
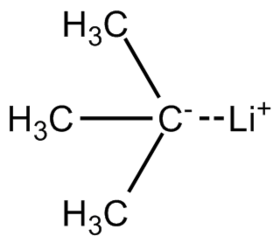
ثالثي بوتيل الليثيوم
| ثالثي بوتيل الليثيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
tert-Butyllithium |
|
| المعرفات | |
| الاختصارات | t-BuLi |
| رقم CAS | 594-19-4 |
| بوب كيم (PubChem) | 638178 |
| الخواص | |
| الصيغة الجزيئية | C4H9Li |
| الكتلة المولية | 64.055 غ/مول |
| المظهر | صلب عديم اللون |
| الكثافة | 660 مغ/سم3 |
| نقطة الانصهار | 140 °س (يتفكك) |
| الذوبانية في الماء | يتفاعل مع الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثالثي بوتيل الليثيوم (يرمز له اختصاراً t-BuLi) هو مركب ليثيوم عضوي له الصيغة C4H9Li والتي يمكن أن تكتب على الشكل CH3)3CLi).
التحضير
حضّر المركب لأول مرة من قبل روبرت وودورد عام 1941.[1]
تتضمن طريقة التحضير إجراء تفاعل بين بروميد ثالثي البوتيل مع مسحوق الليثيوم حسب التفاعل:
الخصائص
إن الرابطة بين الكربون والليثيوم في مركب ثالثي بوتيل الليثيوم مستقطبة بشكل كبير. بما أن الشحنة السالبة على الكربون كبيرة، يتفاعل الجزيء كأنه كربانيون كما هو موضّح من الصيغ الرنينيّة للمركب في الشكل.[2]
كما في مركب ن-بوتيل الليثيوم فإن ثالثي بوتيل الليثيوم يمكن استخدامه من أجل التبادل بين الليثيوم والهالوجين ومن أجل نزع بروتون الأمينات والمركبات الحاوية على رابطة C—H منشَّطة.
مثل بقية مركبات ألكيل الليثيوم فإن ثالثي بوتيل الليثيوم غير مستقر في المحلات الإيثيرية؛ حيث أن عمر النصف لهذا المركب هو 60 دقيقة عند 0 °س في ثنائي إيثيل الإيثر، و40 دقيقة عند -20 °س في رباعي هيدرو الفوران،[3] وحوالي 11 دقيقة عند -70 °س في ثنائي ميثوكسي الإيثان.[4]
تفاعل ثالثي بوتيل الليثيوم مع THF:
الاستخدامات
لهذا المركب العديد من التطبيقات في الاصطناع العضوي حيث أنه يعد قاعدة قوية كافية لنزع بروتون من الهيدروكربونات.
السلامة
إن مركب ثالثي بوتيل الليثيوم تلقائي الاشتعال، مما يعني أنه يشتعل بسهولة عند التماس مع الرطوبة أو الهواء عند درجات حرارة أقل من 55 °س. لذا فإن تماسه مع المحلات (المذيبات) القابلة للاشتعال يمكن أن يسبب حرائق.
المراجع
- ^ Bartlett، Paul D. (1941). J. Am. Chem. Soc. ج. 63 ع. 11: 3229–3230.
{{استشهاد بدورية محكمة}}: الوسيط|title=غير موجود أو فارغ (مساعدة) والوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Organometallic reagents: sources of nucleophilic carbon for alcohol synthesis. K. P. C. Vollhardt, N. E. Schore: Organic Chemistry : Structure And Function. 3rd edition, 1999, §8.7.
- ^ Stanetty, P; Koller, H.; Mihovilovic, M. (1992). "Directed ortho lithiation of phenylcarbamic acid 1,1-dimethylethyl ester (N-BOC-aniline). Revision and improvements". Journal of Organic Chemistry. ج. 57 ع. 25: 6833–6837. DOI:10.1021/jo00051a030.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Fitt, J. J.; Gschwend, H. E. (1984). "Reaction of n-, sec-, and tert-butyllithium with dimethoxyethane (DME): a correction". Journal of Organic Chemistry. ج. 49: 209–210. DOI:10.1021/jo00175a056.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
| ثالثي بوتيل الليثيوم في المشاريع الشقيقة: | |