|
تضامنًا مع حق الشعب الفلسطيني |
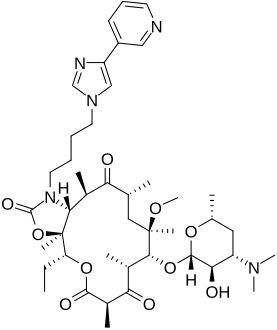
تيليثرومايسين
| تيليثرومايسين | |
|---|---|
| اعتبارات علاجية | |
| معرّفات | |
| بيانات كيميائية | |
| تعديل مصدري - تعديل |
تيليثرومايسين هو أول مضاد حيوي للكيتولايد يدخل في الاستخدام السريري ويُباع تحت الاسم التجاري كيتيك. يُستخدم لعلاج الالتهاب الرئوي المكتسب من المجتمع من خفيف إلى متوسط الشدة. بعد مخاوف كبيرة على السلامة، قلصت إدارة الغذاء والدواء الأمريكية بشكل حاد الاستخدامات المعتمدة للعقار في أوائل عام 2007. تيليثرومايسين هو مشتق الإريثروميسين شبه الاصطناعية.
وقد حصل على براءة اختراع في عام 1994 وتمت الموافقة عليه للاستخدام الطبي في عام 2001. [1]
التأثيرات الضائرة
الآثار الجانبية الأكثر شيوعًا هي الجهاز الهضمي، بما في ذلك الإسهال والغثيان وآلام البطن والقيء. الصداع واضطرابات في الذوق. تشمل الآثار الجانبية الأقل شيوعًا الخفقان وعدم الرؤية الواضحة والطفح الجلدي. قد تكون فترات QTc المطولة أيضًا ناتجة عن تيليثرومايسين. [2]
تم الإبلاغ عن آثار جانبية نادرة ولكن خطيرة في البداية مارس 2006، بما في ذلك تلف الكبد. [3] تم الإبلاغ عن ثلاث حوادث مختلفة: حالة واحدة من التهاب الكبد المؤقت الناجم عن المخدرات، واحدة تنتهي بعملية زرع كبد، وواحدة تنتهي بالوفاة.
في الولايات المتحدة، حدد مكتب الوبائيات والمراقبة التابع لإدارة الأغذية والأدوية FDA 12 حالة من حالات الفشل الحاد في الكبد، مما أسفر عن وفاة أربعة أشخاص، و23 حالة أخرى من الإصابات الحادة والخطيرة في الكبد، من بين 5.2 مليون مريض تناولوا التيلثروميسين حتى أبريل 2006. [4][5]
في عام 2010، وصف تقرير منشور آلية العمل المحتملة التي لا تكمن فقط في حالات فشل الكبد ولكن أيضًا حالات الاضطرابات البصرية وتفاقم الوهن العضلي الوبيل. أظهرت الدراسة أن شدة البيريدين التي تشكل جزءًا من جزيء تيليتروميسين تعمل كمضاد لمستقبلات الكولين الموجودة في الوصلة العصبية العضلية والعقدة الهدبية للعين والعصب المبهم الذي يعصب الكبد. لا تحتوي الماكروليدات الأخرى، مثل أزيثروميسين وكلاريثروميسين والفلوروكيتوليد، سوليترومايسين، على شحنة بيريدين ولا تستعد هذه المستقبلات الكولينية بشكل كبير. [6]
آلية العمل
تيليثرومايسين يمنع البكتيريا من النمو، عن طريق التدخل في إنشاء البروتين. يرتبط تيليثرومايسين بالوحدة الفرعية 50S من الريبوسوم البكتيري، [7] ويمنع تطور سلسلة الببتيد المتنامية. لدى تيليثرومايسين تقارب أعلى بمقدار 10 أضعاف للوحدة الفرعية 50S من الإريثروميسين. بالإضافة إلى ذلك، يرتبط التليثروميسين بقوة في نفس الوقت بنطاقين من 23S RNA للوحدة الفرعية الريباسومية 50 S، حيث ترتبط الماكروليدات القديمة بقوة فقط بمجال واحد وبضعف المجال الثاني. مثل العديد من مثبطات تخليق البروتين الأخرى، يمكن أن يمنع تيلثروميسين أيضًا تكوين وحدات فرعية من الريبوسوم 50S و 30S.
الحرائك الدوائية
على عكس الإريثروميسين، يكون التيليتروميسين ثابتًا في الحمض، ولذلك يمكن أن يؤخذ عن طريق الفم أثناء حمايته من الأحماض المعدية. يتم امتصاصه بسرعة إلى حد ما، وينتشر في معظم الأنسجة والبلعوم. بسبب التركيز العالي في الخلايا البالعة، يتم نقل التيلثروميسين بنشاط إلى موقع العدوى. خلال البلعمة النشطة، يتم إطلاق تركيزات كبيرة من تيليتروميسين. تركيز تيليثرومايسين في الأنسجة أعلى بكثير من تركيزه في البلازما. يفي تيليثرومايسين بالدور الذي نشأ نتيجة لارتفاع المقاومة الميكروبية لماكروليدات موجودة ويبدو أنه فعال ضد العقدية الرئوية المقاومة للبكترياketo. [8]
الأيض
يتم استقلاب تيليثرومايسين بشكل رئيسي في الكبد، ويكون الطريق الرئيسي للتخلص من الصفراء، ويتم أيضًا إخراج جزء صغير منه في البول. يفرز حوالي الثلث دون تغيير في الصفراء والبول، ويتم تفضيل الطريق الصفراوي. عمر النصف تيليثرومايسين هو ما يقرب من عشر ساعات.
تاريخ
بدأت شركة المستحضرات الصيدلانية الفرنسية هوكست (لاحقًا سانوفي) في المرحلة الثانية أو الثالثة من التجارب السريرية للتيلثروميسين (HMR-3647) في عام 1998. تمت الموافقة على تيليثرومايسين من قبل المفوضية الأوروبية في يوليو 2001، ثم تم بيعه في أكتوبر 2001. الولايات المتحدة، تلقى تيليثرومايسين موافقة إدارة الغذاء والدواء الأمريكية (FDA) في 1 أبريل 2004.
مراجع
- ^ Fischer, Jnos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery (بEnglish). John Wiley & Sons. p. 499. ISBN:9783527607495. Archived from the original on 2020-01-02.
- ^ Bertram G. Katzung, Susan B. Masters, Anthony J. Trevor Basic & Clinical Pharmacology, 11e McGraw-Hill 2009 via "accessmedicine.com"
- ^ Clay KD، وآخرون (2006). "Brief communication: severe hepatotoxicity of telithromycin: three case reports and literature review". Annals of Internal Medicine. ج. 144 ع. 6: 415–420. DOI:10.7326/0003-4819-144-6-200503210-00121. PMID:16481451.
- ^ https://web.archive.org/web/20170517005728/https://www.fda.gov/ohrms/dockets/ac/06/slides/2006-4266s1-01-07-FDA-Brinker.ppt. مؤرشف من الأصل في 2017-05-17. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) والوسيط|title=غير موجود أو فارغ (مساعدة) - ^ "Fraud, Errors Taint Key Study Of Widely Used Sanofi Drug - WSJ". مؤرشف من الأصل في 2019-12-31.
- ^ Bertrand، D؛ Bertrand، S؛ Neveu، E؛ Fernandes، P (2010). "Molecular Characterization of Off-Target Activities of Telithromycin: a Potential Role for Nicotinic Acetylcholine Receptors". Antimicrobial Agents and Chemotherapy. ج. 54 ع. 12: 5399–5402. DOI:10.1128/aac.00840-10. PMC:2981250. PMID:20855733.
- ^ Eyal, Z.؛ Matzov, D.؛ Krupkin, M.؛ Wekselman I.؛ Paukner S.؛ Zimmerman, E.؛ Rozenberg, H.؛ Bashan, A.؛ Yonath, A. (2015). "Structural insights into species-specific features of the ribosome from the pathogen Staphylococcus aureus". Proc Natl Acad Sci U S A. ج. 112 ع. 43: E5805–14. DOI:10.1073/pnas.1517952112. PMC:4629319. PMID:26464510.
- ^ Scheinfeld N. Telithromycin: A brief review of a new ketolide antibiotic. J Drug Dermat 2004;3:409-13. ببمد: 15303785
روابط خارجية
- استشارات الصحة العامة FDA لـ تيليثرومايسين (يتم تسويقها باسم Ketek)
- مقال في حوليات الطب الباطني فيما يتعلق بحالات التسمم الكبدي الناجم عن تيليثرومايسين
- نيويورك تايمز المادة. تسجيل الدخول مطلوب
- الأدوية والعلاجات - KETEK Oral - نشرة المرضى من ويب ام دي
| تيليثرومايسين في المشاريع الشقيقة: | |