|
تضامنًا مع حق الشعب الفلسطيني |
تهجين مداري
التهجين في علم الكيمياء هو عملية خلط أو إندماج أو اتحاد بين مدارين أو أكثر للإلكترونات في نفس الذرة مختلفين.[1][2][3] ويكونان متقاربين في الطاقة لتنتج مدارات مهجنة جديدة متكافئة في الطول والطاقة. ويحدث التهجين في نفس الذرة الواحدة وينتج مدارات متكافئة في الشكل والطول والطاقة. ويجب أن تكون الذرة مثارة.وأن تكون المدارات متقاربة في الطاقة مثل 2S مع 2P أو 4s مع 3d. وتكون عدد المدارات المهجنة مساوية لعدد المدارات النقية الداخلة في التهجين.وتكون المدارات المهجنة أكثر بروزاً إلى الخارج لتكون قدرتها على التداخل أقوى من قدرة المدارات العادية.
التهجين في ذرة الكربون
التهجين في الكيمياء هو عملية الحصول على مجالات ذرية جديدة في ذرة عنصر ما نتيجة دمج مجالات ذرية معينة موجودة في مستوى طاقة معين.
ففي ذرة الكربون مثلاً يمكن أن يحدث ثلاثة أنواع من التهجين، يتم في النوع الأول دمج مجال واحد من نوع S مع ثلاث مجالات من نوع P في مستوى الطاقة الرئيسي الثاني ليتكون أربع مجالات مهجنة جديدة من نوع SP3.
وفي النوع الثاني يندمج مجال واحد من نوع S مع مجالين من نوع P ليتكون ثلاث مجالات مهجنة من نوع SP2.
وفي النوع الثالث يندمج مجال واحد من نوع S مع مجال واحد من نوع P ليتكون مجالين مهجنين من نوع SP.
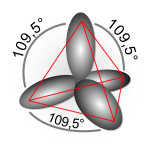
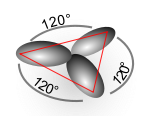
بعض الحقائق التي أثبتتها دراسة أشعة X والتي تمت على بعض الجزيئات تبين أن جميع الروابط التي تربط بين الكربون والهيدروجين في جزيء الميثان روابط متشابهة والزاوية بينها تساوي 109.5 درجة، بينما الزوايا في الايثيلين 120 درجة وفي الاسيتلين 180 درجة.
وفيما يلي تفصيل لعملية التهجين في الكربون:
التهجين في ذرة الكربون المشبعة (في الألكانات)
من المعروف أن التوزيع الإلكتروني العادي لذرة الكربون ذات الستة إلكترونات هو: 1S2 2S2 2P2
ووفق قاعدة هوند يصبح التوزيع الإلكتروني للكربون كالتالي: 1S2 2S2 2Px1 2Py1
السؤال الآن هل يمكن لذرة الكربون في الميثان مثلاً أن ترتبط بالهيدروجين وفق هذا التوزيع ؟
الجواب بالطبع لا ... لأن ذرة الكربون هنا تحتوي على مجالين نصف ممتلئين فقط ولو ارتبطت بهذا التوزيع مع الهيدروجين لتكون لنا جزيء صيغته CH2. وهذا الجزيء لا وجود له.
ولكي ترتبط ذرة الكربون بأربعة ذرات هيدروجين وتكون جزيء الميثان يجب أن يكون هناك أربعة مجالات نصف ممتلئة يحوي كل مجال إلكترون واحد.
هذا الكلام معقول إذن المشكلة الآن هو لابد من توفر أربعة مجالات نصف ممتلئة بالإلكترونات وهذا ممكن فبالإمكان أن ينتقل إلكترون من المجال 2S إلى المجال 2P لتتكون ذرة كربون مثارة بحيث تتوزع فيها الإلكترونات كالتالي: 1S2 2S1 2Px1 2Py1 2Pz1
ولكن هذا التصور أيضاً غير صحيح فلو ارتبطت ذرة الكربون المثارة هذه بالهيدروجين فسيتكون فعلاً جزيء صيغته CH4 ولكن ستكون هناك رابطة واحدة مختلفة كما أن الزوايا الناتجة لن تكون 109.5 درجة بل ستكون 90 درجة.
إذاً كيف ترتبط ذرة الكربون بالهيدروجين في الميثان ؟؟؟
الجواب عند نظرية التهجين التي تقول أنه لكي ترتبط ذرة الكربون بأربعة ذرات هيدروجين وتكون جزيء الميثان يجب أن يتوفر في ذرة الكربون أربعة مجالات متشابهة ونصف ممتلئة وتكون الزوايا بينها 109.5 درجة وهذا يتأتى بدمج المجال S الموجود في مستوى الطاقة الثاني مع ثلاث مجالات من نوع P لتتكون أربعة مجالات جديدة من نوع SP3 بحيث تكون هذه المجالات الأربع في أركان هرم رباعي السطوح والزوايا بينها 109.5 درجة.
بحيث يكون التوزيع الإلكتروني لذرة الكربون المشبعة كالتالي: 1S2 2( SP3)1 ( SP3)1 ( SP3)1 ( SP3)1
وبهذا التصور يتكون جزيء الميثان CH4 الذي يتخذ شكل هرم رباعي السطوح منتظم في الفراغ وتكون جميع الروابط الأربعة متشابهة والزوايا بينها 109.5 درجة وهذا ما أشارت إليه دراسات أشعة X التي أجريت على جزيء الميثان.
التهجين في ذرة الكربون غير المشبعة (في الألكينات)
في ذرة الكربون التي ترتبط برابطة ثنائية فإنه يتم دمج مجال من نوع S مع مجالين فقط من P ليتكون ثلاث مجالات من نوع SP2 ويظل مجال من نوع P خارج عملية التهجين وتكون هذه المجالات الثلاث في أركان مثلث متساوي الأضلاع والزوايا بينها 120 درجة.
وعند تكوين جزيء الايثيلين مثلاً فإن أحد هذه المجالات الثلاث من نوع SP2 تكون رابطة من نوع سيجما بينما يدخل المجال P الذي لم يشارك في عملية التهجين في تكوين الرابطة باي.
وبهذا يصبح التوزيع الإلكتروني لذرة الكربون غير المشبعة في الالكينات كالتالي: 1S2 2(SP2) 1(SP2) 1(SP2) 1 Pz1
التهجين في ذرة الكربون غير المشبعة (في الألكاينات)
في ذرة الكربون التي ترتبط برابطة ثلاثية فإنه يتم دمج مجال من نوع S مع مجال واحد فقط من نوع P ليتكون مجالين من نوع SP ويظل مجالين من نوع P خارج عملية التهجين وتكون هذين المجالين في شكل مستقيم والزاوية بينها 180 درجة.
وعند تكوين جزيء الاسيتلين مثلاً فإن أحد هذين المجالين من نوع SP تكون رابطة من نوع سيجما بينما يدخل المجالين P الذين لم يدخلا في عملية التهجين في تكوين رابطتين من نوع باي.
وبهذا يصبح التوزيع الإلكتروني لذرة الكربون غير المشبعة في الالكاينات كالتالي: 1S2 2(SP)1(SP)1 Py1 Pz1
مراجع
- ^ Angelo R. Rossi؛ Roald. Hoffmann (1975). "Transition metal pentacoordination". Inorganic Chemistry. ج. 14 ع. 2: 365–374. DOI:10.1021/ic50144a032.
- ^ Kutzelnigg, W. (أغسطس 1988). "Orthogonal and non-orthogonal hybrids". Journal of Molecular Structure: THEOCHEM. ج. 169: 403–419. DOI:10.1016/0166-1280(88)80273-2. مؤرشف من الأصل في 2015-09-24.
- ^ King، R. Bruce (2000). "Atomic orbitals, symmetry, and coordination polyhedra". Coordination Chemistry Reviews. ج. 197: 141–168. DOI:10.1016/s0010-8545(99)00226-x.
| تهجين مداري في المشاريع الشقيقة: | |