|
تضامنًا مع حق الشعب الفلسطيني |
تضخم البروستات الحميد
| تضخم البروستات الحميد | |
|---|---|
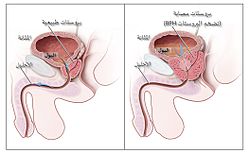
مخطط يوضح حجم البروستات الطبيعي (اليسار) وتضخم البروستات الحميد (اليمين).
| |
| تسميات أخرى | adenofibromyomatous hyperplasia, benign prostatic hypertrophy |
| معلومات عامة | |
| الاختصاص | طب الجهاز البولي |
| تعديل مصدري - تعديل | |
تضخم البروستات الحميد[1] أو ضخامة البروستات، واسمها طبيًا فرط تنسج البروستاتة الحميد (بالإنجليزية: Benign prostatic hyperplasia) (اختصارًا BPH)[2][3][4] وهو تضخم تشريحي في غدة البروستات يصيب الرجال مع تقدم العمر ويؤدي إلى أعراض بولية مزعجة أكثر من كونه مرض خطير.
نظرة تشريحية
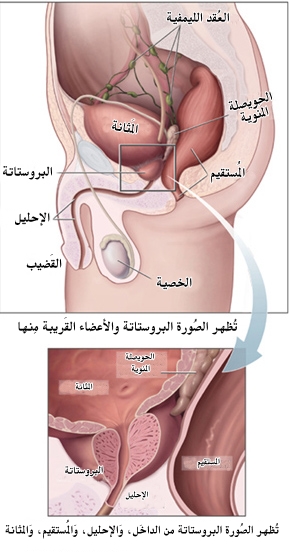
- تعريف: البروستات غدة من أعضاء الجهاز التناسلي عند الرجل فقط، تحيط بجزء من الإحليل داخل البطن.
- الموقع: تقع البروستات أسفل المثانة Bladder بين عظم العانة أماماً والمستقيم خلفاً.
- تكوينها: تتألف غدة البروستات تشريحياً من فصين Lobes جانبيين في الخلف، وفصين ثانويين، أحدهما في الوسط والثاني خلف الحبل المنوي.
- الحجم والوزن: حجم غدة البروستات عند الشخص الطبيعي 3 سم طولاً و4 سم عرضاً ووزنها حوالي 25غ. ويزداد حجمها مع تقدم العمر، حتى أنها تصبح بعد الستين ضعف أو ثلاثة أضعاف حجمها الأصلي.
- الوظيفة: وظيفتها إفراز سائل لزج يزداد إفرازه بشكل انعكاسي مع الإثارة والعملية الجنسية.
وعند القذف يخرج كسائل منوي (سائل البروستات + الحيوانات المنوية)، حيث يستطع هذا السائل تأمين وسيلة النقل للحيوانات المنوية وتأمين الوسط والغذاء والحماية لها أثناء رحلتها الخارجية لإتمام عملية الإلقاح.
المرضيات
يصاب أكثر من 60% من الرجال بعد سن الخمسين بضخامة غدة البروستات، وأسباب هذا المرض غير معروفة تماماً حتى الآن، لكن قد تلعب بعض الهرمونات الأندروجينية دوراً في ذلك، حيث يتحول هرمون التستوستيرون إلى مركب دي هيدروتستيرون Dihydrotestosterone أو اختصاراً (DHT) وإن تأثير هذا المركب على البروستات يؤدي غلى ضخامتها، كما أن هذا المركب هو المسؤول عت تساقط الشعر لدى الذكور (الصلع).
تكمن أهمية ضخامة غدة البروستات في إحداثها لانسداد تشريحي في عنق المثانة التي تتحكم في آلية طرح البول خارج الجسم، وإذا لم تعالج تؤدي إلى احتباس البول في المثانة والحالبين، حيث يحدث في المراحل النهائية استسقاء الكليتين (ضخامة الكليتين بعد انسداد مجرى البول)، وإذا استمر هذا الاستسقاء لفترة طويلة فهذا يؤدي إلى قصور الكليتين الوظيفي.
الأسباب
الهرمونات
يعتقد معظم الخبراء أن للأندروجينات (التستوستيرون والهرمونات الشبيهة) دورًا مؤهبًا في تضخم البروستات الحميد، أي إن وجود الأندروجينات ضروري لتطور تضخم البروستات الحميد، لكنه لا يسبب بالضرورة وبشكل مباشر الإصابة. الدليل الذي يدعم ذلك هو أن الأولاد المخصيين لا يُصابون به عند التقدم في السن. في دراسة غير مألوفة أُجريت على 26 فردًا مخصيًا في قصر أسرة تشينغ التي ما زالت تعيش في بكين في عام 1960، لم يكن جسّ البروستات ممكنًا عند 81% من المخصيين الخاضعين للدراسة.[5] متوسط زمن الإخصاء 54 سنة (المدى، 41-65 سنة). في الجانب الآخر، تظهر بعض الدراسات أن إعطاء التستوستيرون الخارجي لا يترافق مع زيادة ملحوظة في خطر تطور أعراض تضخم البروستات الحميد، ومن ثم فإن دور التستوستيرون في سرطان البروستات وتضخم البروستات الحميد ما زال غير واضح. لا بد من إجراء المزيد من التجارب المنضبطة المعشّاة على مزيد من الأفراد لتحديد مدى تأثير التستوستيرون الخارجي.[6]
الديهدروتستوستيرون هو مستقلَب للتستوستيرون، ووسيط أساسي في نمو البروستات. يُصنّع الديهدروتستوستيرون في البروستات من التستوستيرون الجائل في الدم بواسطة الأنزيم 5 ألفا ريدوكتاز، النمط 2. يمارس الديهدروتستوستيرون دور هرمون صماوي ذاتي (يؤثر في الخلايا التي أنتجته) على الخلايا اللحمية أو يمارس دور هرمون نظير صماوي (يؤثر في الخلايا المجاورة) فينتشر إلى الخلايا الظهارية المجاورة. في كلا النمطين، يرتبط الديهدروتستوستيرون بمستقبلات الأندروجين النووية ويقدح إشارة نسخ عوامل النمو الخاصة بالانقسام الخلوي في الخلايا الظهارية وخلايا اللُحمة. الديهدروتستوستيرون أقوى بعشرة أضعاف من التستوستيرون لأنه ينفصل عن مستقبلات الأندروجين ببطء. تدعم الملاحظات السريرية دور الديهدروتستوستيرون في إحداث التضخم العقدي في البروستات، إذ تُشاهد هذه التأثيرات عند إعطاء مثبطات 5 ألفا ريدوكتاز مثل الفيناسترايد للرجال الذين يعانون هذه الحالة. يؤدي العلاج بمثبطات إنزيم 5 ألفا ريدوكتاز إلى إنقاص الديهدروتستوستيرون في البروستات ومن ثم تراجع حجم البروستات وأعراض التضخم الحميد.[7][8]
يعزز هرمون التستوستيرون تكاثر خلايا البروستات، ولكن مستوى التستوستيرون في الدم عند مرضى تضخم البروستات الحميد منخفض نسبيًا. أظهرت دراسة صغيرة أن الإخصاء الطبي يخفض مستويات التستوستيرون والديهدروتستوستيرون في المصل والبروستات بشكل غير متماثل، إذ يكون تأثيره على مستويات هذه الهرمونات في البروستات أقل.[9]
في حين أن هناك بعض الأدلة حول دور هرمون الإستروجين في تضخم البروستات الحميد، يبدو أن هذا التأثير يرجع بشكل رئيسي إلى تحول الأندروجينات إلى الإستروجين في أنسجة البروستات ولا يؤثر الإستروجين بذاته بشكل مباشر. في الدراسات على الكلاب الحية، أدى الإخصاء الذي خفض مستويات الأندروجين بشكل كبير دون أي تأثير على مستويات الإستروجين إلى ضمور كبير في البروستات. لم تجد الدراسات أي علاقة بين تضخم البروستات ومستويات هرمون الإستروجين في المصل عند البشر بشكل عام.[10][11]
في عام 2008، نشر جات وآخرون دليلًا على أن تضخم البروستات الحميد ناتج عن قصور في نظام التصريف الوريدي المنوي، ما يؤدي إلى زيادة الضغط الهيدروستاتيكي في البروستات وارتفاع مستويات التستوستيرون الموضعي أكثر من 100 ضعف مقارنة مع المستويات المصلية.[12] تشرح هذه الآلية في حال ثبوتها سبب عدم الترابط بين مستويات الأندروجين في المصل والتضخم البروستاتي الحميد، وسبب عدم وجود فروق كبيرة عند إعطاء التستوستيرون الخارجي.
النظام الغذائي
تشير الدراسات إلى أن نمط الغذاء قد يؤثر على تطور تضخم البروستات الحميد، ولكننا بحاجة إلى المزيد من الأبحاث لكشف وجود أي علاقة مهمة. تشير الدراسات التي أُجريت في الصين إلى أن تناول كميات أكبر من البروتين قد يكون عاملًا مؤثرًا في تضخم البروستات الحميد. وُجد أن معدل إصابة الرجال فوق 60 عامًا بتضخم البروستات السريري في المناطق الريفية منخفض جدًا، في حين ارتفع معدل الإصابة عند الرجال الذين يعيشون في المدن ويستهلكون كميات أكبر من البروتين الحيواني. من جهة أخرى، وجدت دراسة أُجريت على الرجال اليابانيين الأمريكيين في هاواي علاقة سلبية قوية بين الإصابة وتناول الكحول، وعلاقة إيجابية ضعيفة بين الإصابة وتناول لحوم البقر. في دراسة حشدية استباقية كبيرة في الولايات المتحدة (دراسة متابعة المهنيين الصحيين)، أبلغ الباحثون عن وجود ارتباطات ضئيلة بين تضخم البروستات الحميد (رجال لديهم أعراض مهمة أو تضخم مؤكد جراحيًا) وإجمالي الوارد من الطاقة والبروتين، دون وجود علاقة مع وارد الدهون. هناك أيضًا أدلة وبائية تربط تضخم البروستات الحميد بالمتلازمة الأيضية (سمنة، وخلل استقلاب الغلوكوز وداء سكري، وارتفاع مستويات الشحوم الثلاثية، وارتفاع مستويات الكوليسترول منخفض الكثافة، وارتفاع ضغط الدم).[13]
التنكس
يرتبط تضخم البروستات الحميد بالتقدم بالسن. تشير نظرية تراكم الإصلاح المعيب في الشيخوخة إلى أن تضخم البروستات الحميد ناجم عن تليف الأنسجة العضلية في البروستات وضعفها.[14][15] للنسيج العضلي دور مهم في وظيفة البروستات، وهو يوفر بتقلصه القوة اللازمة لإفراغ السائل الذي تنتجه البروستات، لكن التقلصات والارتخاءات المتكررة في الألياف العضلية ستؤدي حتمًا إلى تأذيها وتمزقها. تملك الألياف العضلية قابلية ضعيفة للتجدد، لذا تُستبدل بالألياف المتأذية أليافُ الكولاجين. يجعل هذا الإصلاح المعيب النسيج العضلي ضعيفًا وظيفيًا، وغير قادر على إفراغ السائل الذي تفرزه البروستات بشكل كامل. يؤدي تراكم السوائل في الغدد البروستاتية إلى زيادة مقاومة الأنسجة العضلية خلال حركات التقلص والارتخاء، فيتأذى المزيد من الألياف العضلية وتحل محلها ألياف الكولاجين.
علم الأوبئة
يكبر حجم البروستات عند معظم الرجال حين يكبرون في السن. عموماً أكثر من 45% من الرجال فوق سن ال46 يمكن أن يعانوا من عوارض الاختصار إذا عاشوا أكثر من ثلاثين سنة. تزيد معدلات الإصابة من 3 حالات لكل ألف رجل بين سن 45-59. 38 حالة من أصل 1000 رجل بين سن 75-79. في حين أن نسبة انتشار هذا المرض هي 2.7% للرجال الذين تتراوح أعمارهم بين 45-49 وترتفع إلى نسبة 24% في سن ال80.
الأعراض
تختلف شدة الأعراض ونوعها تبعاً لكل مريض وتزادا هذه الاعراض مع ازدياد الضخامة، وهي أعراض بولية:
1-زيادة فترة التردد قبل البدء بالتبول، حيث تزداد الفترة التي ينتظر فيها الشخص لخروج البول بشكل منفعل.
2 ـ استعمال الجهد أثناء التبول، ويضطر الشخص لاستخدام الضغط الداخلي لدفع البول للخارج.
3 ـ ضعف قوة رشق أو دفق البول التبول حيث يكون ضعيفاً أو متقطعاً وبشكل نقط في بعض الأحيان..
4- تشعب البول عند خروجه.
5 ـ تعدد البيلات (البوال) ليلي أو نهاري، وتكون الحالة أكثر إزعاجاً ليلاً لأنها توقظ المريض عدة مرات من نومه وتسبب له الإرهاق أيضاً.
6 ـ الشعور بعدم إفراغ المثانة بشكل كامل.
7 ـ حرقة في البول، خاصةً إذا كانت الضخامة مترافقة مع التهاب.
8 ـ خروج الدم مع البول أحياناً.
9- سلس البول الإلحاحي.
10 - حدوث حصر بولي تام في المراحل الأخيرة مع ضخامة في البطن وألم شديد.
التشخيص
- الأعراض البولية.
- الفحص الشرجي للبروستات لتحري نوعية الضخامة ونفي أن تكون هذه الضخامة سرطانية.
- قياس المتبقي من البول في المثانة بعد التبول (الثمالة البولية).
- اختبار قياس ضغط وعصبية المثانة.
- اختبار قياس جريان البول.
- تصوير البروستات بالموجات فوق الصوتية (الأيكو).
- وهناك فحص دموي يدعى PSA يطلب للتفريق بين الضخامة الحميدة وسرطان البروستات.
- التنظير البولي السفلي أحياناً بإدخال منظار مجهز بمنبع ضوئي عبر الإحليل بتخدير موضعي لكشف الضخامة عيانياً.
الوقاية ونصائح لتخفيف التضخم
- خفف من تناول مضادات الاحتقان (أدوية الزكام) أو مضادات الهيستامين (أدوية الحساسية) فهذه العقاقير تشد العضلات حول الإحليل الذي يتحكم في دفق البول مما يزيد من صعوبة التبول أو حتى احتباس بولي تام.
- الابتعاد عن المهيجات الجنسية.
- تنظيم أوقات العملية الجنسية.
- معالجة الإمساك إن وجد.
- الامتناع عن تناول التوابل والبهارات (المخرشات).
- الامتناع عن التدخين والكافيين والمشروبات الكحولية.
- تجنب شرب السوائل قبل ساعة أو ساعتين قبل موعد النوم.
- حين تشعر بحاجة ملحة للتبول اذهب إلى الحمام فالانتظار لوقت طويل قد يؤذى عضلة المثانة.
- إجراء الفحص الدوري السنوي للرجال لدى الطبيب بعد سن الأربعين.
العلاج

تختلف طرق المعالجة حسب المريض وحسب التقييم وتلخص أساليب المعالجة في:
المعالجة الدوائية
- بالحالات البسطية: يمكن استخدام حبوب زيت بذور القرع (بالإنجليزية: Pumpkin seed oil).[16]
- بالحالات المتوسطة: باستخدام أدوية حاصرة لمستقبلات ألفا (بالإنجليزية: Alpha Blockers) وهي تفيد في إرخاء العضلات في عنق المثانة مما يسهل إفراغها. تأثير هذه الأدوية سريع خلال 1 إلى 3 أيام ومنها دوكسازوسين (بالإنجليزية: Doxazocine)، تيرازوسين (بالإنجليزية: Terazocine)، ألفوزوسين (بالإنجليزية: alfuzosin)، تامسولاسين (بالإنجليزية: tamsulosin).
- معالجة لكبح تأثير المركب المشار إليه سابقاُ (DHT) ويستخدم لذلك دواء (بالإنجليزية: Finasteride) أو دواء دوتاستيرايد وهي ليست من حاصرات المستقبلات ألفا.
- بالحالات الشديدة: يستفيد المرضى من مشاركة دوائين معاً
المعالجة الجراحية
- المعالجات الحديثة: استئصال البروستات عبر الإحليل يعتبر الحل الأفضل والأكثر شيوعا وفعالية في علاج مشاكل تضخم البروستات بشكل نهائي. يحصل هذا بالتنظير عبر فوهة القضيب. بعض المضاعفات تتضمن القذف العكسي، السلس البولي، مشاكل الانتصاب، تضيّق الإحليل، وغيرها.[17] العلاج بالامواج القصيرة (Microwave) أو بالتبخير Electro vaporization ما زالا غير شائعين.
- الجراحة التقليدية.عبر شق واستئصال البروستات تستخدم عندما تكون البروستات ضخمة جداً
يلجأ البعض أحياناً لوضع قطعة معدنية ضمن الإحليل المتضيق (Stent)، تُبقى المنطقة المتضيقة مفتوحة، وذلك عبر التنظير وهذه الطريقة تستخدم للمرضى غير القابلين للعلاج الدوائي أو الجراحي.
انظر أيضاً
المراجع
- ^ القاموس الطبي نسخة محفوظة 11 يناير 2020 على موقع واي باك مشين.
- ^ Gu، F (مارس 1997). "Changes in the prevalence of benign prostatic hyperplasia in China". Chinese medical journal. ج. 110 ع. 3: 163–6. PMID:9594331.
- ^ Kuang M، Vu A، Athreya S (2017). "A systematic review of prostatic artery embolization in the treatment of symptomatic benign prostatic hyperplasia". Cardiovasc Intervent Radiol. ج. 40 ع. 5: 655–663. DOI:10.1007/s00270-016-1539-3. PMID:28032133. مؤرشف من الأصل في 2018-06-12.
- ^ "Urination – difficulty with flow". MedlinePlus. US National Library of Medicine. مؤرشف من الأصل في 6 أكتوبر 2015. اطلع عليه بتاريخ 26 أكتوبر 2015.
- ^ Wu، CP؛ Gu، FL (1991). "The prostate in eunuchs". Prog Clin Biol Res. ج. 370: 249–55. PMID:1924456.
- ^ "Testosterone and Aging: Clinical Research Directions". NCBI Bookshelf. مؤرشف من الأصل في 5 نوفمبر 2017. اطلع عليه بتاريخ 2 فبراير 2015.
- ^ "Proscar (finisteride) Prescribing Information" (PDF). FDA – Drug Documents. Merck and Company. مؤرشف (PDF) من الأصل في 3 مارس 2016. اطلع عليه بتاريخ 2 مارس 2015.
- ^ Bartsch، G؛ Rittmaster، RS؛ Klocker، H (2002). "Dihydrotestosterone and the concept of 5alpha-reductase inhibition in human benign prostatic hyperplasia". World J Urol. ج. 19 ع. 6: 413–25. DOI:10.1007/s00345-002-0248-5. PMID:12022710.
- ^ Page، S. T.؛ Lin، D. W.؛ Mostaghel، E. A.؛ Hess، D. L.؛ True، L. D.؛ Amory، J. K.؛ Nelson، P. S.؛ Matsumoto، A. M.؛ Bremner، W. J. (2006). "Persistent Intraprostatic Androgen Concentrations after Medical Castration in Healthy Men". Journal of Clinical Endocrinology & Metabolism. ج. 91 ع. 10: 3850–6. DOI:10.1210/jc.2006-0968. PMID:16882745.
- ^ Ansari، Mohammad Abduljalil؛ Begum، Dilruba؛ Islam، Fakhrul (2008). "Serum sex steroids, gonadotrophins and sex hormone-binding globulin in prostatic hyperplasia". Annals of Saudi Medicine. ج. 28 ع. 3: 174–8. DOI:10.4103/0256-4947.51727. PMC:6074428. PMID:18500180.
- ^ Ho، C. K M؛ Nanda، J.؛ Chapman، K. E؛ Habib، F. K (2008). "Oestrogen and benign prostatic hyperplasia: effects on stromal cell proliferation and local formation from androgen". Journal of Endocrinology. ج. 197 ع. 3: 483–91. DOI:10.1677/JOE-07-0470. PMID:18492814.
- ^ Gat، Y؛ Gornish، M؛ Heiblum، M؛ Joshua، S (2008). "Reversal of benign prostate hyperplasia by selective occlusion of impaired venous drainage in the male reproductive system: novel mechanism, new treatment". Andrologia. ج. 40 ع. 5: 273–281. DOI:10.1111/j.1439-0272.2008.00883.x. PMID:18811916.
- ^ Gacci، M (2015). "Metabolic syndrome and benign prostatic enlargement: a systematic review and meta-analysis". BJU International. ج. 115 ع. 1: 24–31. DOI:10.1111/bju.12728. PMID:24602293.
- ^ Wang، Jicun؛ Michelitsch، Thomas؛ Wunderlin، Arne؛ Mahadeva، Ravi (2009). "Aging as a consequence of Misrepair –a novel theory of aging". ج. 0904 ع. 575. arXiv:0904.0575. Bibcode:2009arXiv0904.0575W.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Wang-Michelitsch، Jicun؛ Michelitsch، Thomas (2015). "Aging as a process of accumulation of Misrepairs". ج. 1503 ع. 7163. arXiv:1503.07163. Bibcode:2015arXiv150307163W.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Hong، Heeok؛ Kim، Chun-Soo؛ Maeng، Sungho (2009). "Effects of pumpkin seed oil and saw palmetto oil in Korean men with symptomatic benign prostatic hyperplasia". Nutrition Research and Practice. ج. 3 ع. 4: 323–327. DOI:10.4162/nrp.2009.3.4.323. ISSN:1976-1457. PMID:20098586. مؤرشف من الأصل في 2017-01-19.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Transurethral resection of the prostate (TURP) - Risks". nhs.uk (بEnglish). 24 Oct 2017. Archived from the original on 2020-02-18. Retrieved 2020-03-08.
| في كومنز صور وملفات عن: تضخم البروستات الحميد |