|
تضامنًا مع حق الشعب الفلسطيني |
تجربة منضبطة معشاة
تحتاج هذه المقالة إلى الاستشهاد بمصادر إضافية لتحسين وثوقيتها. |
التجربة المنضبطة المعشّاة (يرمز لها RCT من randomised controlled trial أو randomised control trial) [1] هي نوع من أنماط البحث العلمي التجريبي، خاصة في مجال الطب، حيث أن الناس الخاضعين للدراسة يُخصَّصُون عشوائياً بواحدة أو أكثر من وسائل العلاج المختلفة تحت الدراسة. تُعد التجارب المنضبطة المعشاة معيار اختبار ذهبي في التجارب السريرية، وهي تستخدم من أجل اختبار نجاعة الأنماط المختلفة من التدخلات الطبية، ويمكن أن تزود بمعلومات حول التفاعلات الدوائية الضائرة.
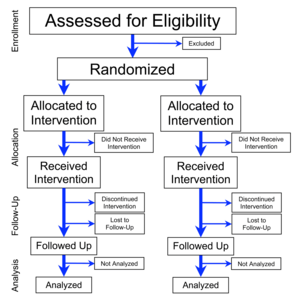
تجربة العشوائية المنتظمة (أو التجربة العشوائية المضبوطة؛ [2] RCT) هو نوع من التجربة العلمية (غالبا الطبية؛ حيث يتم الاختيار بشكل عشوائي من الناس لإجراء دراسة على نوع من الأدوية أو مختلف الأنواع. وغالبا ما ينظر إلى RCT بأنه المعيار الذهبي للتجربة السريرية. وغالبا ما تستخدم RCTs لاختبار فعالية أو تأثير أنواع مختلفة من الاجراءات الطبية ويمكن أن توفر معلومات بشأن الآثار السلبية، مثل تفاعلات الدواء. ويتم التوزيع العشوائي للتدخل بعد أن يتم تقييم العناصر للأحقية والتطوع، ولكن قبل أن يبدأ التدخل لدراستها. التوزيع العشوائي في التجارب الحقيقية هي معقدة، ولكن من الناحية النظرية، والعملية هي مثل قذف عملة. بعد التوزيع العشوائي، يتم اتباع مجموعتين (أو أكثر) من مجموعة من العناصر بنفس الطريقة تماما، والاختلاف الوحيد هو بين التدخل التي يتلقونه، على سبيل المثال، فيما يتعلق بالإجراءات، والاختبارات، وزيارات العيادات الخارجية ومتابعة المكالمات، ينبغي أن تكون تلك جوهرة للعلاجات التي يجري مقارنتها. أهم ميزة من التوزيع العشوائي الصحيح هو أنه يقلل من انحراف التوزيع، وتحقيق التوازن في العوامل التنبؤية المعروفة وغير المعروفة، في تقييم العلاجات.[3] المصطلحات "RCT" والتجربة العشوائية تستخدم في بعض الأحيان بشكل مترادف، ولكن الممارسة السليمة منهجيا هو أن نحتفظ "RCT" بالاسم فقط للتجارب التي تحتوي على مجموعات المقارنة، التي تتم مقارنة مجموعة تتلقى العلاج التجريبي مع مجموعات المقارنة التي لا تتلقى أي علاج (الدواء الوهمي -دراسة يتم اعطاء المريض فيها شيء غير الدواء) أو العلاج المختبر سابقا (دراسة مراقبة إيجابية). مصطلح «التجربة العشوائية» يغفل ذكر المنتظمة ويمكن أن تصف الدراسات التي تقارن بين مجموعات العلاج المتعددة مع بعضها البعض (في حالة عدم وجود مجموعة المراقبة).[4] كذلك، على الرغم من أن "RCT" اسم يتم توسيعه أحيانا بأنه «تجربة العشوائية الطبية» أو «تجربة المقارنة العشوائية»، الممارسة السليمة منهجيا، لتجنب الغموض في الكتابات العلمية، الاحتفاظ ب«المضبوطة» في تعريف "RCT" وبالتالي الاحتفاظ بهذا الاسم فقط للتجارب التي تحتوي على مجموعات مقارنة. ليس كل التجارب السريرية العشوائية هي تجارب عشوائية منتظمة (ومنهم من لا يمكن أبدا أن يكون، في الحالات التي تكون فيها الضوابط غير عملية أو غير أخلاقية لشرعها). مصطلح تجارب العشوائية السريرية المنتظم هو توسع بديل سليم بشكل منهجي ل"RCT" في الRCTs التي تهتم بالبحوث السريرية؛ [5][6][7] ومع ذلك، تعمل الRCTs أيضا في المجالات البحثية الأخرى، بما في ذلك العديد من العلوم الاجتماعية.
التاريخ
أجريت أول تجربة سريرية على يد جيمس ليند عام 1747 لتحديد العلاج لداء الاسقربوط.[8] ظهرت التجارب العشوائية في علم النفس، حيث تم عرضه من قبل تشارلز ساندرز بيرس، [9] والتعليم.[10][11][12] وفي وقت لاحق، ظهرت التجارب العشوائية في الزراعة، من خلال جيرزي نايمان [13] ورونالد فيشر. بحث فيشر تجريبي وكتاباته الشعبية للتجارب العشوائية.[14] RCT ظهر لأول مرة في الطب في ورقة 1948 بعنوان «علاج الإستربتومايسين للسل الرئوي»، التي وصفها تحقيق مجلس البحوث الطبية.[15][16][17] وكان واحد من واضعي تلك الورقة أوستن برادفورد هيل، الذي تصورها بأنها تصور التجربة العشوائية المنتظمة الحديثة.[18]
بحلول أواخر القرن العشرين، تم الاعتراف بالتجربة العشوائية المنتظمة كطريقة قياسية ل«العلاجات العقلانية» في الطب.[19] وفي عام 2004، كان أكثر من 150,000 تجربة عشوائية منتظمة في مكتبة كوكرين.[18] لتحسين تقديم التقارير عن التجارب العشوائية المنتظمة في أدب الطب، نشر مجموعة دولية من العلماء والمحررين المعايير الموحدة لإعداد تقارير تجارب البيانات (CONSORT) في 1996 و 2001 و 2010، وأصبحت هذه مقبولة على نطاق واسع.[3][20] التوزيع العشوائي هو عملية تعيين موضوعات تجريبية للعلاج أو مجموعات المقارنة باستخدام عنصر من الفرص لتحديد المهام من أجل الحد من انحراف النتائج.
أخلاقيات
على الرغم من أن مبدأ التوازن السريري («اليقين الصادق داخل مجتمع طبي خبير... حول العلاج المفضل») شائع في التجارب السريرية [21] تم تطبيقه على التجارب العشوائية المتنظمة، أخلاقيات التجارب العشوائية المتنظمة لديها اعتبارات خاصة. لمرة واحدة، فقد قيل أن التوازن نفس غير كافي لتبرير التجارب العشوائية المتنظمة.[22] ومن ناحية أخرى، «التوازن الجماعي» يمكن أن يتعارض مع عدم وجود توازن الشخصية (على سبيل المثال، اعتقاد شخصي بأن التدخل الفعال).[23] أخيرا، تصميم زيلين، التي استخدم لبعض تجارب السريرية العشوائية، والعناصر العشوائية قبل أن تقدم الموافقة المسبقة، والتي قد تكون أخلاقية لتجارب سريرية عشوائية للفحص والعلاج المحدد، ولكن من المرجح هو غير أخلاقي «بالنسبة لمعظم التجارب العلاجية.» [24][25] على الرغم من أن العناصر تزود دائما تقريبا الموافقة المسبقة عن مشاركتها في التجارب العشوائية المتنظمة، وقد وثقت دراسات منذ عام 1982 أن عناصر التجارب العشوائية المتنظمة يجب أن يعتقدوا أنهم معين عليهم تلقي العلاج وهذا هو الأفضل بالنسبة لهم شخصيا. وهذا هو، أنهم لا يفهمون الفرق بين البحث والعلاج.[26][27] المزيد من البحث ضروري لتحديد مدى انتشار وسائل لمواجهة «الاعتقاد الطبي الخاطئ».[27] طريقة التجارب العشوائية السرسرية قد تخلق أيضا الآثار الثقافية التي لم يتم فهمها جيدا.[28] على سبيل المثال، المرضى الذين يعانون من مرض ميؤوس منه يحاولوا الانضمام إلى التجارب على أنها محاولة أخيرة في العلاج، حتى عندما يكون الدواء غير مرجح لأن يكون ناجحا.
تسجيل التجربة
في عام 2004، أعلنت اللجنة الدولية لمحرري المجلات الطبية ICMJE) International Committee of Medical Journal Editors) أن جميع التجارب بعد 1 يوليو 2005 يجب تسجيلها مسبقا للنظر في النشر في واحدة من أعضاء المجلات الاثنا عشر في اللجنة.[29] ومع ذلك، تسجيل التجارب قد لا تزال تحدث في وقت متأخر أو لا تعمل على الإطلاق.[30][31] كانت المجلات الطبية تفتقر في التكيف مع السياسات التي تتطلب إلزامية تسجيل التجارب السريرية كشرط مسبق للنشر.[32]
تصنيفات التجارب العشوائية المنتظمة
حسب تصميم الدراسة
من طرق تصنيف التجارب العشوائية المنتظمة حسب تصميم الدراسة. من الأكثر إلى الأقل شيوعا في أدب الرعاية الصحية، الفئات الرئيسية لتصاميم دراسة تجارب سريرية عشوائية هي:[33]
- الموازية للمجموعة - يتم تعيين كل مشارك عشوائيا إلى مجموعة، وجميع المشاركين في المجموعة تلقي (أو عدم تلقي) الإجراء.
- التحول - مع مرور الوقت، يتلقى كل مشارك (أو لا يتلقى) إجراء في تسلسل عشوائي [34][35]
- العنقود - مجموعات موجودة من قبل المشاركين (على سبيل المثال القرى والمدارس) ويتم اختيارها عشوائيا لتلقي (أو عدم تلقي) الإجراء.
- التحليل إلى العوامل - يتم تعيين كل مشارك عشوائيا إلى مجموعة وتستقبل تركيبة معينة من الإجراءات أو عدم التدخل (على سبيل المثال، مجموعة 1 تتلقى فيتامين X وفيتامين Y، مجموعة 2 تتلقى فيتامين X وفيتامين Y الوهمي، مجموعة 3 تتلقى فيتامينX الوهمي وفيتامين Y، ومجموعة 4 تتلقى فيتامين X الوهمي وفيتامين Y الوهمي)
تم فهرسة تحليل يتكون من 616 تجربة سريرية عشوائية في PubMed «الببميد موقع يوفر معلومات صحية للمستهلكين والأطباء مع استعراض للبحوث السريرية» خلال شهر ديسمبر 2006 ووجد أن 78٪ كانت تجارب الموازية للمجموعة، و 16٪ كانوا تحول، 2٪ تم تقسيم الجسم، و 2٪ كتلة، و 2٪ منهم تحليل إلى العوامل.[33]
الفائدة حسب النتيجة (الكفاءة مقابل الفعالية)
ويمكن تصنيف ال RCTs ب«توضيحية» أو «عملية».[36] اختبار كفاءة ال RCTs التفسيرية في إعداد البحوث مع المشاركين المختارين بدقة وتحت ظروف محكومة إلى حد كبير.[36] وفي المقابل، عملية اختبار فعالية RCTs العملية في الممارسة اليومية نسبيا مع مشاركين غير محددين وتحت ظروف مرنة؛ في هذه الطريقة، الRCTs العملية تستطيع «إبلاغ قرارات حول الممارسة».[36]
بواسطة فرضية (التفوق مقابل عدم النقص مقابل التكافؤ)
تصنيف آخر من ال RCTs يصنفها بأنها «تجارب التفوق»، «تجارب غير ناقصة»، و «تجارب التكافؤ»، والتي تختلف في المنهجية وإعداد التقارير.[37] معظم ال RCTs هي تجارب التفوق، والذي هو إجراء واحد افترض لتكون متفوقة على آخر بطريقة ذات دلالة إحصائية.[37] بعض ال RCTs هي تجارب غير ناقصة «لتحديد ما إذا كان العلاج الجديد ليس أسوأ من العلاج المرجعي.»[37] ال RCTs الأخرى هي تجارب التكافؤ الذي هو فرضية أن تدخلين لا يمكن تمييزها من بعضها البعض.[37]
التوزيع العشوائي
مزايا التوزيع العشوائي الصحيح في ال RCTs ما يلي:[38]
- «أنه يزيل التحيز في تقييم العلاج،» على وجه التحديد التحيز في الاختيار والخلط.
- «إنه يسهل إعماء (اخفاء) من هوية العلاجات من المحققين، والمشاركين، والمقيمين».
- «ويسمح استخدام نظرية الاحتمالات للتعبير عن احتمال أي اختلاف في النتيجة بين مجموعات العلاج فقط يبين فرصة.»
هناك نوعان من العمليات التي تنطوي عليها عملية العشوائية للمرضى للتدخلات مختلفة. الأول هو اختيار إجراء التوزيع العشوائي لإنشاء تسلسل يمكن التنبؤ به من الحصص؛ قد يكون هذا التوزيع العشوائي البسيط من المرضى إلى أن أي من الفئات المعرضة عند احتمالات متساوية، قد يكون «مقيد»، أو قد يكون «مكيف». المسألة الثانية وأكثر عملية هي إخفاء الفرز، الذي يشير إلى الاحتياطات الصارمة المتخذة لضمان تعيين مجموعة من المرضى الذين لم تكشف من قبل توزيع مجموعاتهم نهائيا. الطرق غير العشوائية «منظمة» لتعيين المجموعة، مثل تناوب العناصر بين مجموعة واحدة والأخرى، يمكن أن يسبب «احتمالات إفساد لا حدود له»، ويمكن أن تسبب خرقا لإخفاء التخصيص.[39] ومع ذلك، الأدلة التجريبية التي تلائم العشوائية تغير النواتج بالنسبة إلى التوزيع العشوائي غير الملائم كان من الصعب للكشف عنها تجريبيا.[40]
إجراءات التوزيع العشوائي
تخصيص العلاج هو نسبة المرغوب فيه من المرضى في كل ذراع العلاج. أن إجراء التوزيع العشوائي المثالي يحقق الأهداف التالية:[41]
- تحقيق أقصى قدر من القوة الإحصائية، وخاصة في تحليل مجموعة فرعية. عموما، أحجام المجموعة المتساوية تعظم القدرة الإحصائية، ومع ذلك، والجماعات غير متساوية الأحجام ربما أكثر قوة لبعض التحليل (على سبيل المثال، مقارنات متعددة من العلاج الوهمي مقابل عدة جرعات باستخدام إجراء Dunnett «هو إجراء مقارنة متعددة التي وضعها إحصائي الكندي تشارلز لمقارنة كل من عدد جلسات العلاج مع عنصر تحكم واحد».[42])، ومرغوب في بعض الأحيان لأسباب غير تحليلية (على سبيل المثال، المرضى ربما يكونوا أكثر حماسا للتسجيل إذا كان هناك فرصة أكبر للحصول على علاج اختبار، أو قد تطلب الهيئات التنظيمية الحد الأدنى لعدد المرضى الذين تعرضوا للعلاج).[43]
- تقليل التحيز في الاختيار. قد يحدث هذا إذا المحققين يستطيعون بوعي أو بغير وعي إلحاق المرضى بشكل تفضيلي بين أذرعه العلاج. إجراء التوزيع العشوائي الجيد يمكن التنبؤ به حتى أن المحققين لا يمكنهم تخمين تقييم مجموعة العناصر المقبلة على أساس تقييمات العلاج السابقة. خطر التحيز في الاختيار هو أعلى عندما تعرف تقييمات العلاج السابقة (كما هو الحال في الدراسات غير المعماة) أو يمكن تخمينها (ربما إذا كان الدواء له آثار جانبية مميزة).
- تقليل تحيز الحصص (أو الخلط). قد يحدث هذا عندما لا يتم توزيع المتغيرات التي تؤثر على النتائج بالتساوي بين مجموعات العلاج، وخلطت تأثير العلاج مع تأثير المتغيرات (أي أن يكون «تحيز غير المقصود» [38][44]). إذا كان الإجراء العشوائي يسبب خللا في المتغيرات المتصلة بنتائج عبر مجموعات، تقديرات التأثير قد تكون متحيزة إذا لم تعدل المتغيرات (والتي قد تكون غير مقاسه وبالتالي من المستحيل التعديل عليها).
ومع ذلك، لا يوجد إجراء توزيع عشوائي واحد يلبي هذه الأهداف في كل ظرف من الظروف، لذلك يجب اختيار الباحثين إجراء لدراسة معينة بناء على مزاياه وعيوبه.
التوزيع العشوائي البسيط
هذا الإجراء شائع وبديهي، على غرار «قذف العملة المتكرر العادل.» [38] المعروف أيضا باسم «متممة» أو «غير مقيدة» العشوائية، فهي قوية ضد كل من التحيز الاختياري أو غير المقصود. ومع ذلك، العيب الرئيسي هو إمكانية توازن أحجام مجموعة في التجارب السريرية العشوائية الصغيرة. ولذلك فمن المستحسن فقط لتجارب سريرية عشوائية مع أكثر من 200 عنصر.[45]
التوزيع العشوائي المقيد
لتحقيق توازن أحجام المجموعة في أصغر التجارب العشوائية المنتظمة، فمن المستحسن شكلا من أشكال العشوائية ال«المقيدة» يوصى به.[45] أنواع التجارب العشوائية المنتظمة الرئيسة هي
- مبدل الكتلة العشوائية أو الكتلة العشوائية: يتم تحديد «حجم الكتلة» و «نسبة الحصص» (عدد من العناصر في مجموعة واحدة مقابل مجموعة أخرى)، ويتم تخصيص موضوعات عشوائيا داخل كل كتلة [39] على سبيل المثال، حجم كتلة من 6 وتخصيص نسبة 2: 1 من شأنه أن يؤدي إلى التوزيع العشوائي من 4 موضوعات لمجموعة واحدة و 2 إلى أخرى. هذا النوع من التوزيع العشوائي يمكن دمجه مع «العشوائية الطبقية»، على سبيل المثال عن طريق مركز في تجربة متعددة المراكز، إلى «ضمان توازن جيد من خصائص المشاركين في كل مجموعة.» [3] وهناك حالة خاصة من مبدل الكتلة العشوائية هي التوزيع العشوائي، حيث يتم التعامل مع العينة كلها ككتلة واحدة.[39] أما العيب الرئيسي لمبدل كتلة العشوائي هو أنه حتى لو كانت أحجام كتلة كبيرة ومتنوعة بشكل عشوائي، ويمكن أن يؤدي هذا الإجراء إلى التحيز في الاختيار.[41] وثمة عيب آخر هو أن تحليل «سليم» من البيانات من مبدل-القطع العشوائي في التجارب السريرية العشوائية يتطلب الطبقية بواسطة الكتل.[45]
- أساليب انحياز العملة العشوائي المتكيف (منها جرة العشوائية وهو النوع الأكثر المعروف على نطاق واسع): في هذه الأساليب غير الشائعة نسبيا، واحتمال التعرض للإلزام لمجموعة ينخفض إذا كانت المجموعة ممثلة تمثيلا زائدا ويزيد إذا كانت المجموعة ممثلة تمثيلا ناقصا.[39] الأساليب تعتقد أنها قد تكون أقل تأثر لتحيز الاختيار من مبدل كتلة العشوائية.[45]
التكيف
وقد استخدمت نوعين على الأقل من الإجراءات العشوائية «التكيف» في تجارب سريرية عشوائية، ولكن أقل من ذلك بكثير في كثير من الأحيان من التوزيع العشوائي البسيط أو المقيدة:
- التوزيع العشوائي المتغاير التكيف، منها نوع واحد هو التقليل: احتمال التعرض للإلزام لمجموعة يختلف من أجل تقليل «تباين مقدار التغاير .»[45] وتفيد التقارير أن يكون للتدنية «المؤيدين والمنتقدين» [39] لأن فقط مجموعة العنصر الأول يتم اختياره حقا عشوائيا، وليس من الضرورة أن ينهي الأسلوب التحيز من العوامل غير المعروفة.[3]
- التوزيع العشوائي للاستجابة التكيفية، المعروف أيضا باسم نتيجة التكيف العشوائي: احتمال وجود تحديد المجموعة يزيد إذا كانت الردود من المرضى السابقين في المجموعة ملائمة [45] على الرغم من الحجج بذلت بأن هذا النهج هو أكثر أخلاقية من أنواع أخرى من التوزيع العشوائي عند احتمال أن العلاج هو فعال أو غير فعال يزيد خلال الRCT، الأخلاقيين لم يدرسوا حتى الآن هذا النهج بشكل مفصل.[46]
إخفاء التخصيص
«إخفاء التخصيص» (التي تعرف بأنها «إجراء لحماية عملية التوزيع العشوائي بحيث أن علاج ليتم تخصيصه ليس معروف قبل أن يتم إدخال المريض إلى دراسة») هي مهمة في الRCTs.[47] وفي الممارسة العملية، في رعاية مريض على حدة، والمحققين السريرية في تجارب سريرية عشوائية وغالبا ما يجد صعوبة في الحفاظ على الحياد. تكثر قصص المحققين رافعين المظاريف المختومة إلى الأضواء أو نهب مكاتب لتحديد مهام المجموعة من أجل فرض مهام المريض القادم.[39] مثل هذه الممارسات إدخال التحيز في الاختيار والإرباك (وكلاهما يجب تقليلهما من خلال التوزيع العشوائي)، وبالتالي ربما تشويه نتائج الدراسة.[39] من المفترض أن يهزم إخفاء التخصيص المرضى والمحققين من اكتشاف تخصيص العلاج متى ما كانت الدراسة جارية وبعد أن اختتمت الدراسة. العلاج المتعلق بآثار جانبية أو أعراض سلبية معينة قد تكون كافية للكشف عن تخصيص للمحققين أو المرضى وبالتالي عرضة للتحيز أو التأثير على أية معالم ذاتية تم جمعها من قبل المحققين أو طلب من العناصر. وتشمل بعض الطرق المعيارية لضمان إخفاء التخصيص ترقيم بالتسلسل، غير الشفافة، مظاريف مختومة (NOSE). حاويات بالتسلسل مرقمة. صيدلية التوزيع العشوائي للرقابة؛ . والعشوائية المركزي [39] فمن المستحسن أن أساليب إخفاء التخصيص يتم تضمينها في بروتوكول الRCT، وأن أساليب إخفاء التخصيص ينبغي الإبلاغ عنها بالتفصيل في نشرة لنتائج التجارب العشوائية. ومع ذلك، قررت دراسة عام 2005 أن معظم ال RCTs لديها إخفاء التخصيص واضح في بروتوكولاتها، في منشوراتها، أو كليهما.[48] من ناحية أخرى، اختتمت دراسة أجريت عام 2008 من 146من التحاليل التلوية أن نتائج التجارب السريرية العشوائية مع عدم كفاية أو غير واضحة اخفاء التخصيص تميل الإخفاء تميل تجاه التحيز نحو آثار مفيدة فقط إذا كانت النتائج على الRCTs ذاتية مقارنة بالموضوعية.[49]
حجم العينة
المقال الرئيسي: تحديد حجم العينة عدد وحدات العلاج (عناصر أو مجموعة من العناصر) المخصصة للمراقبة ومجموعات العلاج تؤثر على موثوقية ال RCTs. إذا كان تأثير العلاج صغير، وعدد من وحدات المعالجة في أي من المجموعتين قد لا تكون كافية لرفض فرضية العدم في الاختبار الإحصائي منها. ان الفشل لرفض فرضية العدم يعني أن العلاج لم يظهر أي تأثير ذو دلالة إحصائية على المعالجة في اختبار معين. ولكن مع زيادة حجم العينة، قد يكون من نفس RCT قادرة على إثبات وجود تأثير كبير للعلاج، حتى لو كان هذا التأثير صغير.[50]
التعمية
قد يكون ال RCT أعمى ، (وتسمى أيضا «الملثمين») من خلال «الإجراءات التي تمنع المشاركين في الدراسة، ومقدمي الرعاية، أو مستشاري النتيجة من معرفة الرعاية التي تم تقديمها.» [49] خلافا لإخفاء التخصيص، التعمية في بعض الأحيان غير مناسبة أو من المستحيل القيام بها في الRCT. على سبيل المثال، إذا كان ينطوي على الRCT علاج فيها المشاركة النشطة من جانب المريض ضروري (على سبيل المثال، العلاج الطبيعي)، لا يمكن تعمية المشاركين في الرعاية. تقليديا، تم تصنيف ال RCTs أعمى باسم «التعمية المفردة»، «التعمية المزدوجة»، أو «التعمية الثلاثية». ومع ذلك، في عام 2001 و 2006 أظهرت دراستان أن هذه المصطلحات لها معان مختلفة لأناس مختلفين.[51][52] يحدد بيان الCONSORT عام 2001 أن المؤلفين والمحررين يجب عليهم عدم استخدام مصطلحات «التعمية المفردة»، «التعمية المزدوجة»، و«التعمية الثلاثية». بدلا من ذلك، ينبغي أن تقارير التعمية في الRCT أي تم مناقشتها «إذا فعلت، الذي أصيب بالعمى بعد الإحالة للتدخلات (على سبيل المثال، والمشاركين، ومقدمي الرعاية، وتقييم تلك النتائج) وكيف.» [3] ال RCTs دون التعمية ويشار إليها باسم "غير معمية"، [53] "فتح"، [54] أو (إذا كان التدخل هو الدواء) "التسمية مفتوحة".[55] وفي عام 2008 أبرمت الدراسة إلى أن نتائج ال RCTs غير المعماة تميل إلى أن تكون منحازة تجاه آثار مفيدة فقط إذا كانت نتائج ال RCTs "ذاتية بدلا من موضوعية؛ [49] على سبيل المثال، في RCT من العلاجات لمرض التصلب المتعدد، أطباء الأعصاب غير المعماة (ولكن ليس أطباء الأعصاب العمي) رأت أن العلاجات كانت مفيدة .[56] وفي ال RCTs واقعية، على الرغم من أن المشاركين والمقدمين غالبا ما يكونوا غير معميين، انه "لا يزال مرغوبا وممكنا في كثير من الأحيان إلى تعمية المقيم أو الحصول على مصدر موضوعي للبيانات لتقييم النتائج." [36]
تحليل البيانات من التجارب العشوائية المنتظمة
أنواع الأساليب الإحصائية المستخدمة في تجارب السريرية العشوائية تعتمد على خصائص البيانات، وتشمل:
- ثنائي (الثنائية) معطيات النتائج، الانحدار اللوجستي (على سبيل المثال، التنبؤ بالاستجابة الفيروسية المستدامة بعد تلقي بيغ انترفيرون ألفا 2A لالتهاب الكبد[57] C)وغيرها من الطرق يمكن استخدامها.
- بيانات النتائج المستمرة، وتحليل التباين (على سبيل المثال، لإجراء تغييرات في مستويات الدهون في الدم بعد تلقي أتورفاستاتين بعد متلازمة الشريان التاجي الحادة [58]) باختبار آثار المتغيرات التنبؤية.
- نتائج بيانات الوقت إلى الحدث الذي قد يكون للرقابة وتحليل البقاء على قيد الحياة (على سبيل المثال، تقديرات كابلان-ماير ونماذج مخاطر النسبية لكوكس من الوقت لمرض القلب التاجي بعد تلقي العلاج بالهرمونات في سن اليأس [59]) هو المناسب.
بغض النظر عن الأساليب الإحصائية المستخدمة، الاعتبارات الهامة في تحليل البيانات RCT ما يلي:
- ما إذا كان ينبغي ايقاف RCT في وقت مبكر بسبب النتائج المؤقتة. على سبيل المثال، قد يتم إيقاف تجارب السريرية العشوائية في وقت مبكر إذا كان التدخل ينتج «أكبر من الفائدة المتوقعة أو ضرر،» أو إذا «المحققين وجدوا دليلا على أي فرق مهم بين التدخلات التجريبية والضابطة.» [3]
- إلى أي مدى المجموعات يمكن تحليلها بالضبط كما كانت عليه بالعشوائي (أي ما إذا كان ما يسمى «تحليل نية إلى علاج» يستخدم). «نقية» تحليل نية إلى علاج هو «ممكن فقط عندما تكون بيانات النتيجة الكاملة متاحة» لجميع المواد الدراسية العشوائية؛ [60] عند فقد بعض البيانات الختامية، خيارات تشمل تحليل الحالات فقط مع النتائج المعروفة واستخدام البيانات المنسوبة .[3] ومع ذلك، فإن أكثر من تحليل يمكن أن يشمل جميع المشاركين في المجموعات التي تم اختيارهم بصورة عشوائية هم، وستخضع الRCT لتحيز أقل.[3]
- ما إذا كان يجب إجراء تحليل لمجموعة فرعية. هذه هي «في كثير من الأحيان بالإحباط» بسبب مقارنات متعددة قد تنتج النتائج الإيجابية الكاذبة التي لا يمكن التأكد منها بدراسات أخرى.[3]
الإبلاغ عن نتائج الRCT
بيان CONSORT 2010 وهو «، المستندة إلى الأدلة، الحد الأدنى من التوصيات من أجل تسجيل تجارب السريرية العشوائية.» [61] عام 2010 CONSORT قائمة مرجعية تحتوي على 25 وحدات (مع العديد من البنود الفرعية) تركز على «العشوائية بشكل فردي، واثنين من المجموعة، المحاكمات الموازية» التي هي النوع الأكثر شيوعا من التجربة العشوائية السريرية [20] لتصاميم دراسات RCT أخرى ، «ملحقات CONSORT» وقد نشرت.[20]
الأهمية النسبية للتجارب العشوائية المنتظمة والدراسات الرصدية
وجدت دراستين نشرتا في دورية نيو انجلاند جورنال اوف ميديسين عام 2000 أن الدراسات الرصدية وتجارب السريرية العشوائية تنتج عموما نتائج مماثلة. .[62][63] مؤلفو نتائج عام 2000 أثاروا الشكوك على الأفكار «الدراسات الرصدية لا ينبغي أن تستخدم لتحديد الرعاية الطبية المستندة إلى الأدلة»، وأن نتائج تجارب السريرية العشوائية هي«دليل على أعلى درجة.»[62][63] ومع ذلك، خلصت دراسة أجريت عام 2001 نشرت في مجلة الجمعية الطبية الأمريكية أن «التناقضات وراء فرصة لا تحدث والاختلاف في حجم المقدرة تأثير العلاج شائعة جدا» بين الدراسات القائمة على المراقبة وتجارب السريرية العشوائية.[64] سطرين اخرين في مساهمة المنطق في مسألة تجارب السريرية العشوائية من المعارف العلمية وراء أنواع أخرى من الدراسات:
- إذا تصاميم الدراسة تم ترتيبها حسب قدرتها على الاكتشافات الجديدة ، ثم أدلة غير مؤكدة قد تكون على قمة القائمة، تليها الدراسات الرصدية، تليها تجارب السريرية العشوائية.[65]
- تجارب السريرية العشوائية قد يكون من الضروري للعلاجات التي قد يكون لها آثار كبيرة وسريعة نسبيا لتوقع مسار طبيعي مستقر أو أسوأ تدريجيا للحالة المعالجة.[66][67] ومن الأمثلة على الجمع بين العلاج الكيميائي بما في ذلك سيسبلاتين لسرطان الخصية النقيلي، مما أدى إلى زيادة نسبة الشفاء من 5٪ إلى 60٪ في دراسة 1977 غير عشوائية.[67][68]
تفسير النتائج الإحصائية
مثل كل الأساليب الإحصائية، تجارب السريرية العشوائية تخضع لكلا من النوع الأول («إيجابية كاذبة») والنوع الثاني («سلبية زائفة») الأخطاء الإحصائية. وفيما يتعلق بالنوع الأول من الأخطاء، التجربة السريرية العشوائية النموذجية تستخدم 0.05 (أي 1 في 20)، واحتمال أن RCT سوف تكون زائفة لإيجاد علاجين فعالين على قدر المساواة مختلفين بأهمية.[69] وفيما يتعلق النوع الثاني من أخطاء، على الرغم من نشر ورقة في 1978 مشيرا إلى أن أحجام العينة للعديد من تجارب السريرية العشوائية «السلبية» صغير جدا لجعل استنتاجات نهائية حول نتائج سلبية، [70] بحلول 2005-2006 نسبة كبيرة من تجارب السريرية العشوائية لا يزال لديه حسابات غير دقيقة أو غير كاملة أفادت حجم العينة.[71]
مزايا
تعتبر تجارب السريرية العشوائية من قبل الأعظم ليكون على شكل الأكثر موثوقية للأدلة العلمية في التسلسل الهرمي للأدلة التي تؤثر على السياسات والممارسات الصحية لان التجارب السريرية العشوائية تقلل السببية الزائفة والتحيز. نتائج تجارب السريرية العشوائية قد تكون مجتمعة في المراجعات المنهجية التي يتزايد استخدامها في تسيير الممارسة المستندة إلى الأدلة. بعض الأمثلة العلمية منظمات النظر في تجارب السريرية العشوائية والمراجعات المنهجية في تجارب السريرية العشوائية لتكون الأدلة ذات جودة أعلى المتاحة هي:
- اعتبارا من عام 1998، المجلس الوطني للبحوث الصحية والطبية في أستراليا عين «المستوى الأول» أدلة على أن «تم الحصول عليها من مراجعة منهجية لجميع التجارب العشوائية السريرية ذات الصلة» و «المستوى الثاني» أدلة على أن «تم الحصول عليها على الأقل من واحد من تجارب العشوائية السريرية مصممة بشكل صحيح.»[72]
- منذ عام 2001 على الأقل، في تقديم توصيات توجيهية للممارسة السريرية وقد نظرت فرقة العمل الوقائي في الولايات المتحدة على حد سواء تصميم دراسة وصحتها الداخلية كمؤشرات لجودتها.[73] وقد أدركت الحكومة «دليل تم الحصول عليه على الأقل بشكل صحيح من واحد من التجارب العشوائية السريرية» مع صحتها الداخلية الجيدة (أي تصنيف من«I-جيدة») وكذلك أعلى مستوى من جودة الأدلة المتوفرة لديها.[73]
- اختتم الفريق العامل GRADE في عام 2008 إلى أن «التجارب العشوائية دون قيود هامة تشكل دليلا ذات جودة عالية.» [74]
- القضايا التي تنطوي على «العلاج / الوقاية والمسببات / الضرر»، ومركز أكسفورد للطب المبني على البراهين اعتبارا من عام 2011 تعريف «مستوى 1A» أدلة مراجعة منهجية في تجارب السريرية العشوائية التي تنسجم مع بعضها البعض، «مستوى 1B» دليلا على أنه «RCT الفردي (بثقة الضيق الفاصل).» [75]
تجارب السريرية العشوائية الملحوظة مع نتائج غير متوقعة التي ساهمت في التغيرات في الممارسة السريرية وتشمل: بعد موافقة إدارة الغذاء والدواء، وكلاء ارتفاع معدل ضربات القلب flecainide «فليكانيد من ادوية مضادات اضظرابات النظم. تستخدم لمنع وعلاج اضطرابات نظم القلب» و encainide «هو مضاد اضطراب النظم الدرجة الأول (ج)» جاؤوا إلى السوق في عام 1986 و 1987 على التوالي.[76] وتميزت هذه الدراسات غير العشوائية بشأن الادوية بأنها «متوهجة»، زادت [77] زادت مبيعاتهم مجتمعة مجموعه حوالي 165,000 وصفة طبية شهريا في أوائل عام 1989.[76] وفي هذا العام، ومع ذلك، خلص تقرير أولي لRCT أن هذين الدواءين زادا نسبة الوفيات.[78] ثم انخفض مبيعات الأدوية.[76] قبل عام 2002، استنادا إلى الدراسات الرصدية، كان روتين للأطباء أن يصف العلاج بالهرمونات البديلة للنساء بعد انقطاع الطمث لمنع احتشاء عضلة القلب.[77] وفي عام 2002 و 2004، ومع ذلك، نشرت تجارب السريرية العشوائية من مبادرة صحة المرأة ادعى أن النساء اللواتي يتناولن كان العلاج بالهرمونات البديلة مع هرمون الاستروجين بالإضافة إلى البروجستين ارتفاع معدل احتشاء عضلة القلب أكثر من النساء على الدواء الوهمي، ولم يتسبب ذلك الاستروجين الوحيد العلاج بالهرمونات البديلة أي انخفاض في معدل الإصابة بأمراض القلب التاجية.[59][79] التفسيرات المحتملة لهذا التناقض بين الدراسات الرصدية وتجارب السريرية العشوائية المعنية اختلافات في المنهجية، في نظم هرمون المستخدمة، ودرس السكان.[80][81] انخفض استخدام العلاج بالهرمونات البديلة بعد نشر تجارب السريرية العشوائية.[82]
عيوب
العديد من الصحف تناقش عيوب تجارب السريرية العشوائية [66][83] من بين الأكثر ذكرا السلبيات هي:
القيود المفروضة على الصلاحية الخارجية
- إلى أي مدى نتائج تجارب السريرية العشوائية "قابلة للتطبيق خارج تجارب السريرية العشوائية يختلف. وهذا هو، تجارب السريرية العشوائية ". قد تكون الصلاحية الخارجية محدودة [66][84] العوامل التي يمكن أن تؤثر على تجارب السريرية العشوائية" الصلاحية الخارجية ما يلي:[84]
- حيث تم إجراء الRCT (على سبيل المثال، ما يصلح في بلد معين قد لا يصلح في بلد آخر).
- خصائص المرضى (على سبيل المثال، يمكن أن يشمل RCT المرضى الذين تشخيصهم أفضل من المتوسط، أو قد يستبعد «النساء والأطفال وكبار السن، وذوي الحالات الطبية المشتركة»[85]).
- إجراءات الدراسة (على سبيل المثال، قد يتلقى مرضى RCT إجراءات تشخيصية مكثفة ومتابعة الرعاية ومن الصعب تحقيقه في «العالم الحقيقي»).
- مقاييس النتائج (على سبيل المثال، ال RCTs قد تستخدم قياسات مركبة تستخدم بشكل غير متكرر في الممارسة السريرية).
- تسجيل تقارير غير كاملة للتأثيرات السلبية للتدخلات.
ومع ذلك، تعاني جميع البحوث من القيود المفروضة على صحة الخارجية، سواء ملاحظية أو تجريبية، كمية، أو نوعية، لأنه يقتصر بالضرورة على السياق الذي يأخذ موقع فيه.
الوقت والتكاليف
يمكن ال RCTs لأن تكون مكلفة، وجدت دراسة [83] واحدة 28 مرحلة ثالثة من ال RCTs بتمويل من المعهد الوطني للاضطرابات العصبية والسكتة الدماغية قبل عام 2000 بتكلفة إجمالية قدرها 335 مليون دولار، [86] لمتوسط تكلفة 12 مليون دولار لكل RCT . ومع ذلك، فإن العائد على الاستثمار من ال RCTs قد تكون مرتفعة، في أن نفس مشروع الدراسة أن ال 28 ال RCTs أنتجت «فائدة صافية للمجتمع في 10 عاما» 46 ضعف تكلفة برنامج المحاكمات، بناء على تقييم جودة الحياة المعدلة سنويا على قدم المساواة إلى المتوسط السائد بنصيب الفرد من الناتج المحلي الإجمالي.[86]
صرف الRCT يستغرق عدة سنوات حتى يتم نشرها، يتم تقييد هذه البيانات من المجتمع الطبي لسنوات طويلة، وربما تكون أقل أهمية في وقت النشر.[87] أنها مكلفة للحفاظ على ال RCTs لسنوات أو عقود التي من شأنها أن تكون مثالية لتقييم بعض التدخلات.[66][83] تدخلات لمنع الأحداث التي تحدث إلا نادرا (على سبيل المثال، متلازمة موت الرضع المفاجئ) والنتائج السلبية غير الشائعة (على سبيل المثال، أحد الآثار الجانبية النادرة من الدواء) يتطلب ال RCTs مع أحجام عينة كبيرة للغاية، وبالتالي أفضل أن يتم تقديرها من الدراسات الملاحظية.[66] نظرا لتكاليف تشغيل ال RCTs، يتم بالعادة فحص متغير واحد فقط أو عدد قليل جدا من المتغيرات، ونادرا ما تعكس صورة كاملة عن الوضع الطبي المعقد؛ في حين أن تقرير الحالة، على سبيل المثال، يستطيع تفصيل جوانب عديدة من الوضع الطبي للمريض (على سبيل المثال تاريخ المريض والفحص البدني، والتشخيص، والجوانب النفسية والاجتماعية ومتابعتها).[87]
نزاع اهتمام المخاطر
أجريت دراسة عام 2001 للكشف عن الصراعات المحتملة للمصالح في الدراسات البحثية الأساسية المستخدمة في طب التحليل التجميعي استعرض 29 من التحاليل التجميعية ووجدت أن نادرا ما تم الكشف عن تضارب المصالح في الدراسات التي يقوم عليها التحليل التجميعي. شملت التحليلات الوصفية التسع والعشرين إحدى عشرة من مجلات الطب العام. 15 من مجلات الطب التخصصي، و 3 من قاعدة بيانات كوكرين للمراجعات المنهجية. استعرضت ال29 من التحاليل التجميعية لمجموع 509دراسة من التجارب العشوائية المضبوطة. ومن بين هؤلاء، أفادت 318دراسة من ال RCTs مصادر التمويل مع 219 (69٪) صناعة التمويل. 132 دراسة من 509 من ال RCTs أفادت تأليف التضارب لافصاحات الاهتمام، مع 91 دراسة (69٪) الكشف عن صناعة العلاقات المالية مع واحد أو أكثر من المؤلفات. ومع ذلك، فقد نادرا ما تعكس المعلومات في هذا التحليل. اثنين فقط (7٪) عن مصادر تمويل ال RCT وأفادت لا شيء من ال RCT روابط تأليف الصناعة. وخلص الباحثون إلى «من دون اعتراف COI بسبب تمويل الصناعة أو تأليف صناعة العلاقات المالية من ال RCTs المدرجة في التحليلات التجميعية، فهم القراء وتقييم الأدلة من قد يؤثر سلبا التحليل التجميعي.» [88] يتم كليا أو جزئيا بتمويل بعض ال RCTs من قبل صناعة الرعاية الصحية (على سبيل المثال، صناعة الأدوية) في مقابل الحكومة، غير ربحية، أو من مصادر أخرى. وتبين من استعراض منهجي نشر في عام 2003 أربعة (1986-2002) مقالات من ال RCTs التي تقارن غير الكفالة الصناعية والكفالة الصناعية ، وفي جميع المقالات كان هناك علاقة الكفالة الصناعة ونتائج الدراسة إيجابية.[89] حددت دراسة أجريت عام 2004 (1999-2001) ال RCTs التي نشرت في المجلات الطبية والجراحية الرائدة التي تمولها الصناعة «من المرجح أن تكون مرتبطة مع النتائج ذات الدلالة الإحصائية الموالية للصناعة.» [90] أحد الأسباب المحتملة لنتائج الموالية للصناعة في الممولة للصناعة نشر RCTs تحيز نشر.[90] كتاب آخرون قد استشهد أهداف مختلفة من الأبحاث الأكاديمية والصناعة برعاية أنها تساهم في الفرق. قد يكون الرعاة التجاريين أكثر تركيزا على أداء التجارب للأدوية التي أظهرت بالفعل وعد في التجارب في مرحلة مبكرة، وعلى تكرار النتائج الإيجابية السابقة للوفاء بالمتطلبات التنظيمية لموافقة الدواء.[91]
أخلاقيات
إذا وضعت البدعة «التخريبية» في التكنولوجيا الطبية (أو غيرها)، فإنه قد يكون من الصعب اختبار هذه أخلاقيا في RCT إذا أصبح «واضحا» أن المجموعة الضابطة لها نتائج أفقر - إما بسبب اختبار آخر لما سبق، أو داخل المرحلة الأولى من RCT نفسها. أخلاقيا قد يكون من الضروري لإجهاض RCT قبل الأوان، والحصول على موافقة أخلاقية (والاتفاق مع المريض) لحجب البدعة من مجموعة المراقبة في المستقبل قد لا يكون ممكنا.
تجارب السيطرة العشوائية في العلوم الاجتماعية
نظرا لظهور ال RCTsمؤخرا في العلوم الاجتماعية، واستخدام ال RCTs في العلوم الاجتماعية هي قضية متنازع عليها. وقد جادل بعض الكتاب من خلفية طبية أو صحية أن الأبحاث الحالية في مجموعة من التخصصات في العلوم الاجتماعية تفتقر إلى الدقة، وينبغي تحسينها من خلال زيادة استخدام تجارب السيطرة العشوائية.
نقل العلم
ويقول الباحثون في علوم النقل أن الإنفاق العام على برامج مثل خطط السفر المدرسية لا يمكن تبريره إلا إذا أثبتت فعاليتها من خلال تجارب عشوائية منظمة.[92] استعرض غراهام-رو وزملاؤه [93] 77 تقييما لتدخلات النقل وجدت في الأدب ، تصنيفها إلى 5 «مستويات الجودة». واختتموا إلى أن معظم الدراسات كانت ذات جودة منخفضة ودعا إلى استخدام التجارب العشوائية المنتظمة حيثما كان ذلك ممكنا في بحوث النقل في المستقبل. أخذت ميليا [94] قضية مع هذه الاستنتاجات، بحجة أن تزعم حول مزايا ال RCTs، في إنشاء السببية وتجنب التحيز، ومبالغ فيها. واقترح المعايير ال8 التالية لاستخدام ال RCTs في السياقات التي يجب على التدخلات تغيير السلوك البشري أن تكون فعالة: التدخل:
- لم يتم تطبيقها على جميع أعضاء مجموعة فريدة من نوعها من الناس (على سبيل المثال سكان بلد بأكمله، جميع العاملين في مؤسسة فريدة من نوعها الخ)
- يتم تطبيقها في سياق أو وضع مماثل لذلك الذي ينطبق على المجموعة الضابطة
- يمكن عزله عن الأنشطة الأخرى - والغرض من هذه الدراسة هو تقييم هذا التأثير معزولا
- لديه جدول زمني قصير بين تنفيذها واستحقاق آثاره
والآليات السببية:
- ومن المعروف إما للباحثين، أو يمكن اختبار كل البدائل الممكنة الأخرى
- لا تنطوي على آليات تغذية راجعة ذات دلالة إحصائية بين مجموعة التدخل والبيئات الخارجية
- لها علاقة مستقرة ويمكن التنبؤ بها للعوامل خارجية
- سيتصرف بنفس الطريقة إذا تم عكس المجموعة السيطرة ومجموعة التدخل
التنمية الدولية
ويجري حاليا استخدام ال RCTs من قبل عدد من خبراء التنمية الدولية لقياس أثر التدخلات الإنمائية في جميع أنحاء العالم. وقد استخدم خبراء التنمية الاقتصادية في المنظمات البحثية بما في ذلك عبد اللطيف جميل مختبر مكافحة الفقر [95][96] وابتكارات من أجل مكافحة الفقر[97] استخدم ال RCTs لقياس فعالية الفقر، والصحة، وبرامج التعليم في العالم النامي. في حين ال RCTs يمكن أن تكون مفيدة في تقييم السياسات، فمن الضروري توخي الحذر في تفسير النتائج في إعدادات العلوم الاجتماعية. على سبيل المثال، يمكن للتدخلات حمل عن غير قصد التغيرات الاجتماعية والاقتصادية والسلوكية التي يستطيع الخلط بين العلاقات (بهارجافا، 2008). بالنسبة لبعض خبراء التنمية الاقتصادية، والميزة الرئيسية لاستخدام ال RCTs مقارنة الأساليب البحثية الأخرى هي أن حراس العشوائية ضد التحيز في الاختيار، وهي مشكلة موجودة في العديد من الدراسات الحالية لسياسة التنمية. في أحد الأمثلة البارزة لRCT العنقودية في مجال اقتصاديات التنمية، Olken (2007) يوزع عشوائيا 608 قرية في إندونيسيا التي كانت الطرق على وشك أن يتم بناؤها إلى ست مجموعات (لا تدقيق مقابل تدقيق، ولا دعوات لحضور اجتماعات المساءلة مقابل دعوات لحضور اجتماعات المساءلة مقابل دعوات لحضور اجتماعات المساءلة جنبا إلى جنب مع أشكال تعليق مجهول).[98] وبعد تقدير «مفقود النفقات» (مقياس الفساد)، واختتم Olken «أولكين» أن التدقيقات الحكومية كانت أكثر فعالية من «زيادة المشاركة الشعبية في الرصد» في الحد من الفساد.[98] وعموما، من المهم في العلوم الاجتماعية إلى تمثل المقصود فضلا عن العواقب غير المقصودة من التدخلات لتقييم السياسات.
علم الجريمة
وجد استعراض عام 2005 (83) تجارب عشوائية في علم الجريمة نشرت في 1982-2004، مقارنة مع 35 فقط نشرت في 1957-1981.[99] صنف المؤلفون الدراسات التي وجدوها إلى خمس فئات: «الشرطة»، «الوقاية»، «التصحيحات»، «المحكمة»، و «المجتمع» [99] التركيز فقط على إساءة برامج السلوك، جادل Hollin (2008)«هولين» أن ال RCTs قد يكون من الصعب تنفيذها (على سبيل المثال، إذا كانت ال RCT مطلوبة «الجمل تمر من شأنها أن تعين عشوائيا المخالفين للبرامج»)، وبالتالي أن التجارب مع التصميم شبه التجريبي لا تزال ضرورية .[100]
التعليم
وقد استخدمت ال RCTs في تقييم عدد من التدخلات التعليمية. على سبيل المثال، دراسة 2009 توزع عشوائيا 260 غرفة صفية لمعلمي المدارس الابتدائية لتلقي أو لا تلقي برنامج الفحص السلوكي، تدخل الغرف الصفية ، وتدريب الآباء، ومن ثم قياس الأداء السلوكي والأكاديمي لطلابها.[101] دراسة أخرى عام 2009 توزع عشوائيا غرف صفية ل678 طفل في الصف الأول لتلقي تدخل محور الغرف الصفية ، وتدخل محور الوالدين، أو عدم التدخل، ثم تبع النتائج الأكاديمية من خلال سن ال19.[102]
اقرأ أيضاً
المراجع
- ^ Chalmers TC, Smith H Jr, Blackburn B, Silverman B, Schroeder B, Reitman D, Ambroz A (1981). "A method for assessing the quality of a randomized control trial". Controlled Clinical Trials. ج. 2 ع. 1: 31–49. DOI:10.1016/0197-2456(81)90056-8. PMID:7261638.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Chalmers TC, Smith H Jr, Blackburn B, Silverman B, Schroeder B, Reitman D, Ambroz A (1981). "A method for assessing the quality of a randomized control trial". Controlled Clinical Trials. ج. 2 ع. 1: 31–49. DOI:10.1016/0197-2456(81)90056-8. PMID:7261638.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت ث ج ح خ د ذ Moher D, Hopewell S, Schulz KF, Montori V, Gøtzsche PC, Devereaux PJ, Elbourne D, Egger M, Altman DG (2010). "CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials". المجلة الطبية البريطانية. ج. 340: c869. DOI:10.1136/bmj.c869. PMC:2844943. PMID:20332511.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Ranjith G (2005). "Interferon-α-induced depression: when a randomized trial is not a randomized controlled trial". Psychother Psychosom. ج. 74 ع. 6: 387. DOI:10.1159/000087787. PMID:16244516.
- ^ Peto R, Pike MC, Armitage P, Breslow NE, Cox DR, Howard SV, Mantel N, McPherson K, Peto J, Smith PG (1976). "Design and analysis of randomized clinical trials requiring prolonged observation of each patient. I. Introduction and design". Br J Cancer. ج. 34 ع. 6: 585–612. DOI:10.1038/bjc.1976.220. PMC:2025229. PMID:795448.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Peto R, Pike MC, Armitage P, Breslow NE, Cox DR, Howard SV, Mantel N, McPherson K, Peto J, Smith PG (1977). "Design and analysis of randomized clinical trials requiring prolonged observation of each patient. II. Analysis and examples". Br J Cancer. ج. 35 ع. 1: 1–39. DOI:10.1038/bjc.1977.1. PMC:2025310. PMID:831755.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Wollert KC, Meyer GP, Lotz J, Ringes-Lichtenberg S, Lippolt P, Breidenbach C, Fichtner S, Korte T, Hornig B, Messinger D, Arseniev L, Hertenstein B, Ganser A, Drexler H (2004). "Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial". Lancet. ج. 364 ع. 9429: 141–8. DOI:10.1016/S0140-6736(04)16626-9. PMID:15246726.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ NCBI - WWW Error Blocked Diagnostic نسخة محفوظة 10 يناير 2020 على موقع واي باك مشين.
- ^ Charles Sanders Peirce and Joseph Jastrow (1885). "On Small Differences in Sensation". Memoirs of the National Academy of Sciences. ج. 3: 73–83. مؤرشف من الأصل في 2019-09-24. http://psychclassics.yorku.ca/Peirce/small-diffs.htm
- ^ Hacking، Ian (سبتمبر 1988). "Telepathy: Origins of Randomization in Experimental Design". Isis. ج. 79 ع. 3: 427–451. DOI:10.1086/354775. JSTOR:234674. MR:1013489.
- ^ Stephen M. Stigler (نوفمبر 1992). "A Historical View of Statistical Concepts in Psychology and Educational Research". American Journal of Education. ج. 101 ع. 1: 60–70. DOI:10.1086/444032.
- ^ Trudy Dehue (ديسمبر 1997). "Deception, Efficiency, and Random Groups: Psychology and the Gradual Origination of the Random Group Design". Isis. ج. 88 ع. 4: 653–673. DOI:10.1086/383850. PMID:9519574. مؤرشف من الأصل في 2022-04-05.
- ^ Neyman, Jerzy. 1923 [1990]. "On the Application of Probability Theory to AgriculturalExperiments. Essay on Principles. Section 9." Statistical Science 5 (4): 465–472. Trans. Dorota M. Dabrowska and Terence P. Speed.
- ^
According to Conniffe (1991, p. 87),
Ronald A. Fisher was "interested in application and in the popularization of statistical methods and his early book Statistical Methods for Research Workers, published in 1925, went through many editions and motivated and influenced the practical use of statistics in many fields of study. His Design of Experiments (1935) [promoted] statistical technique and application. In that book he emphasized examples and how to design experiments systematically from a statistical point of view. The mathematical justification of the methods described was not stressed and, indeed, proofs were often barely sketched or omitted altogether ..., a fact which led H. B. Mann to fill the gaps with a rigorous mathematical treatment in his well known treatise, Mann (1949)."
Page 87: Conniffe، Denis (1990–1991). "R. A. Fisher and the development of statistics—a view in his centenary year". Journal of the Statistical and Social Inquiry Society of Ireland. Dublin: Statistical and Social Inquiry Society of Ireland. ج. XXVI رقم 3. ص. 55–108. ISSN:0081-4776. مؤرشف من الأصل في 2013-10-29.
{{استشهاد بخبر}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|1=(مساعدة)Mann، H. B. (1949). Analysis and design of experiments: Analysis of variance and analysis of variance designs. New York, N. Y.: Dover Publications, Inc. ص. x+195. MR:0032177.
- ^ Streptomycin in Tuberculosis Trials Committee (1948). "Streptomycin treatment of pulmonary tuberculosis. A Medical Research Council investigation". المجلة الطبية البريطانية. ج. 2 ع. 4582: 769–82. DOI:10.1136/bmj.2.4582.769. PMC:2091872. PMID:18890300.
- ^ Brown D (2 نوفمبر 1998). "Landmark study made research resistant to bias". Washington Post.
- ^ Shikata S, Nakayama T, Noguchi Y, Taji Y, Yamagishi H (2006). "Comparison of effects in randomized controlled trials with observational studies in digestive surgery". Ann Surg. ج. 244 ع. 5: 668–76. DOI:10.1097/01.sla.0000225356.04304.bc. PMC:1856609. PMID:17060757.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Stolberg HO, Norman G, Trop I (2004). "Randomized controlled trials". Am J Roentgenol. ج. 183 ع. 6: 1539–44. DOI:10.2214/ajr.183.6.01831539. PMID:15547188. مؤرشف من الأصل في 2011-06-11.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Meldrum ML (2000). "A brief history of the randomized controlled trial. From oranges and lemons to the gold standard". Hematol Oncol Clin North Am. ج. 14 ع. 4: 745–60, vii. DOI:10.1016/S0889-8588(05)70309-9. PMID:10949771.
- ^ أ ب ت Schulz KF, Altman DG, Moher D; for the CONSORT Group (2010). "CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials". المجلة الطبية البريطانية. ج. 340: c332. DOI:10.1136/bmj.c332. PMC:2844940. PMID:20332509.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Freedman B (1987). "Equipoise and the ethics of clinical research". نيو إنغلاند جورنال أوف ميديسين. ج. 317 ع. 3: 141–5. DOI:10.1056/NEJM198707163170304. PMID:3600702.
- ^ Gifford F (1995). "Community-equipoise and the ethics of randomized clinical trials". Bioethics. ج. 9 ع. 2: 127–48. DOI:10.1111/j.1467-8519.1995.tb00306.x. PMID:11653056.
- ^ Edwards SJL, Lilford RJ, Hewison J (1998). "The ethics of randomised controlled trials from the perspectives of patients, the public, and healthcare professionals". المجلة الطبية البريطانية. ج. 317 ع. 7167: 1209–12. DOI:10.1136/bmj.317.7167.1209. PMC:1114158. PMID:9794861. مؤرشف من الأصل في 2003-07-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Zelen M (1979). "A new design for randomized clinical trials". نيو إنغلاند جورنال أوف ميديسين. ج. 300 ع. 22: 1242–5. DOI:10.1056/NEJM197905313002203. PMID:431682. مؤرشف من الأصل في 2008-11-06.
- ^ Torgerson DJ, Roland M (1998). "What is Zelen's design?". المجلة الطبية البريطانية. ج. 316 ع. 7131: 606. DOI:10.1136/bmj.316.7131.606. PMC:1112637. PMID:9518917. مؤرشف من الأصل في 2009-12-27.
- ^ Appelbaum PS, Roth LH, Lidz C (1982). "The therapeutic misconception: informed consent in psychiatric research". Int J Law Psychiatry. ج. 5 ع. 3–4: 319–29. DOI:10.1016/0160-2527(82)90026-7. PMID:6135666.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Henderson GE, Churchill LR, Davis AM, Easter MM, Grady C, Joffe S, Kass N, King NM, Lidz CW, Miller FG, Nelson DK, Peppercorn J, Rothschild BB, Sankar P, Wilfond BS, Zimmer CR (2007). "Clinical trials and medical care: defining the therapeutic misconception". PLoS Med. ج. 4 ع. 11: e324. DOI:10.1371/journal.pmed.0040324. PMC:2082641. PMID:18044980.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Jain SL (2010). "The mortality effect: counting the dead in the cancer trial". Public Culture. ج. 21 ع. 1: 89–117. DOI:10.1215/08992363-2009-017.
- ^ De Angelis C، Drazen JM، Frizelle FA، وآخرون (سبتمبر 2004). "Clinical trial registration: a statement from the International Committee of Medical Journal Editors". The New England Journal of Medicine. ج. 351 ع. 12: 1250–1. DOI:10.1056/NEJMe048225. PMID:15356289. مؤرشف من الأصل في 2020-04-14.
- ^ Law MR, Kawasumi Y, Morgan SG (2011). "Despite law, fewer than one in eight completed studies of drugs and biologics are reported on time on ClinicalTrials.gov". Health Aff (Millwood). ج. 30 ع. 12: 2338–45. DOI:10.1377/hlthaff.2011.0172. PMID:22147862. مؤرشف من الأصل في 2020-03-14.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Mathieu S, Boutron I, Moher D, Altman DG, Ravaud P (2009). "Comparison of registered and published primary outcomes in randomized controlled trials". JAMA. ج. 302 ع. 9: 977–84. DOI:10.1001/jama.2009.1242. PMID:19724045. مؤرشف من الأصل في 2020-03-14.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Bhaumik، S (مارس 2013). "Editorial policies of MEDLINE indexed Indian journals on clinical trial registration". Indian Pediatr. ج. 50 ع. 3: 339–40. DOI:10.1007/s13312-013-0092-2. PMID:23680610.
- ^ أ ب Hopewell S, Dutton S, Yu LM, Chan AW, Altman DG (2010). "The quality of reports of randomised trials in 2000 and 2006: comparative study of articles indexed in PubMed". BMJ. ج. 340: c723. DOI:10.1136/bmj.c723. PMC:2844941. PMID:20332510. مؤرشف من الأصل في 2010-04-02.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Jones، Byron؛ Kenward, Michael G. (2003). Design and Analysis of Cross-Over Trials (ط. Second). London: Chapman and Hall.
- ^ Vonesh، Edward F.؛ Chinchilli, Vernon G. (1997). "Crossover Experiments". نموذج الانحدار الخطي and Nonlinear نموذج إحصائي for the Analysis of Repeated Measurements. London: Chapman and Hall. ص. 111–202.
- ^ أ ب ت ث Zwarenstein M, Treweek S, Gagnier JJ, Altman DG, Tunis S, Haynes B, Oxman AD, Moher D; CONSORT group; Pragmatic Trials in Healthcare (Practihc) group (2008). "Improving the reporting of pragmatic trials: an extension of the CONSORT statement". BMJ. ج. 337: a2390. DOI:10.1136/bmj.a2390. PMC:3266844. PMID:19001484. مؤرشف من الأصل في 2010-04-10.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت ث Piaggio G, Elbourne DR, دوغ ألتمان، Pocock SJ, Evans SJ; CONSORT Group (2006). "Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement". JAMA. ج. 295 ع. 10: 1152–60. DOI:10.1001/jama.295.10.1152. PMID:16522836. مؤرشف من الأصل في 2010-08-17.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت Schulz KF, Grimes DA (2002). "Generation of allocation sequences in randomised trials: chance, not choice". Lancet. ج. 359 ع. 9305: 515–9. DOI:10.1016/S0140-6736(02)07683-3. PMID:11853818. مؤرشف من الأصل في 2020-04-14.
- ^ أ ب ت ث ج ح خ د Schulz KF, Grimes DA (2002). "Allocation concealment in randomised trials: defending against deciphering". Lancet. ج. 359 ع. 9306: 614–8. DOI:10.1016/S0140-6736(02)07750-4. PMID:11867132. مؤرشف من الأصل في 2020-04-14.
- ^ Howick J, Mebius A (2014). "In search of justification for the unpredictability paradox". Trials. ج. 15: 480. DOI:10.1186/1745-6215-15-480. PMID:25490908. مؤرشف من الأصل في 2015-11-01.
- ^ أ ب Lachin JM (1988). "Statistical properties of randomization in clinical trials". Controlled Clinical Trials. ج. 9 ع. 4: 289–311. DOI:10.1016/0197-2456(88)90045-1. PMID:3060315.
- ^ Rosenberger، James. "STAT 503 - Design of Experiments". Pennsylvania State University. مؤرشف من الأصل في 2018-07-20. اطلع عليه بتاريخ 2012-09-24.
- ^ Avins، "A L" (1998). ""Can unequal be more fair? Ethics, subject allocation, and randomized clinical trials"". J Med Ethics. ج. 24 ع. 6: 401–408. DOI:10.1136/jme.24.6.401. مؤرشف من الأصل في 2019-10-26.
- ^ Buyse ME (1989). "Analysis of clinical trial outcomes: some comments on subgroup analyses". Controlled Clinical Trials. ج. 10 ع. 4 Suppl: 187S–194S. DOI:10.1016/0197-2456(89)90057-3. PMID:2605967.
- ^ أ ب ت ث ج ح Lachin JM, Matts JP, Wei LJ (1988). "Randomization in clinical trials: conclusions and recommendations". Controlled Clinical Trials. ج. 9 ع. 4: 365–74. DOI:10.1016/0197-2456(88)90049-9. PMID:3203526.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Rosenberger WF, Lachin JM (1993). "The use of response-adaptive designs in clinical trials". Controlled Clinical Trials. ج. 14 ع. 6: 471–84. DOI:10.1016/0197-2456(93)90028-C. PMID:8119063.
- ^ Forder PM, Gebski VJ, Keech AC (2005). "Allocation concealment and blinding: when ignorance is bliss". Med J Aust. ج. 182 ع. 2: 87–9. PMID:15651970. مؤرشف من الأصل في 2011-06-06.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Pildal J, Chan AW, Hróbjartsson A, Forfang E, Altman DG, Gøtzsche PC (2005). "Comparison of descriptions of allocation concealment in trial protocols and the published reports: cohort study". BMJ. ج. 330 ع. 7499: 1049. DOI:10.1136/bmj.38414.422650.8F. PMC:557221. PMID:15817527. مؤرشف من الأصل في 2009-03-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت Wood L, Egger M, Gluud LL, Schulz KF, Jüni P, Altman DG, Gluud C, Martin RM, Wood AJ, Sterne JA (2008). "Empirical evidence of bias in treatment effect estimates in controlled trials with different interventions and outcomes: meta-epidemiological study". BMJ. ج. 336 ع. 7644: 601–5. DOI:10.1136/bmj.39465.451748.AD. PMC:2267990. PMID:18316340. مؤرشف من الأصل في 2009-02-03.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Glennerster، Rachel؛ Kudzai Takavarasha (2013). Running randomized evaluations: a practical guide. Princeton: Princeton University Press.
- ^ Devereaux PJ, Manns BJ, Ghali WA, Quan H, Lacchetti C, Montori VM, Bhandari M, Guyatt GH (2001). "Physician interpretations and textbook definitions of blinding terminology in randomized controlled trials". دورية الجمعية الطبية الأمريكية. ج. 285 ع. 15: 2000–3. DOI:10.1001/jama.285.15.2000. PMID:11308438. مؤرشف من الأصل في 2009-01-22.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Haahr MT, Hróbjartsson A (2006). "Who is blinded in randomized clinical trials? A study of 200 trials and a survey of authors". Clin Trials. ج. 3 ع. 4: 360–5. DOI:10.1177/1740774506069153. PMID:17060210. مؤرشف من الأصل في 2009-05-31.
- ^ Marson AG، Al-Kharusi AM، Alwaidh M، Appleton R، Baker GA، Chadwick DW، وآخرون (2007). "The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalised and unclassifiable epilepsy: an unblinded randomised controlled trial". Lancet. ج. 369 ع. 9566: 1016–26. DOI:10.1016/S0140-6736(07)60461-9. PMC:2039891. PMID:17382828.
- ^ Chan R, Hemeryck L, O'Regan M, Clancy L, Feely J (1995). "Oral versus intravenous antibiotics for community acquired lower respiratory tract infection in a general hospital: open, randomised controlled trial". BMJ. ج. 310 ع. 6991: 1360–2. DOI:10.1136/bmj.310.6991.1360. PMC:2549744. PMID:7787537. مؤرشف من الأصل في 2003-08-23.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Fukase K, Kato M, Kikuchi S, Inoue K, Uemura N, Okamoto S, Terao S, Amagai K, Hayashi S, Asaka M; Japan Gast Study Group (2008). "Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial". Lancet. ج. 372 ع. 9636: 392–7. DOI:10.1016/S0140-6736(08)61159-9. PMID:18675689.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Noseworthy JH, Ebers GC, Vandervoort MK, Farquhar RE, Yetisir E, Roberts R (1994). "The impact of blinding on the results of a randomized, placebo-controlled multiple sclerosis clinical trial". Neurology. ج. 44 ع. 1: 16–20. DOI:10.1212/wnl.44.1.16. PMID:8290055. مؤرشف من الأصل في 10 مايو 2005. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Manns MP, McHutchison JG, Gordon SC, Rustgi VK, Shiffman M, Reindollar R, Goodman ZD, Koury K, Ling M, Albrecht JK (2001). "Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial". Lancet. ج. 358 ع. 9286: 958–65. DOI:10.1016/S0140-6736(01)06102-5. PMID:11583749.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Schwartz GG, Olsson AG, Ezekowitz MD, Ganz P, Oliver MF, Waters D, Zeiher A, Chaitman BR, Leslie S, Stern T; Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators (2001). "Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial". دورية الجمعية الطبية الأمريكية. ج. 285 ع. 13: 1711–8. DOI:10.1001/jama.285.13.1711. PMID:11277825. مؤرشف من الأصل في 2010-05-31.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J; Writing Group for the Women's Health Initiative Investigators (2002). "Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative randomized controlled trial". دورية الجمعية الطبية الأمريكية. ج. 288 ع. 3: 321–33. DOI:10.1001/jama.288.3.321. PMID:12117397. مؤرشف من الأصل في 2010-12-02.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Hollis S, Campbell F (1999). "What is meant by intention to treat analysis? Survey of published randomised controlled trials". المجلة الطبية البريطانية. ج. 319 ع. 7211: 670–4. DOI:10.1136/bmj.319.7211.670. PMC:28218. PMID:10480822. مؤرشف من الأصل في 2009-08-26.
- ^ CONSORT Group. "Welcome to the CONSORT statement Website". مؤرشف من الأصل في 2019-05-09. اطلع عليه بتاريخ 2010-03-29.
- ^ أ ب Benson K, Hartz AJ (2000). "A comparison of observational studies and randomized, controlled trials". نيو إنغلاند جورنال أوف ميديسين. ج. 342 ع. 25: 1878–86. DOI:10.1056/NEJM200006223422506. PMID:10861324. مؤرشف من الأصل في 2009-02-22.
- ^ أ ب Concato J, Shah N, Horwitz RI (2000). "Randomized, controlled trials, observational studies, and the hierarchy of research designs". نيو إنغلاند جورنال أوف ميديسين. ج. 342 ع. 25: 1887–92. DOI:10.1056/NEJM200006223422507. PMC:1557642. PMID:10861325. مؤرشف من الأصل في 2020-05-21.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Ioannidis JP, Haidich AB, Pappa M, Pantazis N, Kokori SI, Tektonidou MG, Contopoulos-Ioannidis DG, Lau J (2001). "Comparison of evidence of treatment effects in randomized and nonrandomized studies". دورية الجمعية الطبية الأمريكية. ج. 286 ع. 7: 821–30. DOI:10.1001/jama.286.7.821. PMID:11497536. مؤرشف من الأصل في 2010-05-11.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Vandenbroucke JP (2008). "Observational research, randomised trials, and two views of medical science". PLoS Med. ج. 5 ع. 3: e67. DOI:10.1371/journal.pmed.0050067. PMC:2265762. PMID:18336067.
- ^ أ ب ت ث ج Black N (1996). "Why we need observational studies to evaluate the effectiveness of health care". BMJ. ج. 312 ع. 7040: 1215–8. DOI:10.1136/bmj.312.7040.1215. PMC:2350940. PMID:8634569. مؤرشف من الأصل في 2010-07-22.
- ^ أ ب Glasziou P, Chalmers I, Rawlins M, McCulloch P (2007). "When are randomised trials unnecessary? Picking signal from noise". المجلة الطبية البريطانية. ج. 334 ع. 7589: 349–51. DOI:10.1136/bmj.39070.527986.68. PMC:1800999. PMID:17303884.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Einhorn LH (2002). "Curing metastatic testicular cancer". Proc Natl Acad Sci U S A. ج. 99 ع. 7: 4592–5. DOI:10.1073/pnas.072067999. PMC:123692. PMID:11904381.
- ^ Wittes J (2002). "Sample size calculations for randomized controlled trials". Epidemiol Rev. ج. 24 ع. 1: 39–53. DOI:10.1093/epirev/24.1.39. PMID:12119854.
- ^ Freiman JA, Chalmers TC, Smith H Jr, Kuebler RR (1978). "The importance of beta, the type II error and sample size in the design and interpretation of the randomized control trial. Survey of 71 "negative" trials". نيو إنغلاند جورنال أوف ميديسين. ج. 299 ع. 13: 690–4. DOI:10.1056/NEJM197809282991304. PMID:355881. مؤرشف من الأصل في 2010-03-17.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Charles P, Giraudeau B, Dechartres A, Baron G, Ravaud P (12 مايو 2009). "Reporting of sample size calculation in randomised controlled trials: review". المجلة الطبية البريطانية. ج. 338: b1732. DOI:10.1136/bmj.b1732. PMC:2680945. PMID:19435763.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ National Health and Medical Research Council (16 نوفمبر 1998). A guide to the development, implementation and evaluation of clinical practice guidelines (PDF). Canberra: Commonwealth of Australia. ص. 56. مؤرشف من الأصل (PDF) في 2017-10-14. اطلع عليه بتاريخ 2010-03-28.
- ^ أ ب Harris RP, Helfand M, Woolf SH, Lohr KN, Mulrow CD, Teutsch SM, Atkins D; Methods Work Group, Third US Preventive Services Task Force (2001). "Current methods of the US Preventive Services Task Force: a review of the process" (PDF). Am J Prev Med. ج. 20 ع. 3 Suppl: 21–35. DOI:10.1016/S0749-3797(01)00261-6. PMID:11306229. مؤرشف من الأصل في 2016-12-21.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Guyatt GH, Oxman AD, Kunz R, Vist GE, Falck-Ytter Y, Schünemann HJ; GRADE Working Group (2008). "What is "quality of evidence" and why is it important to clinicians?". BMJ. ج. 336 ع. 7651: 995–8. DOI:10.1136/bmj.39490.551019.BE. PMC:2364804. PMID:18456631. مؤرشف من الأصل في 2009-02-08.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Oxford Centre for Evidence-based Medicine (16 سبتمبر 2011). "Levels of evidence". مؤرشف من الأصل في 2014-05-13. اطلع عليه بتاريخ 2012-02-15.
- ^ أ ب ت Anderson JL, Pratt CM, Waldo AL, Karagounis LA (1997). "Impact of the Food and Drug Administration approval of flecainide and encainide on coronary artery disease mortality: putting "Deadly Medicine" to the test". Am J Cardiol. ج. 79 ع. 1: 43–7. DOI:10.1016/S0002-9149(96)00673-X. PMID:9024734. مؤرشف من الأصل في 2020-04-14.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Rubin R (16 أكتوبر 2006). "In medicine, evidence can be confusing - deluged with studies, doctors try to sort out what works, what doesn't". USA Today. مؤرشف من الأصل في 2011-06-29. اطلع عليه بتاريخ 2010-03-22.
- ^ "Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators". N Engl J Med. ج. 321 ع. 6: 406–12. 1989. DOI:10.1056/NEJM198908103210629. PMID:2473403. مؤرشف من الأصل في 2008-07-04.
- ^ Anderson GL، Limacher M، Assaf AR، Bassford T، Beresford SA، Black H، وآخرون (2004). "Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial". JAMA. ج. 291 ع. 14: 1701–12. DOI:10.1001/jama.291.14.1701. PMID:15082697. مؤرشف من الأصل في 2010-12-02.
- ^ Grodstein F, Clarkson TB, Manson JE (2003). "Understanding the divergent data on postmenopausal hormone therapy". N Engl J Med. ج. 348 ع. 7: 645–50. DOI:10.1056/NEJMsb022365. PMID:12584376. مؤرشف من الأصل في 2009-02-27.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Vandenbroucke JP (2009). "The HRT controversy: observational studies and RCTs fall in line". Lancet. ج. 373 ع. 9671: 1233–5. DOI:10.1016/S0140-6736(09)60708-X. PMID:19362661. مؤرشف من الأصل في 2020-01-10.
- ^ Hsu A, Card A, Lin SX, Mota S, Carrasquillo O, Moran A (2009). "Changes in postmenopausal hormone replacement therapy use among women with high cardiovascular risk". Am J Public Health. ج. 99 ع. 12: 2184–7. DOI:10.2105/AJPH.2009.159889. PMC:2775780. PMID:19833984. مؤرشف من الأصل في 2011-10-27.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت Sanson-Fisher RW, Bonevski B, Green LW, D'Este C (2007). "Limitations of the randomized controlled trial in evaluating population-based health interventions". Am J Prev Med. ج. 33 ع. 2: 155–61. DOI:10.1016/j.amepre.2007.04.007. PMID:17673104. مؤرشف من الأصل في 2020-04-14.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Rothwell PM (2005). "External validity of randomised controlled trials: "to whom do the results of this trial apply?"" (PDF). Lancet. ج. 365 ع. 9453: 82–93. DOI:10.1016/S0140-6736(04)17670-8. PMID:15639683. مؤرشف من الأصل في 2016-03-03.
- ^ Van Spall HG, Toren A, Kiss A, Fowler RA (2007). "Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review". JAMA. ج. 297 ع. 11: 1233–40. DOI:10.1001/jama.297.11.1233. PMID:17374817. مؤرشف من الأصل في 2010-08-13.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Johnston SC, Rootenberg JD, Katrak S, Smith WS, Elkins JS (2006). "Effect of a US National Institutes of Health programme of clinical trials on public health and costs" (PDF). Lancet. ج. 367 ع. 9519: 1319–27. DOI:10.1016/S0140-6736(06)68578-4. PMID:16631910. مؤرشف من الأصل (PDF) في 3 مارس 2016. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Yitschaky O, Yitschaky M, Zadik Y (مايو 2011). "Case report on trial: Do you, Doctor, swear to tell the truth, the whole truth and nothing but the truth?" (PDF). J Med Case Reports. ج. 5 ع. 1: 179. DOI:10.1186/1752-1947-5-179. PMC:3113995. PMID:21569508. مؤرشف من الأصل (PDF) في 2016-03-03.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "How Well Do Meta-Analyses Disclose Conflicts of Interests in Underlying Research Studies | The Cochrane Collaboration". Cochrane.org. مؤرشف من الأصل في 2014-12-16. اطلع عليه بتاريخ 2011-08-19.
- ^ Bekelman JE, Li Y, Gross CP (2003). "Scope and impact of financial conflicts of interest in biomedical research: a systematic review". دورية الجمعية الطبية الأمريكية. ج. 289 ع. 4: 454–65. DOI:10.1001/jama.289.4.454. PMID:12533125. مؤرشف من الأصل في 2010-08-18.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Bhandari M, Busse JW, Jackowski D, Montori VM, Schünemann H, Sprague S, Mears D, Schemitsch EH, Heels-Ansdell D, Devereaux PJ (2004). "Association between industry funding and statistically significant pro-industry findings in medical and surgical randomized trials". Can Med Assoc J. ج. 170 ع. 4: 477–80. PMC:332713. PMID:14970094. مؤرشف من الأصل في 2016-08-30.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Ridker PM، Torres J (2006). "Reported outcomes in major cardiovascular clinical trials funded by for-profit and not-for-profit organizations: 2000-2005". JAMA. ج. 295 ع. 19: 2270–4. DOI:10.1001/jama.295.19.2270. PMID:16705108.
- ^ Rowland, D., DiGuiseppi, C., Gross, M., Afolabi, E. and Roberts, I. (2003). "Randomised controlled trial of site specific advice on school travel patterns". Archives of Disease in Childhood. ج. 88 ع. 1: 8–11. DOI:10.1136/adc.88.1.8.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Graham-Rowe, E., Skippon, S., Gardner, B. and Abraham, C. (2011). "Can we reduce car use and, if so, how? A review of available evidence". Transportation Research Part A: Policy and Practice. ج. 44 ع. 5: 401–418.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Melia(2011) Do Randomised Control Trials Offer a Solution to ’low Quality’ Transport Research? Bristol: University of the West of England][وصلة مكسورة] Do نسخة محفوظة 14 أبريل 2020 على موقع واي باك مشين.
- ^ Introduction to Evaluations | The Abdul Latif Jameel Poverty Action Lab نسخة محفوظة 10 مارس 2016 على موقع واي باك مشين.
- ^ Banerjee AV, Cole S, Duflo E, Linden L (2007). "Remedying education: evidence from two randomized experiments in India". Quarterly Journal of Economics. ج. 122 ع. 3: 1235–1264. DOI:10.1162/qjec.122.3.1235.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Karlan D, Zinman J (2010). "Expanding credit access: using randomized supply decisions to estimate the impacts". Review of Financial Studies. ج. 23 ع. 1: 433–464. DOI:10.1093/rfs/hhp092.
- ^ أ ب Olken BA (2007). "Monitoring corruption: evidence from a field experiment in Indonesia". Journal of Political Economy. ج. 115 ع. 2: 200–249. DOI:10.1086/517935.
- ^ أ ب Farrington DP, Welsh BC (2005). "Randomized experiments in criminology: What have we learned in the last two decades?". Journal of Experimental Criminology. ج. 1 ع. 1: 9–38. DOI:10.1007/s11292-004-6460-0.
- ^ Hollin CR (2008). "Evaluating offending behaviour programmes: does only randomization glister?". Criminology and Criminal Justice. ج. 8 ع. 1: 89–106. DOI:10.1177/1748895807085871.
- ^ Walker HM, Seeley JR, Small J, Severson HH, Graham BA, Feil EG, Serna L, Golly AM, Forness SR (2009). "A randomized controlled trial of the First Step to Success early intervention. Demonstration of program efficacy outcomes in a diverse, urban school district". Journal of Emotional and Behavioral Disorders. ج. 17 ع. 4: 197–212. DOI:10.1177/1063426609341645.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Bradshaw CP, Zmuda JH, Kellam SG, Ialongo NS (2009). "Longitudinal impact of two universal preventive interventions in first grade on educational outcomes in high school". مجلة علم النفس التربوي. ج. 101 ع. 4: 926–937. DOI:10.1037/a0016586.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)