|
تضامنًا مع حق الشعب الفلسطيني |
بيرأوكسينايتريت
| بيرأوكسينايتريت | |
|---|---|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل |
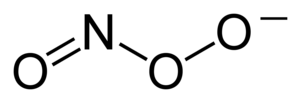

بيرأوكسينايتريت (أحيانا يسمى بيروكسونايتريت) هو أيون يأتي على الصيغة (ONOO−). وهو مصاوغ بنائي غير مستقر من النترات، NO−3.
على الرغم من أن حمضه المرافق شديد التفاعل، فإن بيرأوكسينايتريت مستقر في المحاليل القلوية.[1][2] يتم تحضيره بواسطة تفاعل بيروكسيد الهيدروجين مع النتريت:
- H2O2 + NO2− → ONOO− + H2O
بيرأوكسينايتريت هو عامل مؤكسد و نترتة. بسبب خواصه المؤكسدة، يمكن أن يتلف مجموعة واسعة من الجزيئات في الخلايا، بما في ذلك الحمض النووي والبروتينات. يُعزى تكوين بيرأوكسينايتريت في داخل جسم الإنسان إلى تفاعل فوق أكسيد الجذر الحر مع أحادي أكسيد النيتروجين الجذري الحر. [3][4]
- O2•− + NO• → ONO2−
بيرأوكسينايتريت (أحيانا يسمى بيروكسونايتريت) هو أيون يأتي على الصيغة (ONOO−). وهو مصاوغ بنائي غير مستقر من النترات، NO−3.
على الرغم من أن حمضه المرافق شديد التفاعل، فإن بيرأوكسينايتريت مستقر في المحاليل القلوية.[1][2] يتم تحضيره بواسطة تفاعل بيروكسيد الهيدروجين مع النتريت:
- H2O2 + NO2− → ONOO− + H2O
بيرأوكسينايتريت هو عامل مؤكسد و نترتة. بسبب خواصه المؤكسدة، يمكن أن يتلف مجموعة واسعة من الجزيئات في الخلايا، بما في ذلك الحمض النووي والبروتينات. يُعزى تكوين بيرأوكسينايتريت في داخل جسم الإنسان إلى تفاعل فوق أكسيد الجذر الحر مع أحادي أكسيد النيتروجين الجذري الحر. [3][4]
- O2•− + NO• → ONO2−
ينتج عن الاقتران الناتج عن هذين الراديكاليين الحرين بيرأوكسينايتريت، وهو جزيء في حد ذاته ليس جذرًا حرًا، ولكنه مؤكسد قوي.
في المختبر، يمكن تحضير محلول من بيرأوكسينايتريت عن طريق معالجة بيروكسيد الهيدروجين المحمض بمحلول من نتريت الصوديوم، يليه إضافة سريعة من NaOH. يشار إلى تركيزه من خلال الامتصاص عند 302 نانومتر (درجة الحموضة 12 ، 2302 = 1670 م − 1 سم − 1).
دوره كمحب للنواة
يتفاعل بيرأوكسينايتريت (ONOO−) كمحب وأليف للنواة مع ثاني أكسيد الكربون. في الجسم الحي، يكون تركيز ثاني أكسيد الكربون حوالي 1 مم، ويحدث تفاعله مع (ONOO−) بسرعة. وبالتالي، في ظل الظروف الفسيولوجية، يكون تفاعل (ONOO−) مع ثاني أكسيد الكربون لتكوين نيتروسوبروكسيكربونات (ONOOCO−2). ما يقرب من 66 ٪ من الوقت، هاذان الجذانر يتجمعان لتكوين ثاني أكسيد الكربون والنترات. إن هذه الجذور (جذرية الكربونات وثاني أكسيد النيتروجين) هي التي يعتقد أنها تسبب تلفًا خلويًا بالبيرأوكسينايتريت.
حمض النتريك
حمض النتريك (HNO3) هو نوع يحتوي على النيتروجين النشط. وهذا هو الحمض المرافق من البيرأوكسينايتريت. قيمة pKa ~ 6.8.
مراجع
- ^ أ ب Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. (ردمك 0-12-352651-5).
- ^ أ ب Koppenol، W. H (1998). "The chemistry of peroxynitrite, a biological toxin<a name=TOP1></a>". Química Nova. ج. 21 ع. 3: 326–331. DOI:10.1590/S0100-40421998000300014.
- ^ أ ب Pacher، P؛ Beckman، J. S؛ Liaudet، L (2007). "Nitric oxide and peroxynitrite in health and disease". Physiological Reviews. ج. 87 ع. 1: 315–424. DOI:10.1152/physrev.00029.2006. PMC:2248324. PMID:17237348.
- ^ أ ب Szabó، C؛ Ischiropoulos، H؛ Radi، R (2007). "Peroxynitrite: Biochemistry, pathophysiology and development of therapeutics". Nature Reviews Drug Discovery. ج. 6 ع. 8: 662–80. DOI:10.1038/nrd2222. PMID:17667957.
| بيرأوكسينايتريت في المشاريع الشقيقة: | |