|
تضامنًا مع حق الشعب الفلسطيني |
فلوريد المنغنيز الثلاثي
| فلوريد المنغنيز الثلاثي | |
|---|---|
| الاسم النظامي (IUPAC) | |
فلوريد المنغنيز الثلاثي |
|
| أسماء أخرى | |
ثلاثي فلوريد المنغنيز |
|
| المعرفات | |
| رقم CAS | 7783-53-1 |
| بوب كيم (PubChem) | 522682 |
| الخواص | |
| الصيغة الجزيئية | MnF3 |
| الكتلة المولية | 111.94 غ/مول |
| المظهر | بلورات زهرية قرمزية |
| الكثافة | 3.54 غ/سم3 |
| نقطة الانصهار | > 600 °س يتفكك |
| الذوبانية في الماء | يتفاعل |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
فلوريد المنغنيز الثلاثي مركب كيميائي له الصيغة MnF3، ويكون على شكل بلورات زهرية قرمزية. ويكون المنغنيز بحالة أكسدة +3 في هذا المركب.
الخواص
- يتفاعل فلوريد المنغنيز الثلاثي مع الماء عند التماس معه في تفاعل حلمهة. لكن يوجد من المركب شكل مائي (هيدرات ثلاثية MnF3.3H2O) والتي يحصل عليها من خلال عملية بلورة للمركب في حمض هيدروفلوريك.
- إن تسخين المركب يؤدي إلى تفككه إلى فلوريد المنغنيز الثنائي.[2][3]
- يتفاعل فلوريد المنغنيز الثلاثي مع فلوريد الصوديوم أنيون سداسي فلورات التي لها بنية جزيئية ثمانية الوجوه.[4]
- 3NaF + MnF3 → Na3MnF6
تعطي شروط أخرى للتفاعل أعلاه نواتج مختلفة يمكن أن تطون لها الصيغة 2-MnF5 أو -MnF4. يكون لهذه الأنيونات (أيونات سالبة الشحنة) بنى خطية وطبقية على الترتيب، مع وجود روابط فلورية جسرية فيما بيتها.[4]
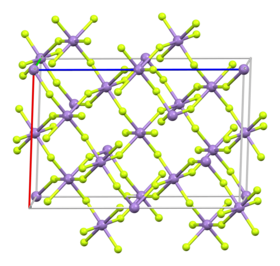
البنية
يكون لفلوريد المنغنيز الثلاثي بنية بلورية مشابهة لبنية فلوريد الفاناديوم الثلاثي، حيث أن لكليهما بنية جزيئية ثمانية الوجوه تتوسطها ذرة الفلز الموافق ولهما متوسط طول رابطة M-F مشابه. على الرغم من ذلك، فإن لفلوريد المنغنيز الثلاثي بنية مشوهة عن تلك لفلوريد الفاناديوم التي تتميز بتناظر هندسي، ويؤدي التشوه (عدم الانتظام) إلى تبني نظام بلوري أحادي الميل حسب تأثير يان-تيلر Jahn–Teller effect، وتكون أطزال الروابط Mn-F كالتالي: 1.79 و 1.91 و 2.09 Å.[5][6][7]
أما الهيدرات الثلاثية لفلوريد المنغنيز الثلاثي فتظهر بنيتين مختلفتين وذلك اعتمادا على الصيغة -[Mn(H2O)4F2]+ [Mn(H2O)2F4] والذين لديهما المجموعة الفراغية P21/c و P21/a. على الترتيب.[8]
التحضير
يحضر فلوريد المنغنيز الثلاثي من معالجة محلول من فلوريد المنغنيز الثنائي في حمض هيدروفلوريك مع بغاز الفلور.[9]
- MnF2 + 0.5 F2 → MnF3
الاستخدامات
يستخدم فلوريد المنغنيز الثلاثي في الكيمياء العضوية كعامل مفلور (إضافة الفلور).[10] يستطيع MnF3 أن يفلور الهيدروكربونات العطرية [11] وحلقي البوتينات [12] والفوليرينات.[13]
المراجع
- ^ صفحة البيانات الكيميائية من Sigma-Aldrich نسخة محفوظة 2020-06-01 على موقع واي باك مشين.
- ^ Manganese; section Manganic Salts via www.1911encyclopedia.orgنسخة محفوظة 27 مايو 2013 على موقع واي باك مشين.
- ^ In situ time-resolved X-ray diffraction study of manganese trifluoride thermal decomposition، J.V. Raua, V. Rossi Albertinib, N.S. Chilingarova, S. Colonnab, U. Anselmi Tamburini, Journal of Fluorine Chemistry 4506 (2001) 1–4، نسخة إلكترونية من المنشور العلمي نسخة محفوظة 30 ديسمبر 2017 على موقع واي باك مشين.
- ^ أ ب Inorganic chemistry, Catherine E. Housecroft, A.G. Sharpe, pp.711-712, section Manganese (III)، googlebooks link نسخة محفوظة 12 نوفمبر 2012 على موقع واي باك مشين.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Hepworth, M. A.; Jack, K. H.; Ronald Sydney Nyholm, R. S. (1957). "Interatomic Bonding in Manganese Trifluoride". Nature. ج. 179: 211–212. DOI:10.1038/179211b0.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ M. A. Hepworth, K. H. Jack (1957). "The crystal structure of manganese trifluoride, MnF3". Acta Crystallographica. ج. 10: 345–351. DOI:10.1107/S0365110X57001024.
- ^ Structures of two polymorphs of MnF3·3H2O، Michel Molinier and Werner Massa، Journal of Fluorine Chemistry، Volume 57, Issues 1-3, April-June 1992, pp.139-146، online abstract via www.sciencedirect.com[وصلة مكسورة] نسخة محفوظة 18 فبراير 2019 على موقع واي باك مشين.
- ^ Z. Mazej (2002). "Room temperature syntheses of MnF3, MnF4 and hexafluoromanganete(IV) salts of alkali cations". Journal of Fluorine Chemistry. ج. 114 ع. 1: 75–80. DOI:10.1016/S0022-1139(01)00566-8.
- ^ Burley, G. A.; Taylor, R. "Manganese(III) fluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. دُوِي:10.1002/047084289
- ^ Fluorination of p-chlorobenzotrifluoride by manganese trifluoride A. Kachanov, V. Kornilov, V.Belogay، Fluorine Notes :Vol. 1 (1) November-December 1998، via notes.fluorine1.ru[وصلة مكسورة] نسخة محفوظة 11 أبريل 2016 على موقع واي باك مشين.
- ^ Fluorination of fluoro-cyclobutene with high-valency metal fluoride m Junji Mizukado, Yasuhisa Matsukawa, Heng-dao Quan, Masanori Tamura, Akira Sekiya، Journal of Fluorine Chemistry Volume 127, Issue 1, January 2006, Pages 79-84، online abstract via www.sciencedirect.com[وصلة مكسورة] نسخة محفوظة 18 فبراير 2019 على موقع واي باك مشين.
- ^ Fluorination of the cubic and hexagonal C60 modifications by crystalline manganese trifluoride، Physics of the Solid State، Volume 44, Number 4، 4/2002، pp.629-630، V.É. Aleshina, A.Ya. Borshchevskii, E.V. Skokan, I.V. Arkhangel’skii, A.V. Astakhov, N.B. Shustova، online abstract via www.springerlink نسخة محفوظة 5 مارس 2020 على موقع واي باك مشين.[وصلة مكسورة]
| فلوريد المنغنيز الثلاثي في المشاريع الشقيقة: | |