|
تضامنًا مع حق الشعب الفلسطيني |
سافلوفيناسيل
| سافلوفيناسيل | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
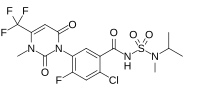
2-Chloro-4-fluoro-5-[3-methyl-2,6-dioxo-4-(trifluoromethyl)-3,6-dihydropyrimidin-1(2H)-yl]-N-[methyl(propan-2-yl)sulfamoyl]benzamide |
|
| المعرفات | |
| رقم CAS | 372137-35-4 |
| بوب كيم (PubChem) | 11571392 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C17H17ClF4N4O5S |
| كتلة مولية | 500.85 غ.مول−1 |
| الكثافة | 1.595 غرام/ملليلتر |
| نقطة الانصهار | 189.9 °س، 463 °ك، 374 °ف |
| الذوبانية في الماء | 2100 ملليغرام/لتر (20 °C) |
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | تحذير |
| بيانات الخطر وفق GHS | H410 |
| بيانات وقائية وفق GHS | P273, P391, P501 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
سافلوفيناسيل هو الاسم الشائع لمركب عضوي من فئة البيريميدين ديون الكيميائية التي تستخدم كمبيدات للأعشاب. وهو يعمل عن طريق تثبيط إنزيم البروتوبرفيرينوجين أوكسيداز للتحكم في نمو الحشائش عريضة الأوراق في المحاصيل، والتي من اهما محاصيل فول الصويا والذرة.[1]
لمحة تاريخية
قدم الكيميائيون في مختبرات الدكتور ر. ماغ التابعة لشركة هوفمان-لا روش في عام 1985 براءات اختراع لمشتقات مركب 3-أريل اليورازول، والتي أظهرت نشاطًا فعالًا كمبيدات للأعشاب.[2] بيعت مختبرات ماغ للأبحاث الكيميائية الزراعية في عام 1990 لشركة سيبا غايغي، واستمر العمل فيها على تحسين هذا المجال من النشاط الحيوي، ونُشرت بعد ذلك براءات اختراع أخرى لاسترات إضافية لهذه المركبات كان من بينها مركب بوتافيناسيل (CGA276854)، والذي طُرح في الأسواق في عام 2001.[3][4]
قام علماء شركة باسف بعد ذلك بالعمل على تطوير هذه المركبات، وحصلوا على براءة اختراع مشابهًا وظيفيًا نتج عن استبدال إستر الكربوكسيل في مركب بوتافيناسيل بسلفامويل الكربوكساميد، وعُرف بمركب السافلوفيناسيل.
طُرح السافلوفيناسيل بالأسواق لأول مرة في عام 2008، بعد أن حمل الرقم الكودي (BAS800H) والعلامة التجارية كيكسور.[5]
التحضير
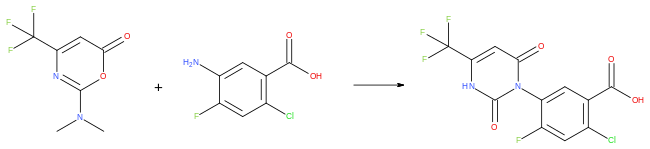
تتضمن الخطوة الرئيسية في تحضير مركب السافلوفيناسيل، كما هو موضح في براءة اختراع شركة باسف، التفاعل بين مستبدل الأنيلين، والأوكسازينون. يُسخّن بعد ذلك مركب حمض 2-كلورو-4-فلورو-5-أمينو البنزويك ومركب 2-ثنائي ميثيل أمينو-4-(ثلاثي فلورو ميثيل)-6 هيدرو-1،3-أوكسازين-6 ون في حمض الأسيتيك لتكوين الأنظمة الحلقية لمبيد الأعشاب وتتجاوز نسبة النواتج 90%. ويتكون الناتج النهائي بعد إجراء المزيد من التحولات الكيميائية المعيارية.[5]
آلية العمل
يعمل مركب السافلوفيناسيل عن طريق تثبيط إنزيم البروتوبورفيرينوجين أوكسيداز 9، ومنع تكوين الكلوروفيل، مما يؤدي إلى تراكم البروتوبورفيرين 9، وهو محسس ضوئي قوي. يعمل هذا على تنشيط الأكسجين، مما يؤدي إلى أكسدة الليبيد مع فقدان سريع لسلامة ووظيفة الغشاء الخلوي. وتتضمن التأثيرات المرئية التي تظهر على النباتات الكاملة بفعل مبيد السافلوفيناسيل إصابة النبات بشحوب الأوراق والنخر.[6] تكون تأثيرات السافلوفيناسيل في الذرة وبعض أنواع فول الصويا غير كافية لإحداث أضرار جسيمة مما يؤدي إلى انتقائية مفيدة، لذا يُستخدم السافلوفيناسيل كمبيد الأعشاب في محاصيل الذرة وفول الصويا على وجه الخصوص.[7][8]
الاستخدام
وافقت وكالة حماية البيئة الأمريكية على بيع واستخدام مبيدات السافلوفيناسيل في الولايات المتحدة الأمريكية. تُعتبر وكالة حماية البيئة مسؤولة عن تنظيم مبيدات الآفات بموجب القانون الفيدرالي لمبيدات الحشرات ومبيدات الفطريات ومبيدات القوارض، وقانون حماية جودة الأغذية، وتحسين تسجيل مبيدات الآفات قانون، ولا يمكن استخدام المبيد بشكل قانوني إلا وفقًا للإرشادات الموجودة على الملصق الموجود وقت البيع.[7][9]
يتحكم السافلوفيناسيل المبيد للأعشاب في نمو الحشائش عريضة الأوراق فقط، ولكنه فعّال على حد سواء في حال استخدامه قبل أو بعد الظهور على مجموعة واسعة جدًا من أنواع الحشائش عريضة الأوراق، ومنها: حشائش أبو طيلون ابن سينا، والسرمق الأبيض، والأريغارون الكندي، والداتورا الصفراوية، والأثمان الأرجواني، والرجلة، والخردل البري، والمغد الأسود، وحشيشة القزاز، والحسك الأرضي. ويستخدم منتج السافلوفيناسيل عادةً بمعدلات تطبيق تبلغ 0.1 رطل من المكون الفعال لكل فدان ويمكن استخدامه أيضًا لتجفيف المحاصيل قبل الحصاد.[7]
حددت هيئة الخدمة الجيولوجية الأمريكية مقدار الاستهلاك السنوي للسافلوفيناسيل في الزراعة الأمريكية بما يقرب من 500000 رطل (230.000 كيلوغرام) في عام 2017، والتي استخدمت بشكل رئيسي في محاصيل الذرة وفول الصويا.[10] حصل مركب السافلوفيناسيل أيضًا على الموافقة بالاستخدام في أستراليا، ولكن حتى الآن لم يحظة بالموافقة على الاستخدام والتداول في دول الاتحاد الأوروبي.
المراجع
- ^ "Compendium of Pesticide Common Names: saflufenacil". BCPC. مؤرشف من الأصل في 2022-01-24.
- ^ US patent 4746352, Wenger J. & Winternitz P., "3-(5-Carboxy-4-Substituted-Phenyl)-(thio) Uracil esters and salts", issued 1988-05-24, assigned to Hoffmann-La Roche Inc.
- ^ US patent 5183492, Suchy M.; Winternitz P. & Zeller M., "Herbicidal 3-aryluracils", issued 1993-02-02, assigned to Ciba-Geigy Ag
- ^ Pesticide Properties Database. "Butafenacil". University of Hertfordshire. مؤرشف من الأصل في 2021-05-15.
- ^ أ ب US patent 6534492, Carlsen M.; Guaciaro M. A. & Takasugi J. J., "Uracil substituted phenyl sulfamoyl carboxamides", issued 2003-03-18, assigned to BASF SE
- ^ Theodoridis، George (2016). "Carboxylic-Acid-Containing Protoporphyrinogen-IX-Oxidase-Inhibiting Herbicides". Bioactive Carboxylic Compound Classes: Pharmaceuticals and Agrochemicals. ص. 347–356. DOI:10.1002/9783527693931.ch26. ISBN:9783527339471.
- ^ أ ب ت BASF. "Sharpen: powered by Kixor herbicide" (PDF). www3.epa.gov. مؤرشف من الأصل (PDF) في 2022-05-25. اطلع عليه بتاريخ 2021-03-15.
- ^ Grossmann، Klaus؛ Niggeweg، Ricarda؛ Christiansen، Nicole؛ Looser، Ralf؛ Ehrhardt، Thomas (2010). "The Herbicide Saflufenacil (Kixor™) is a New Inhibitor of Protoporphyrinogen IX Oxidase Activity". Weed Science. ج. 58: 1–9. DOI:10.1614/WS-D-09-00004.1. S2CID:86227686.
- ^ "About Pesticide Registration". US EPA. مؤرشف من الأصل في 2022-05-20. اطلع عليه بتاريخ 2021-03-15.
- ^ US Geological Survey (18 يونيو 2020). "Estimated Agricultural Use for Saflufenacil, 2017". مؤرشف من الأصل في 2021-03-25. اطلع عليه بتاريخ 2021-03-16.