|
تضامنًا مع حق الشعب الفلسطيني |
حرارة الانصهار
حرارة الانصهار[1] أو إنثالبي الانصهار في الكيمياء (بالإنجليزية: Enthalpy of fusion) هي كمية الطاقة الحرارية اللازمة لتحويل مول واحد من مادة ما من الحالة الصلبة إلى الحالة السائلة أو العكس ، وتدعى درجة الحرارة التي تحدث عندها العملية بنقطة الانصهار.
لكي تتحول مادة من الحالة الصلبة إلى الحالة السائلة فهي تحتاج إلى امتصاص حرارة من الخارج لكي تفكك الروابط بين الجزيئات أو الذرات ، فخلال تلك العملية لا تكتسب الجزيئات طاقة حركة ولا ترتفع درجة حرارتها وإنما تحتاج إلى تلك الحرارة الخارجية والتي تسمى حرارة انصهار لمجرد تفكيك الروابط بين الجزيئات . وحدة حرارة الانصهار هي وحدة طاقة وهي الجول.
وحرارة الانصهار يمكن معرفتها من جداول خاصة تعطيها بوحدات : جول/مول أو جول/كيلوجرام من المادة .
إن المحتوى الحراري للانصهار للمادة ، والمعروف أيضًا باسم حرارة الانصهار (الكامنة) ، هو التغير في المحتوى الحراري الناتج عن توفير الطاقة ، عادة الحرارة ، إلى كمية محددة من المادة لتغيير حالتها من مادة صلبة إلى سائلة ، تحت ضغط مستمر. على سبيل المثال ، عند ذوبان 1 كجم من الجليد (عند 0 درجة مئوية تحت نطاق واسع من الضغوط) ، يتم امتصاص 333.55 كيلو جول من الطاقة دون تغيير في درجة الحرارة. حرارة التصلب (عندما تتغير المادة من السائل إلى الصلب) تكون مساوية ومعاكسة.
تتضمن هذه الطاقة المساهمة المطلوبة لإفساح المجال لأي تغيير مرتبط في الحجم من خلال إزاحة بيئتها ضد الضغط المحيط. درجة الحرارة التي يحدث فيها انتقال المرحلة هي نقطة الانصهار أو نقطة التجمد ، وفقًا للسياق. حسب الاصطلاح ، يُفترض أن يكون الضغط 1 ات (101.325 كيلو باسكال) ما لم ينص على خلاف ذلك.
حرارة انصهار بعض المواد
| المادة | حرارة الانصهار (ألف جول/كيلوجرام) | حرارة الانصهار (ألف جول/مول) |
|---|---|---|
| الألمونيوم | 398 | 10,7[2] |
| الرصاص | 23,4 | 4,85[3] |
| الكروم | 325 | 16,93[4] |
| الكادميوم | 55 | 6,2[5] |
| الكوبلت | 291,8 | 17,2[6] |
| النحاس | 210 | 13,3[7] |
| الصوديوم | 113 | 2,6[8] |
| الزئبق | 11,81 | 2,37[9] |
| السيليكون | 1803,7 | 50,66[10] |
| التنجستن | 191,3 | 35,2[11] |
| الزنك | 113 | 7,4[12] |
| القصدير | 59 | 7,03[13] |
التطبيقات
1) للحرارة كيلوغرام واحد (حوالي 1 لتر) من المياه من 283.15 إلى 303.15 K K (10 درجة مئوية إلى 30 درجة مئوية) يتطلب 83.6 كج. ومع ذلك، لإذابة الجليد ورفع درجة حرارة الماء الناتج بنسبة 20 K يتطلب طاقة اضافية. لتسخين الجليد من 273.15 K في الماء على 293.15 K (0 درجة مئوية إلى 20 درجة مئوية) ما يلي: (1) 333.55 J / ز (حرارة انصهار الجليد) = 333.55 كج / كلغ = 333،55 كيلو جول ل1 كيلوغرام من الجليد في الذوبان PLUS (2) 4.18 J / (ز · K) = 4.18 كيلوجول / (كغم · K) = 83.6 كج لل1kg من المياه لترتفع 20 K = 417.15 كج أو أن أكرر ذلك من حيث كل يوم، واحد في جزء الجليد 0 درجة مئوية ويبرد تقريبا بالضبط 4 أجزاء ماء عند 20 درجة مئوية إلى 0 درجة مئوية. 2) السيليكون لديه حرارة الانصهار 50.21 كيلو جول / مول. يمكن 50 كيلو واط من الكهرباء تزويد الطاقة اللازمة لإذابة حوالي 100 كلغ من السيليكون في ساعة واحدة، بعد أن يتم إحضارها إلى ذوبان نقطة درجة الحرارة: 50 كيلوواط = 50 كج / س = 180 000 كج / ساعة 180 000 كج / ساعة * (1 مول سي) / 50.21 كج * 28 ز سي / (مول سي) * 1 كجم سي / 1 000 غ سي = 100.4 كجم / ساعة
حرارة الانصهار والحرارة النوعية
في الجدول اعلاه نجد أن الماء على سبيل المثال يحتاج لامتصاص قدرا من الحرارة مقداره 333.000 جول/كيلوجرام لكي ينصهر الثلج ويتحول إلى ماء . وتبين المشاهدة أن تلك العملية من بدايتها إلى نهايتها تتم عند درجة الصفر المئوي وتبقى درجة الحرارة ثابتة عند الصفر المئوي حتى يتم تحول كل الثلج إلى ماء. عندئذ تبدأ الحرارة المكتسبة من الخارج في رفع درجة حرارة الماء الذي أصبح في حالة سائلة فترتفع أولا إلى 1 درجة مئوية . يحتاج الماء إلى نحو 4000 جول/كيلوجرام لترتفع درجة حرارته من 0 إلى 1 درجة مئوية . تلك الحرارة الخاصة بالماء تسمى حرارة نوعية وهي تختلف باختلاف درجة الحرارة ، فهي تصل إلى 4190 جول/كيلوجرام عند 20 درجة مئوية . ويلاحظ أن الفرق بين حرارة انصهار الماء أكبر بكثير عن «الحرارة النوعية للماء» فالنسبة بينهما تبلغ نحو 4/333 (انظر نقطة الغليان).
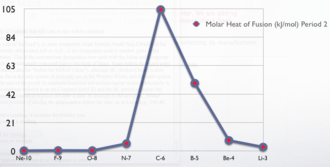
تغير حرارة الانصهار في الجدول الدوري

ملخص
- الحرارة الممتصة بواسطة كتلة وحدة من المادة الصلبة عند نقطة الانصهار من أجل تحويل المادة الصلبة إلى سائل في نفس درجة الحرارة
- حرارة الانصهار تساوي حرارة التصلب
المراجع
- ^ Q113378673، ص. 232، QID:Q113378673
- ^ W.B. Frank, W.E. Haupin, H. Vogt, M. Bruno, J Thonstad, R.K. Dawless, H. Kvande, O.A. Taiwo: Aluminium in Ullmann's Encyclopedia of Industrial Chemistry, 2009 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a01_459.pub2
- ^ C.A. Sutherland, E.F. Milner, R.C. Kerby, H. Teindl, A. Melin, H.M. Bolt: Lead in Ullmann's Encyclopedia of Industrial Chemistry, 2006 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a15_193.pub2
- ^ J.H. Downing, P.D. Deeley, R. Fichte: Chromium and Chromium Alloys in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a07 043.
- ^ K.-H. Schulte-Schrepping, M. Piscator: Cadmium and Cadmium Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a04_499.
- ^ J.D. Donaldson, D. Beyersmann: Cobalt and Cobalt Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a07_281.pub2.
- ^ A. Lossin: Copper in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a07_471.
- ^ A. Klemm, G. Hartmann, L. Lange: Sodium and Sodium Alloys in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a24 277
- ^ M. Simon, P. Jönk, G. Wühl-Couturier, S. Halbach: Mercury, Mercury Alloys, and Mercury Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2006 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a16 269.pub2
- ^ W. Zulehner, B. Neuer, G. Rau: Silicon in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a23_721
- ^ E. Lassner, W.-D. Schubert, E. Lüderitz, H.U. Wolf: Tungsten, Tungsten Alloys, and Tungsten Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a27_229
- ^ G.G. Graf: Zinc in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a28_509
- ^ G.G. Graf: Tin, Tin Alloys, and Tin Compounds in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a27_049
اقرأ أيضا
| حرارة الانصهار في المشاريع الشقيقة: | |
