بيركلورات الكلور
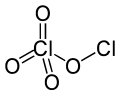
بيركلورات الكلور هو مركب كيميائي صيغته Cl2O4، ويوجد على شكل سائل أصفر مخضر. ينتمي هذا المركب إلى مجموعة البيركلورات وكذلك إلى أكاسيد الكلور.
| بيركلورات الكلور | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Chlorine perchlorate |
|
| تسمية الاتحاد الدولي للكيمياء | |
Chloro perchlorate[1] |
|
| أسماء أخرى | |
Chlorine perchlorate |
|
| الخواص | |
| الصيغة الجزيئية | Cl2O4 |
| الكتلة المولية | 134.90 غ/مول |
| المظهر | سائل أصفر مخضر |
| الكثافة | 1.81 غ/سم3 |
| نقطة الانصهار | −117 °س |
| نقطة الغليان | 44 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
التحضير
يمكن أن يحضر المركب من تفاعل بيركلورات السيزيوم مع كلوروفلورو الكبريتات:[2]
كما يمكن أن يكون ضمن نواتج ديمرة مركب ثنائي أكسيد الكلور بأثر من الأشعة فوق البنفسجية عند درجات حرارة منخفضة؛[3] وذلك عند طول موجة مقداره 436 نانومتر.[4][5]
الخواص
يوجد المركب على شكل سائل أصفر مخضر، وهو ضعيف الاستقرار إذ يتفكك إلى عنصري الكلور والأكسجين بالإضافة إلى سداسي أكسيد ثنائي الكلور Cl2O6:
الاستخدامات
يمكن أن يتفاعل مركب بيركلورات الكلور مع الكلوريدات الفلزية للحصول على البيركلورات اللامائية.
طالع أيضاً
مراجع
- ^ "Chloro Perchlorate - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information. مؤرشف من الأصل في 2012-10-22.
- ^ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 338
- ^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 496
- ^ A. J. Schell-Sorokin؛ D. S. Bethune؛ J. R. Lankard؛ M. M. T. Loy؛ P. P. Sorokin (1982). "Chlorine perchlorate a major photolysis product of chlorine dioxide". J. Phys. Chem. ج. 86 ع. 24: 4653–4655. DOI:10.1021/j100221a001.
- ^ M. I. Lopez؛ J. E. Sicre (1988). "Ultraviolet spectrum of chlorine perchlorate". J. Phys. Chem. ج. 92 ع. 2: 563–564. DOI:10.1021/j100313a062.
| بيركلورات الكلور في المشاريع الشقيقة: | |