|
تضامنًا مع حق الشعب الفلسطيني |
بطارية
| مدخرة | |
|---|---|
مجموعة مختلفة من المدخرات الكهربائية
| |
| النوع | منبع استطاعة |
| مبدأ العمل | القوة المحركة الكهربائية |
| إعداد الدبوس | قطبان، سالب وموجب. القطب الموجب هو القطب الأطول دائماً. |
| الرمز الإلكتروني | 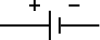 |
| تعديل مصدري - تعديل | |



البطارية أو الحاشدة[1] أو المُدَّخِرة الكهربائية هي جهاز يتكون من خلية كهروكيميائية واحدة أو أكثر مع توصيلات خارجية [2] لتشغيل الأجهزة الكهربائية مثل المصابيح الكهربائية والهواتف المحمولة والسيارات الكهربائية. عندما تقوم البطارية بتزويد الطاقة الكهربائية، يكون طرفها الموجب هو الكاثود والطرف السالب هو الأنود.[3] الطرف المحدد بالسالب هو مصدر الإلكترونات التي ستتدفق عبر دائرة كهربائية خارجية إلى الطرف الموجب. عندما يتم توصيل بطارية بحمل كهربائي خارجي، فإن تفاعل الأكسدة والاختزال يحول المواد المتفاعلة عالية الطاقة إلى منتجات منخفضة الطاقة، ويتم توصيل فرق الطاقة الحرة إلى الدائرة الخارجية كطاقة كهربائية.[4] تاريخيًا، يشير مصطلح «البطارية» تحديدًا إلى جهاز مكون من عدة خلايا، ولكن تطور الاستخدام ليشمل أجهزة مكونة من خلية واحدة.[5]
تُستخدم البطاريات الأولية (التي تُستخدم مرة واحدة أو «التي تستخدم لمرة واحدة») مرة واحدة ويتم التخلص منها، حيث يتم تغيير مواد القطب بشكل لا رجعة فيه أثناء التفريغ؛ ومن الأمثلة الشائعة على ذلك البطارية القلوية المستخدمة في المصابيح الكهربائية وعدد كبير من الأجهزة الإلكترونية المحمولة. يمكن تفريغ البطاريات الثانوية (القابلة لإعادة الشحن) وإعادة شحنها عدة مرات باستخدام التيار الكهربائي المطبق؛ يمكن استعادة التكوين الأصلي للأقطاب الكهربائية عن طريق التيار العكسي. تشمل الأمثلة بطاريات الرصاص الحمضية المستخدمة في المركبات وبطاريات الليثيوم أيون المستخدمة في الأجهزة الإلكترونية المحمولة مثل الحواسيب المحمولة والهواتف المحمولة.
تأتي البطاريات بأشكال وأحجام عديدة، من الخلايا المصغرة المستخدمة لتشغيل المعينات السمعية وساعات اليد إلى الخلايا الصغيرة الرقيقة المستخدمة في الهواتف الذكية، إلى بطاريات الرصاص الحمضية الكبيرة أو بطاريات الليثيوم أيون في المركبات، وفي أقصى الحالات، توجد بطاريات ضخمة للبطاريات حجم الغرف التي توفر الطاقة الاحتياطية أو الطوارئ لمبادلات الهاتف ومراكز بيانات الحاسوب.
تحتوي البطاريات على طاقة نوعية أقل بكثير (طاقة لكل وحدة كتلة) من أنواع الوقود الشائعة مثل البنزين. في السيارات، يتم تعويض هذا إلى حد ما من خلال الكفاءة العالمية و تكنولوجية العالية للمحركات الكهربائية في تحويل الطاقة الكهربائية إلى عمل ميكانيكي، مقارنة بمحركات الاحتراق. منذ ما يزيد على 2500 سنة مضت، تمكن العالم الإغریقی «طاليس» (نحو 624 - نحو 546 ق.م) من إنتاج ومضات كهربائية بسيطة عن طريق حك قطعة من القماش بالكهرمان، وهو راتينج أصفر يتكون من عصارة الأشجار الميتة منذ فترات زمنية طويلة. لكن الأمر استغرق فترة طويلة من الوقت قبل أن يتمكن الإنسان من تسخير هذه القوة لإنتاج البطاريات الكهربائية، وبالتالي إنتاج تيار ثابت من الكهرباء. إلا أن عالم الآثار فيلهلم كونج (Wilhelm König) ayman )والذي شغل منصب مشرف المتحف العراقي كان قد أشار في سنة 1940 إلى أن جرة فخارية محفوظة بالمتحف قد تكون أول بطارية معروفة في التاريخ فيما صار يعرف ببطارية بغداد [6][7]
التاريخ
يعود استخدام مصطلح «البطارية» لوصف مجموعة من الأجهزة الكهربائية إلى بنجامين فرانكلين، الذي وصف في عام 1748 عدة جرار ليدن على غرار بطارية المدفع [8] (استعار بنجامين فرانكلين مصطلح «البطارية» من الجيش، والذي يشير إلى للأسلحة تعمل معا [9]).
أول بطارية كهربائية في التاريخ
قام الفيزيائي الإيطالي أليساندرو فولتا ببناء ووصف أول بطارية كهروكيميائية، الكومة الفولتية، في عام 1800.[10] كانت هذه كومة من ألواح النحاس والزنك، مفصولة بأقراص ورقية مبللة بمحلول ملحي، والتي يمكن أن تنتج تيارًا ثابتًا لفترة طويلة من الزمن. لم يفهم فولتا أن الجهد كان بسبب تفاعلات كيميائية. كان يعتقد أن خلاياه كانت مصدرًا لا ينضب للطاقة، [11] وأن آثار التآكل المرتبطة بها في الأقطاب الكهربائية كانت مجرد إزعاج، وليست نتيجة حتمية لعملها، كما أوضح مايكل فاراداي في عام 1834.[12]
نشر ألساندرو فولتا (1745-1827م) التفاصيل الخاصة بأول بطارية كهربائية في التاريخ. وقد كانت البطارية الكهربائية التي اخترعها فولتا تنتج الكهرباء عن طريق التفاعل الكيميائي بين بعض المحاليل المعينة والأقطاب الكهربائية المعدنية (الإلكترودات). جدير بالذكر أن بعض العلماء الآخرين، مثل جون فردريك دانييل (1790 - 1845م) قد طور تصمیم فولتا عن طريق استخدام مواد مختلفة في الأقطاب الكهربائية. كما أن البطاريات الكهربائية المستخدمة اليوم تتبع التصميم الأساسي نفسه ولكن مع استخدام مواد حديثة.
كانت البطارية الكهربائية التي اخترعها فولتا تتكون من أقراص من الزنك والفضة أو النحاس يتم الفصل بينهما عن طريق فواصل مبتلة بحمض مخفف أو محلول ملحي كانت الكهرباء تتدفق خلال سلك يربط بين القرصين العلوي والسفلى. الجدير بالذكر هنا أن الفولت، وهو وحدة كهربائية. تمت تسميته على اسم ألساندرو فولتا.
على الرغم من أن البطاريات المبكرة كانت ذات قيمة كبيرة للأغراض التجريبية، إلا أن الفولتية في الواقع كانت متذبذبة ولم تستطع توفير تيار كبير لفترة مستدامة. كانت خلية دانييل، التي اخترعها الكيميائي البريطاني جون فريدريك دانييل في عام 1836، أول مصدر عملي للكهرباء، وأصبحت معيارًا صناعيًا وشهدت اعتمادًا واسع النطاق كمصدر للطاقة لشبكات التلغراف الكهربائية.[13] وتتكون من وعاء نحاسي مملوء بمحلول كبريتات النحاس، والذي كان مغمورًا فيه وعاء خزفي غير مطلي بحمض الكبريتيك وقطب كهربائي من الزنك.[14]
تستخدم هذه الخلايا الرطبة الشوارد السائلة، والتي تكون عرضة للتسرب والانسكاب إذا لم يتم التعامل معها بشكل صحيح. استخدم العديد من الأواني الزجاجية لحمل مكوناتها، مما جعلها هشة ومن المحتمل أن تكون خطرة. جعلت هذه الخصائص الخلايا الرطبة غير مناسبة للأجهزة المحمولة. قرب نهاية القرن التاسع عشر، جعل اختراع بطاريات الخلايا الجافة، التي حلت محل الإلكتروليت السائل معجون، الأجهزة الكهربائية المحمولة عملية.[15]
بداية التطوير في بطارية فولتا
تبع ذلك طريقة أخرى كان يتم فيها توصيل الكثير من الخلايا معاً حيث كانت كل خلية منها تتكون من زوجين من الأقطاب الكهربائية المصنوعة من معادن مختلفة وذلك لإنتاج قدر أكبر من الجهد الكهربى (الفولت)، وبالتالي تیار كهربائي بكمية أكبر. وتتكون الخلية «الفولتية» الشهيرة من أقطاب كهربائية مصنوعة من النحاس والزنك مغموسة في حمض مخفف. وقد تمكن المخترع الإنجليزي «کروکشانك» من اختراع بطارية «الحوض» الكهربائية هذه في عام 1800م.
وقد كان يتم لحم الألواح المعدنية بحيث يكون ظهر كل منها للآخر، ثم يتم تثبيتها بالإسمنت في فتحات صغيرة ضيقة في صندوق خشبي، ثم يملأ الصندوق بعد ذلك بحمض مخفف أو محلول من كلوريد الأمونيوم.
مبدأ التشغيل
تقوم البطاريات بتحويل الطاقة الكيميائية مباشرة إلى طاقة كهربائية. في كثير من الحالات، تكون الطاقة الكهربائية المنبعثة هي الاختلاف في طاقة التماسك [16] أو طاقات الرابطة للمعادن أو الأكاسيد أو الجزيئات التي تخضع للتفاعل الكهروكيميائي.[4] على سبيل المثال، يمكن تخزين الطاقة في Zn أو Li، وهي معادن عالية الطاقة لأنها غير مستقرة عن طريق الترابط الإلكترون D، على عكس المعادن الانتقالية. تم تصميم البطاريات بحيث لا يمكن أن يحدث تفاعل الأكسدة والاختزال المناسب بقوة إلا إذا تحركت الإلكترونات عبر الجزء الخارجي من الدائرة.
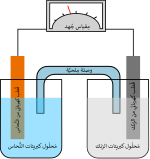
تتكون البطارية من عدد من الخلايا الفولتية. تتكون كل خلية من خليتين نصفيتين متصلتين في سلسلة بواسطة إلكتروليت موصل يحتوي على كاتيونات معدنية. تشتمل نصف الخلية على إلكتروليت وإلكترود سالب، وهو القطب الذي تهاجر إليه الأنيونات (أيونات سالبة الشحنة)؛ تشتمل نصف الخلية الأخرى على الإلكتروليت والقطب الموجب، حيث تهاجر إليها الكاتيونات (أيونات موجبة الشحنة). يتم تقليل الكاتيونات (تُضاف الإلكترونات) عند الكاثود، بينما تتأكسد ذرات المعدن (تُزال الإلكترونات) عند القطب الموجب.[17] تستخدم بعض الخلايا إلكتروليتات مختلفة لكل نصف خلية؛ ثم يتم استخدام فاصل لمنع اختلاط الإلكتروليت مع السماح للأيونات بالتدفق بين أنصاف الخلايا لإكمال الدائرة الكهربائية.
كل نصف خلية لها قوة دافعة كهربائية (emf، تقاس بالفولت) بالنسبة للمعيار. صافي emf للخلية هو الفرق بين emfs لخلايا نصفها.[18] وهكذا، إذا كانت الأقطاب الكهربائية لديها emfs و ، ثم صافي emf هو ؛ وبعبارة أخرى، فإن صافي emf هو الفرق بين إمكانات الاختزال لنصف التفاعلات.[19]
القوة الدافعة الكهربائية أو يُعرف عبر أطراف الخلية بالجهد الطرفي (الفرق) ويقاس بالفولت.[20] يُطلق على الجهد الطرفي لخلية لا تشحن ولا تفريغ جهد الدائرة المفتوحة ويساوي emf للخلية. بسبب المقاومة الداخلية، [21] الجهد الطرفي للخلية التي يتم تفريغها يكون أصغر في الحجم من جهد الدائرة المفتوحة والجهد النهائي للخلية التي يتم شحنها يتجاوز جهد الدائرة المفتوحة.[22] تتمتع الخلية المثالية بمقاومة داخلية ضئيلة، لذا فهي تحافظ على جهد طرفي ثابت حتى ينفد، ثم ينخفض إلى الصفر. إذا حافظت هذه الخلية على 1.5 فولت وأنتجت شحنة مقدارها كولوم واحد، فعند التفريغ الكامل، كانت ستؤدي 1.5 جول من العمل.[20] في الخلايا الفعلية، تزداد المقاومة الداخلية تحت التفريغ [21] وينخفض جهد الدائرة المفتوحة أيضًا تحت التفريغ. إذا تم رسم الجهد والمقاومة مقابل الوقت، فعادة ما تكون الرسوم البيانية الناتجة منحنى؛ يختلف شكل المنحنى وفقًا للكيمياء والترتيب الداخلي المستخدم.
يعتمد الجهد المتطور عبر أطراف الخلية على إطلاق الطاقة للتفاعلات الكيميائية للأقطاب الكهربائية والإلكتروليت. تمتلك الخلايا القلوية والزنك-الكربون مواد كيميائية مختلفة، ولكن تقريبًا نفس emf البالغ 1.5 فولت؛ وبالمثل، فإن خلايا NiCd وNiMH لها كيميائية مختلفة، ولكن تقريبًا نفس emf البالغ 1.2 فولت.[23] التغييرات المحتملة الكهروكيميائية عالية في ردود الفعل من الليثيوم المركبات تعطي خلايا الليثيوم emfs من 3 فولت أو أكثر.[24]
فئات وأنواع البطاريات
يتم تصنيف البطاريات إلى أشكال أولية وثانوية:
- تم تصميم البطاريات الأولية لاستخدامها حتى نفاد الطاقة ثم التخلص منها. لا يمكن عكس تفاعلاتها الكيميائية بشكل عام، لذا لا يمكن إعادة شحنها. عندما يتم استنفاد إمدادات المواد المتفاعلة في البطارية، تتوقف البطارية عن إنتاج التيار وتكون عديمة الفائدة.[25]
- يمكن إعادة شحن البطاريات الثانوية ؛ أي أنه يمكن عكس تفاعلاتها الكيميائية عن طريق تطبيق تيار كهربائي على الخلية. يؤدي ذلك إلى تجديد المواد الكيميائية المتفاعلة الأصلية، بحيث يمكن استخدامها وإعادة شحنها واستخدامها مرة أخرى عدة مرات.[26]
تمت استعادة بعض أنواع البطاريات الأولية المستخدمة، على سبيل المثال، لدوائر التلغراف، للعمل عن طريق استبدال الأقطاب الكهربائية.[27] البطاريات الثانوية غير قابلة لإعادة الشحن إلى أجل غير مسمى بسبب تشتت المواد النشطة وفقدان الإلكتروليت والتآكل الداخلي.
ابتدائي
يمكن أن تنتج البطاريات الأولية أو الخلايا الأولية تيارًا فور التجميع. يتم استخدامها بشكل شائع في الأجهزة المحمولة ذات استنزاف تيار منخفض، أو يتم استخدامها بشكل متقطع فقط، أو يتم استخدامها بعيدًا عن مصدر طاقة بديل، كما هو الحال في دوائر الإنذار والاتصالات حيث لا تتوفر الطاقة الكهربائية الأخرى إلا بشكل متقطع. لا يمكن إعادة شحن الخلايا الأولية التي يمكن التخلص منها بشكل موثوق، نظرًا لأن التفاعلات الكيميائية لا يمكن عكسها بسهولة وقد لا تعود المواد الفعالة إلى أشكالها الأصلية. يوصي مصنعو البطاريات بعدم محاولة إعادة شحن الخلايا الأولية.[28] بشكل عام، تتمتع هذه البطاريات بكثافة طاقة أعلى من البطاريات القابلة لإعادة الشحن، [29] ولكن البطاريات التي تستخدم لمرة واحدة لا تعمل جيدًا في التطبيقات عالية الاستنزاف مع أحمال أقل من 75 أوم (75). تشمل الأنواع الشائعة للبطاريات التي تستخدم لمرة واحدة بطاريات الزنك والكربون والبطاريات القلوية.
ثانوي
يجب شحن البطاريات الثانوية، المعروفة أيضًا باسم الخلايا الثانوية، أو البطاريات القابلة لإعادة الشحن، قبل الاستخدام الأول؛ عادة ما يتم تجميعها بمواد فعالة في حالة التفريغ. يتم (إعادة) شحن البطاريات القابلة لإعادة الشحن عن طريق تطبيق تيار كهربائي، مما يعكس التفاعلات الكيميائية التي تحدث أثناء التفريغ / الاستخدام. تسمى الأجهزة التي توفر التيار المناسب أجهزة الشحن.
أقدم شكل من أشكال البطاريات القابلة لإعادة الشحن هو بطارية الرصاص الحمضية، والتي تستخدم على نطاق واسع في تطبيقات السيارات والقوارب. تحتوي هذه التقنية على سائل إلكتروليت في حاوية غير محكمة الإغلاق، مما يتطلب إبقاء البطارية في وضع مستقيم وأن تكون المنطقة جيدة التهوية لضمان التوزيع الآمن لغاز الهيدروجين الذي ينتج أثناء الشحن الزائد. تعتبر بطارية الرصاص الحمضية ثقيلة نسبيًا بالنسبة لكمية الطاقة الكهربائية التي يمكنها توفيرها. إن تكلفة التصنيع المنخفضة ومستويات الارتفاع الحالية العالية تجعلها شائعة حيث تكون سعتها (أكثر من 10 آه تقريبًا) أكثر أهمية من مشكلات الوزن والمعالجة. أحد التطبيقات الشائعة هو بطارية السيارة الحديثة، والتي يمكنها بشكل عام توفير تيار ذروة يبلغ 450 أمبير.
تحظى بطارية الرصاص الحمضية المنظمة بصمام مختوم (بطارية VRLA) بشعبية في صناعة السيارات كبديل للخلية الرطبة الحمضية والرصاصية. تستخدم بطارية VRLA إلكتروليت حامض الكبريتيك ثابتًا، مما يقلل من فرصة التسرب ويطيل العمر الافتراضي.[30] تعمل بطاريات VRLA على تجميد الإلكتروليت. النوعان هما:
- تستخدم بطاريات الهلام (أو «خلية هلامية») إلكتروليت شبه صلب.
- تمتص البطاريات الزجاجية الماصة (AGM) المنحل بالكهرباء في حصير من الألياف الزجاجية خاص.
تشتمل البطاريات القابلة لإعادة الشحن المحمولة الأخرى على عدة أنواع من «الخلايا الجافة» محكمة الغلق، والتي تفيد في التطبيقات مثل الهواتف المحمولة وأجهزة الكمبيوتر المحمولة. تشمل الخلايا من هذا النوع (بترتيب زيادة كثافة الطاقة والتكلفة) خلايا النيكل والكادميوم (NiCd) والنيكل والزنك (NiZn) وهيدريد معدن النيكل (NiMH) وخلايا أيون الليثيوم (Li-ion). تتمتع Li-ion بأعلى حصة من سوق الخلايا الجافة القابلة لإعادة الشحن. لقد حلت NiMH محل NiCd في معظم التطبيقات نظرًا لقدرتها العالية، لكن NiCd لا يزال قيد الاستخدام في أدوات الطاقة وأجهزة الراديو ثنائية الاتجاه والمعدات الطبية.
في العقد الأول من القرن الحادي والعشرين، تضمنت التطورات بطاريات مزودة بإلكترونيات مدمجة مثل USBCELL، والتي تسمح بشحن بطارية AA من خلال موصل USB، [31] بطاريات نانوبال التي تسمح بمعدل تفريغ أكبر بحوالي 100 مرة من البطاريات الحالية، وحزم البطاريات الذكية بالحالة- شاشات الشحن ودوائر حماية البطارية التي تمنع التلف الناتج عن التفريغ الزائد. يسمح انخفاض التفريغ الذاتي (LSD) بشحن الخلايا الثانوية قبل الشحن.
أنواع الخلايا
تم إنتاج أنواع عديدة من الخلايا الكهروكيميائية، مع عمليات وتصميمات كيميائية مختلفة، بما في ذلك الخلايا الجلفانية، والخلايا الكهربية، وخلايا الوقود، وخلايا التدفق والأكوام الفولتية.[32]
الخلية الرطبة
تحتوي بطارية الخلية الرطبة على سائل إلكتروليت. الأسماء الأخرى هي الخلية المغمورة، حيث يغطي السائل جميع الأجزاء الداخلية أو الخلية ذات التهوية، حيث يمكن للغازات الناتجة أثناء التشغيل أن تتسرب إلى الهواء. كانت الخلايا الرطبة مقدمة للخلايا الجافة وتستخدم عادة كأداة تعليمية للكيمياء الكهربائية. يمكن بناؤها باستخدام المستلزمات المختبرية الشائعة، مثل الأكواب، لإظهار كيفية عمل الخلايا الكهروكيميائية. يعتبر نوع معين من الخلايا الرطبة يعرف باسم خلية التركيز مهمًا في فهم التآكل. قد تكون الخلايا الرطبة خلايا أولية (غير قابلة لإعادة الشحن) أو خلايا ثانوية (قابلة لإعادة الشحن). في الأصل، تم بناء جميع البطاريات الأولية العملية مثل خلية دانييل كخلايا رطبة لوعاء زجاجي مفتوح. الخلايا الرطبة الأولية الأخرى هي خلية ليكلانش، وخلية خلية غروف، وخلية خلية بنزن، وخلية خلية حمض الكروميك، وخلية كلارك، وخلية ويستون. تم تكييف كيمياء خلية ليكلانش مع الخلايا الجافة الأولى. لا تزال الخلايا الرطبة تستخدم في بطاريات السيارات وفي الصناعة للحصول على الطاقة الاحتياطية للمفاتيح الكهربائية أو الاتصالات السلكية واللاسلكية أو إمدادات الطاقة الكبيرة غير المنقطعة، ولكن في كثير من الأماكن تم استخدام البطاريات ذات الخلايا الهلامية بدلاً من ذلك. تستخدم هذه التطبيقات بشكل شائع خلايا حمض الرصاص أو النيكل والكادميوم.
خلية جافة


تستخدم الخلية الجافة معجونًا بالكهرباء، مع رطوبة كافية فقط للسماح للتيار بالتدفق. على عكس الخلية الرطبة، يمكن أن تعمل الخلية الجافة في أي اتجاه دون انسكاب، حيث لا تحتوي على سائل حر، مما يجعلها مناسبة للأجهزة المحمولة. وبالمقارنة، كانت الخلايا المبللة الأولى حاويات زجاجية هشة مع قضبان من الرصاص معلقة من الأعلى وتحتاج إلى معالجة دقيقة لتجنب الانسكاب. لم تحقق بطاريات الرصاص الحمضية سلامة الخلية الجافة وقابليتها للنقل حتى تطوير بطارية الهلام.
الخلية الجافة الشائعة هي بطارية الزنك والكربون، والتي تسمى أحيانًا خلية ليكلانش الجافة، بجهد اسمي يبلغ 1.5 فولت، مثل البطارية القلوية (حيث يستخدم كلاهما نفس تركيبة ثاني أكسيد الزنك والمنغنيز). تتكون الخلية الجافة القياسية من أنود الزنك، عادة في شكل وعاء أسطواني، مع كاثود كربون على شكل قضيب مركزي. المنحل بالكهرباء هو كلوريد الأمونيوم على شكل معجون بجوار أنود الزنك. يتم أخذ المساحة المتبقية بين المنحل بالكهرباء وكاثود الكربون بواسطة عجينة ثانية تتكون من كلوريد الأمونيوم وثاني أكسيد المنغنيز، وتعمل الأخيرة كمزيل للاستقطاب. في بعض التصميمات، يتم استبدال كلوريد الأمونيوم بكلوريد الزنك.
ملح مذاب
بطاريات الملح المصهور هي بطاريات أولية أو ثانوية تستخدم الملح المصهور كإلكتروليت. تعمل في درجات حرارة عالية ويجب عزلها جيدًا للاحتفاظ بالحرارة.
الاحتياطي
يمكن تخزين البطارية الاحتياطية غير مفككة (غير نشطة ولا توفر طاقة) لفترة طويلة (ربما سنوات). عند الحاجة إلى البطارية، يتم تجميعها (على سبيل المثال، بإضافة المنحل بالكهرباء)؛ بمجرد تجميعها، يتم شحن البطارية وجاهزة للعمل. على سبيل المثال، قد يتم تنشيط بطارية لصمام مدفعي إلكتروني من خلال تأثير إطلاق النار من مسدس. يكسر التسارع كبسولة من الإلكتروليت التي تنشط البطارية وتزود دارات الصمامات بالطاقة. عادة ما يتم تصميم البطاريات الاحتياطية لفترة خدمة قصيرة (ثوانٍ أو دقائق) بعد التخزين الطويل (سنوات). يتم تنشيط بطارية تعمل بالماء للأجهزة الأوقيانوغرافية أو التطبيقات العسكرية عند الغمر في الماء.
أداء الخلية
قد تختلف خصائص البطارية على مدار دورة التحميل ودورة الشحن الزائدة والعمر الافتراضي بسبب العديد من العوامل بما في ذلك الكيمياء الداخلية واستنزاف التيار ودرجة الحرارة. في درجات الحرارة المنخفضة، لا يمكن للبطارية توفير نفس القدر من الطاقة. على هذا النحو، في المناخات الباردة، يقوم بعض مالكي السيارات بتركيب أجهزة تدفئة للبطارية، وهي عبارة عن وسادات تدفئة كهربائية صغيرة تحافظ على تدفئة بطارية السيارة.
القدرة والتفريغ

سعة البطارية هي مقدار الشحنة الكهربائية التي يمكن أن تقدمها بالجهد المقدر. كلما زادت مادة القطب الموجودة في الخلية زادت قدرتها. تتمتع الخلية الصغيرة بسعة أقل من خلية أكبر لها نفس الكيمياء، على الرغم من أنها تطور نفس جهد الدائرة المفتوحة.[33] يتم قياس السعة بوحدات مثل أمبير ساعة (A · h). عادة ما يتم التعبير عن السعة المقدرة للبطارية على أنها ناتج 20 ساعة مضروبة في التيار الذي يمكن أن توفره بطارية جديدة باستمرار لمدة 20 ساعة عند 68 °ف (20 °م)، بينما تظل أعلى من جهد طرفي محدد لكل خلية. على سبيل المثال، يمكن لبطارية مصنفة عند 100 أمبير في الساعة توصيل 5 أمبير خلال فترة 20 ساعة في درجة حرارة الغرفة. يعتمد جزء الشحنة المخزنة التي يمكن أن توفرها البطارية على عوامل متعددة، بما في ذلك كيمياء البطارية، ومعدل توصيل الشحنة (التيار)، والجهد الطرفي المطلوب، وفترة التخزين، ودرجة الحرارة المحيطة وعوامل أخرى.[33]
كلما زاد معدل التفريغ، انخفضت السعة.[34] العلاقة بين التيار ووقت التفريغ والسعة لبطارية الرصاص الحمضية تقريبية (على مدى نموذجي للقيم الحالية) بموجب قانون بيوكيرت :
حيث
- هي السعة عند التفريغ بمعدل 1 أمبير.
- هو التيار المأخوذ من البطارية (A).
- هو مقدار الوقت (بالساعات) الذي يمكن أن تتحمله البطارية.
- ثابت حول 1.3.
البطاريات التي يتم تخزينها لفترة طويلة أو التي يتم تفريغها بجزء صغير من السعة تفقد قدرتها بسبب وجود تفاعلات جانبية لا رجعة فيها بشكل عام تستهلك ناقلات الشحن دون إنتاج تيار. تُعرف هذه الظاهرة باسم التفريغ الذاتي الداخلي. علاوة على ذلك، عند إعادة شحن البطاريات، يمكن أن تحدث تفاعلات جانبية إضافية، مما يقلل من القدرة على التفريغ اللاحق. بعد عمليات إعادة الشحن الكافية، تُفقد كل السعة بشكل أساسي وتتوقف البطارية عن إنتاج الطاقة.
يؤدي فقدان الطاقة الداخلي والقيود المفروضة على معدل مرور الأيونات عبر الإلكتروليت إلى اختلاف كفاءة البطارية. فوق الحد الأدنى، يوفر التفريغ بمعدل منخفض سعة أكبر للبطارية مقارنة بالمعدل الأعلى. لا يؤثر تركيب البطاريات ذات التصنيفات A · h المتفاوتة على تشغيل الجهاز (على الرغم من أنه قد يؤثر على الفاصل الزمني للتشغيل) المصنف لجهد معين ما لم يتم تجاوز حدود الحمل. يمكن للأحمال عالية الاستنزاف مثل الكاميرات الرقمية أن تقلل السعة الإجمالية، كما يحدث مع البطاريات القلوية. على سبيل المثال، بطارية مصنفة عند 2 A · h لتفريغ لمدة 10 أو 20 ساعة لن يحافظ على تيار 1 أ لمدة ساعتين كاملتين كما تدل سعتها المعلنة.
معدل C
معدل C هو مقياس لمعدل شحن البطارية أو تفريغها. يتم تعريفه على أنه التيار عبر البطارية مقسومًا على السحب الحالي النظري والذي بموجبه ستوفر البطارية قدرتها الاسمية المقدرة في ساعة واحدة.[35] لديها الوحدات h −1 .
بسبب فقدان المقاومة الداخلية والعمليات الكيميائية داخل الخلايا، نادرًا ما توفر البطارية القدرة المقدرة للوحة الاسم في ساعة واحدة فقط.
عادةً ما يتم العثور على السعة القصوى بمعدل C منخفض، كما أن الشحن أو التفريغ بمعدل C أعلى يقلل من عمر البطارية وسعة استخدامها. غالبًا ما ينشر المصنعون أوراق بيانات تحتوي على رسوم بيانية توضح السعة مقابل منحنيات معدل C. يستخدم معدل C أيضًا كتقييم للبطاريات للإشارة إلى الحد الأقصى للتيار الذي يمكن للبطارية توصيله بأمان في الدائرة. تعمل معايير البطاريات القابلة لإعادة الشحن بشكل عام على تقييم السعة ودورات الشحن على مدى 4 ساعات (0.25 درجة مئوية) أو 8 ساعات (0.125 درجة مئوية) أو وقت تفريغ أطول. يمكن تصنيف الأنواع المخصصة لأغراض خاصة، مثل مصدر الطاقة غير المنقطع للكمبيوتر، من قبل الشركات المصنعة لفترات التفريغ التي تقل كثيرًا عن ساعة واحدة (1C) ولكنها قد تعاني من دورة حياة محدودة.
بطاريات سريعة الشحن وكبيرة وخفيفة الوزن
اعتبارا من عام 2012، فوسفات الحديد الليثيوم (LiFePO 4) كانت تقنية البطارية هي الأسرع في الشحن / التفريغ، حيث تم تفريغها بالكامل في 10-20 ثانية.[36]
اعتبارًا من عام 2017، تم تصنيع أكبر بطارية في العالم في جنوب أستراليا بواسطة تيسلا. يمكنها تخزين 129 ميجاوات في الساعة. تم تصنيع بطارية في مقاطعة خبي بالصين يمكنها تخزين 36 ميجاوات ساعة من الكهرباء في عام 2013 بتكلفة 500 مليون دولار. توجد بطارية كبيرة أخرى تتكون من خلايا Ni–Cd في فيربانكس بولاية ألاسكا، بحيث كانت تغطي 2000 متر مربع (22000 قدم مربع) - أكبر من ملعب كرة القدم - ووزنها 1300 طن. تم تصنيعه من قبل ABB لتوفير طاقة احتياطية في حالة انقطاع التيار الكهربائي. يمكن أن توفر البطارية 40 ميغاواط من الطاقة لمدة تصل إلى سبع دقائق. تم استخدام بطاريات الصوديوم والكبريت لتخزين طاقة الرياح. يعمل نظام بطارية 4.4 ميجاوات في الساعة والذي يمكنه توفير 11 ميجاوات لمدة 25 دقيقة على استقرار إنتاج مزرعة الرياح آوهي في هاواي.[37][38][39][40][41]
تم استخدام بطاريات الليثيوم والكبريت في أطول وأعلى رحلة تعمل بالطاقة الشمسية.[42]
أوقات الحياة
عمر البطارية (وعمرها المرادف للبطارية) له معنيان للبطاريات القابلة لإعادة الشحن ولكن واحد فقط للبطاريات غير القابلة للشحن. بالنسبة لعمليات إعادة الشحن، يمكن أن يعني ذلك إما طول الفترة الزمنية التي يمكن للجهاز أن يعمل فيها على بطارية مشحونة بالكامل أو عدد دورات الشحن / التفريغ الممكنة قبل أن تفشل الخلايا في العمل بشكل مرض. بالنسبة إلى غير القابلة لإعادة الشحن، فإن هاتين العمليتين متساويتان لأن الخلايا تدوم لدورة واحدة فقط بحكم التعريف. (يُستخدم مصطلح الصلاحية لوصف المدة التي ستحتفظ فيها البطارية بأدائها بين التصنيع والاستخدام.) تنخفض السعة المتاحة لجميع البطاريات مع انخفاض درجة الحرارة. على عكس معظم بطاريات اليوم، توفر بطارية زامبوني، التي تم اختراعها في عام 1812، عمر خدمة طويل جدًا دون تجديد أو إعادة شحن، على الرغم من أنها توفر التيار فقط في نطاق nanoamp. كان أكسفورد إلكتريك بيل يرن بشكل مستمر تقريبًا منذ عام 1840 على زوج البطاريات الأصلي، الذي يُعتقد أنه أكوام زامبوني.
التفريغ الذاتي
تفقد البطاريات التي تستخدم لمرة واحدة عادةً ما بين 8 إلى 20 بالمائة من شحنتها الأصلية سنويًا عند تخزينها في درجة حرارة الغرفة (20-30 درجة مئوية).[43] يُعرف هذا بمعدل «التفريغ الذاتي»، ويرجع ذلك إلى التفاعلات الكيميائية «الجانبية» غير المنتجة للتيار والتي تحدث داخل الخلية حتى في حالة عدم وجود حمل. يتم تقليل معدل التفاعلات الجانبية للبطاريات المخزنة في درجات حرارة منخفضة، على الرغم من أن بعضها يمكن أن يتلف بسبب التجميد.
البطاريات القديمة القابلة لإعادة الشحن تفريغ التفريغ الذاتي بسرعة أكبر من البطاريات القلوية التي تستخدم لمرة واحدة، وخاصة البطاريات القائمة على النيكل ؛ تفقد بطارية النيكل والكادميوم (NiCd) المشحونة حديثًا 10٪ من شحنتها في أول 24 ساعة، وبعد ذلك يتم تفريغها بمعدل 10٪ تقريبًا شهريًا. ومع ذلك، فإن بطاريات هيدريد معدن النيكل الأحدث منخفضة التفريغ الذاتي وتصميمات الليثيوم الحديثة تعرض معدل تفريغ ذاتي أقل (ولكن لا يزال أعلى من البطاريات الأولية).
تآكل
قد تتآكل الأجزاء الداخلية وتفشل، أو قد تتحول المواد النشطة ببطء إلى أشكال غير نشطة.
يتغير المكون المادي
تغير المادة النشطة الموجودة على لوحات البطارية التركيب الكيميائي في كل دورة شحن وتفريغ ؛ قد تفقد المادة النشطة بسبب التغيرات المادية في الحجم، مما يحد من عدد المرات التي يمكن فيها إعادة شحن البطارية. يتم تفريغ شحن معظم البطاريات القائمة على النيكل جزئيًا عند شرائها، ويجب شحنها قبل استخدامها لأول مرة.[44] تعد بطاريات NiMH الأحدث جاهزة للاستخدام عند شرائها، ولا يتجاوز تفريغها سوى 15٪ في السنة.[45]
يحدث بعض التدهور في كل دورة شحن وتفريغ. يحدث التحلل عادة بسبب انتقال الإلكتروليت بعيدًا عن الأقطاب الكهربائية أو بسبب انفصال المادة الفعالة عن الأقطاب الكهربائية. بطاريات NiMH منخفضة السعة (1700-2000 مللي أمبير ساعة) يمكن شحنها حوالي 1000 مرة، في حين أن بطاريات NiMH عالية السعة (أعلى من 2500 mA · h) تدوم حوالي 500 دورة.[46] تميل بطاريات NiCd إلى تصنيفها لمدة 1000 دورة قبل أن تزيد مقاومتها الداخلية بشكل دائم عن القيم القابلة للاستخدام.
سرعة الشحن / التفريغ
يزيد الشحن السريع من تغييرات المكونات ويقصر عمر البطارية.[46]
زيادة الشحن
إذا تعذر على الشاحن اكتشاف وقت شحن البطارية بالكامل، فمن المحتمل أن يؤدي الشحن الزائد إلى إتلافها.[47]
تأثير الذاكرة
قد تظهر خلايا NiCd، إذا تم استخدامها بطريقة متكررة معينة، انخفاضًا في السعة يسمى «تأثير الذاكرة».[48] يمكن تجنب التأثير بممارسات بسيطة. على الرغم من أن خلايا NiMH متشابهة في الكيمياء، إلا أنها تعاني بشكل أقل من تأثير الذاكرة.[49]

الظروف البيئية
يجب أن تتحمل بطاريات السيارات القابلة لإعادة الشحن الرصاص الحمضية الإجهاد بسبب الاهتزازات والصدمات ونطاق درجة الحرارة. بسبب هذه الضغوط وكبريتات ألواح الرصاص الخاصة بها، فإن القليل من بطاريات السيارات تدوم لأكثر من ست سنوات من الاستخدام المنتظم.[50] تحتوي بطاريات بدء تشغيل السيارات (SLI : بدء التشغيل، الإضاءة، الإشعال) على العديد من اللوحات الرفيعة لزيادة التيار. بشكل عام، كلما زادت سماكة الألواح كلما طال العمر الافتراضي. عادة ما يتم تفريغها قليلاً فقط قبل إعادة الشحن.
تحتوي بطاريات الرصاص الحمضية «ذات الدورة العميقة» مثل تلك المستخدمة في عربات الغولف الكهربائية على ألواح أكثر سمكًا لإطالة عمرها.[51] الفائدة الرئيسية لبطارية الرصاص الحمضية هي انخفاض تكلفتها. عيوبه الرئيسية هي الحجم الكبير والوزن بالنسبة لقدرة وجهد معينين. لا ينبغي مطلقًا تفريغ بطاريات الرصاص الحمضية إلى أقل من 20٪ من سعتها، [52] لأن المقاومة الداخلية سوف تسبب الحرارة والضرر عند إعادة شحنها. غالبًا ما تستخدم أنظمة الرصاص والحمض ذات الدورة العميقة ضوء تحذير منخفض الشحن أو مفتاح قطع طاقة منخفض الشحن لمنع نوع الضرر الذي سيقصر من عمر البطارية.[53]
تخزين
يمكن إطالة عمر البطارية من خلال تخزين البطاريات في درجة حرارة منخفضة، كما هو الحال في الثلاجة أو الفريزر، مما يؤدي إلى إبطاء التفاعلات الجانبية. مثل هذا التخزين يمكن أن يطيل عمر البطاريات القلوية بحوالي 5٪ ؛ يمكن أن تحمل البطاريات القابلة لإعادة الشحن شحنتها لفترة أطول، حسب النوع.[54] للوصول إلى أقصى جهد لها، يجب إعادة البطاريات إلى درجة حرارة الغرفة ؛ تفريغ بطارية قلوية بقدرة 250 مللي أمبير عند 0 درجة مئوية فقط نصف كفاءة 20 درجة مئوية.[29] لا ينصح مصنعو البطاريات القلوية مثل دوراسيل بتبريد البطاريات.[28]
أحجام البطارية
تتراوح البطاريات الأساسية المتاحة بسهولة للمستهلكين من خلايا الأزرار الصغيرة المستخدمة في الساعات الكهربائية، إلى الخلية رقم 6 المستخدمة في دوائر الإشارة أو التطبيقات الأخرى طويلة الأمد. الخلايا الثانوية مصنوعة بأحجام كبيرة جدًا ؛ يمكن للبطاريات الكبيرة جدًا تشغيل غواصة أو تثبيت شبكة كهربائية والمساعدة في تسوية أحمال الذروة.
المخاطر
انفجار

يحدث انفجار البطارية بشكل عام بسبب سوء الاستخدام أو عطل، مثل محاولة إعادة شحن بطارية أساسية (غير قابلة لإعادة الشحن) أو ماس كهربائي.
عندما يعاد شحن البطارية بمعدل مفرط، يمكن إنتاج خليط غاز متفجر من الهيدروجين والأكسجين بشكل أسرع مما يمكنه الهروب من داخل البطارية (على سبيل المثال من خلال فتحة مدمجة)، مما يؤدي إلى تراكم الضغط وانفجار في نهاية المطاف حالة البطارية. في الحالات القصوى، قد تتناثر المواد الكيميائية للبطارية بعنف من الغلاف وتتسبب في حدوث إصابة. الشحن الزائد - أي محاولة شحن بطارية بما يتجاوز سعتها الكهربائية - يمكن أن يؤدي أيضًا إلى انفجار البطارية، بالإضافة إلى التسريب أو التلف غير القابل للإصلاح. قد يتسبب ذلك أيضًا في تلف الشاحن أو الجهاز الذي يتم استخدام البطارية الزائدة فيه لاحقًا.
من المرجح أن تنفجر بطاريات السيارات عندما تولد دائرة كهربائية تيارات كبيرة جدًا. تنتج هذه البطاريات الهيدروجين، وهو شديد الانفجار، عندما يتم شحنه بشكل مفرط (بسبب التحليل الكهربائي للماء في المنحل بالكهرباء). أثناء الاستخدام العادي، عادة ما تكون كمية الشحن الزائد صغيرة جدًا وتنتج القليل من الهيدروجين، والذي يتبدد بسرعة. ومع ذلك، عند «بدء التشغيل السريع» للسيارة، يمكن أن يتسبب التيار العالي في إطلاق كميات كبيرة من الهيدروجين سريعًا، والتي يمكن أن تشتعل بشكل متفجر بواسطة شرارة قريبة، على سبيل المثال عند فصل كبل توصيل.
قد يؤدي التخلص من البطارية عن طريق الحرق إلى انفجارها حيث يتراكم البخار داخل العلبة المغلقة.
أصبحت عمليات سحب الأجهزة التي تستخدم بطاريات الليثيوم أيون أكثر شيوعًا في السنوات الأخيرة. هذا ردا على الحوادث والفشل المبلغ عنها، وأحيانا الاشتعال أو الانفجار.[55][56] يشير ملخص الخبراء للمشكلة إلى أن هذا النوع يستخدم «إلكتروليتات سائلة لنقل أيونات الليثيوم بين الأنود والكاثود. إذا تم شحن خلية البطارية بسرعة كبيرة جدًا، فقد يتسبب ذلك في حدوث ماس كهربائي، مما يؤدي إلى حدوث انفجارات وحرائق».[57][58]
تسرب

العديد من المواد الكيميائية للبطاريات مسببة للتآكل أو سامة أو كليهما. في حالة حدوث تسرب، إما تلقائيًا أو من خلال حادث، فقد تكون المواد الكيميائية المنبعثة خطيرة. على سبيل المثال، غالبًا ما تستخدم البطاريات التي تستخدم لمرة واحدة «علبة» الزنك كمواد تفاعل وكحاوية لعقد الكواشف الأخرى. في حالة الإفراط في تفريغ هذا النوع من البطاريات، يمكن أن تخرج الكواشف من خلال الورق المقوى والبلاستيك الذي يشكل باقي الحاوية. يمكن أن يؤدي التسرب الكيميائي النشط بعد ذلك إلى إتلاف أو تعطيل المعدات التي تشغلها البطاريات. لهذا السبب، يوصي العديد من مصنعي الأجهزة الإلكترونية بإزالة البطاريات من الأجهزة التي لن يتم استخدامها لفترات طويلة من الزمن نسبيا .
المواد السامة
تستخدم أنواع كثيرة من البطاريات مواد سامة مثل الرصاص والزئبق والكادميوم كقطب كهربائي أو إلكتروليت. عند انتهاء عمر كل بطارية، يجب التخلص منها لمنع حدوث أضرار بيئية.[59] البطاريات هي أحد أشكال النفايات الإلكترونية (النفايات الإلكترونية). تعمل خدمات إعادة تدوير النفايات الإلكترونية على استعادة المواد السامة، والتي يمكن استخدامها بعد ذلك للبطاريات الجديدة.[60] من بين ما يقرب من ثلاثة مليارات بطارية يتم شراؤها سنويًا في الولايات المتحدة، ينتهي المطاف بحوالي 179000 طن في مدافن النفايات في جميع أنحاء البلاد.[61] في الولايات المتحدة، حظر قانون إدارة البطاريات المحتوية على الزئبق والقابلة لإعادة الشحن لعام 1996 بيع البطاريات المحتوية على الزئبق، وسن متطلبات وضع العلامات الموحدة للبطاريات القابلة لإعادة الشحن وتطلب أن تكون البطاريات القابلة لإعادة الشحن قابلة للإزالة بسهولة.[62] تحظر كاليفورنيا ومدينة نيويورك التخلص من البطاريات القابلة لإعادة الشحن في النفايات الصلبة، وتتطلب مع ماين إعادة تدوير الهواتف المحمولة.[63] تقوم صناعة البطاريات القابلة لإعادة الشحن بتشغيل برامج إعادة التدوير على مستوى الدولة في الولايات المتحدة وكندا، مع نقاط إنزال في تجار التجزئة المحليين.[63]
يشتمل توجيه البطارية الخاص بالاتحاد الأوروبي على متطلبات مماثلة، بالإضافة إلى المطالبة بزيادة إعادة تدوير البطاريات وتعزيز البحث حول طرق إعادة تدوير البطاريات المحسنة.[64] وفقًا لهذا التوجيه، يجب تمييز جميع البطاريات التي سيتم بيعها داخل الاتحاد الأوروبي بعلامة «رمز المجموعة» (حاوية ذات عجلات مشطوب عليها). يجب أن يغطي هذا ما لا يقل عن 3٪ من سطح البطاريات المنشورية و 1.5٪ من سطح البطاريات الأسطوانية. يجب وضع علامة على جميع العبوات بالمثل.[65]
ابتلاع
قد تكون البطاريات ضارة أو مميتة إذا ابتلعت.[66] يمكن ابتلاع خلايا الزر الصغيرة، خاصة من قبل الأطفال الصغار. أثناء وجوده في الجهاز الهضمي، قد يؤدي التفريغ الكهربائي للبطارية إلى تلف الأنسجة؛ [67] مثل هذا الضرر يكون خطيرًا في بعض الأحيان ويمكن أن يؤدي إلى الوفاة. لا تتسبب بطاريات القرص المبتلعة عادة في حدوث مشكلات إلا إذا استقرت في الجهاز الهضمي. المكان الأكثر شيوعًا لبطاريات الأقراص لتستقر هو المريء، مما يؤدي إلى عواقب إكلينيكية. من غير المحتمل أن تستقر البطاريات التي تعبر المريء بنجاح في مكان آخر. إن احتمالية استقرار بطارية القرص في المريء هي دالة على عمر المريض وحجم البطارية. بطاريات القرص 16 مم استقرت في المريء لطفلين تقل أعمارهم عن سنة واحدة. لا يعاني الأطفال الأكبر سنًا من مشاكل في البطاريات الأصغر من 21-23 مم. قد يحدث نخر التسييل لأن هيدروكسيد الصوديوم ينتج عن التيار الذي تنتجه البطارية (عادة عند الأنود). حدث الانثقاب بسرعة تصل إلى 6 ساعات بعد الابتلاع.[68]
كيمياء
تملي كيمياء البطارية العديد من خصائص الخلية المهمة، مثل الجهد، وكثافة الطاقة، والقابلية للاشتعال، وتركيبات الخلايا المتاحة، ونطاق درجة حرارة التشغيل، وفترة الصلاحية.
البطاريات الأولية وخصائصها
| كيمياء | الأنود (-) | كاثود (+) | ماكس. الجهد النظري (فولت) | الجهد الاسمي، عملي (فولت) | الطاقة النوعية (كيلوجول / كجم) | التفصيل | العمر الافتراضي عند 25 درجة مئوية، السعة 80٪ (شهور) |
|---|---|---|---|---|---|---|---|
| بطارية الزنك والكربون | Zn | MnO 2 | 1.6 | 1.2 | 130 | غير مكلف. | 18 |
| بطارية كلوريد الزنك | 1.5 | يُعرف أيضًا باسم "الخدمة الشاقة"، وهو غير مكلف. | |||||
| بطارية قلوية(الزنك - ثاني أكسيد المنغنيز) | Zn | MnO 2 | 1.5 | 1.15 | 400-590 | كثافة الطاقة المعتدلة.
جيد للاستخدامات عالية ومنخفضة الصرف. |
30 |
| بطارية نيكل أوكسي هيدروكسيد (الزنك - ثاني أكسيد المنغنيز / أوكسي هيدروكسيد النيكل) | 1.7 | كثافة الطاقة المعتدلة.
جيد للاستخدامات عالية الصرف. |
|||||
| بطارية الليثيوم(الليثيوم - أكسيد النحاس)
Li – CuO |
لي | CuO | 1.7 | لم تعد تصنع.
تم استبدالها ببطاريات أكسيد الفضة (من نوع IEC "SR"). |
|||
| بطارية الليثيوم(الليثيوم - ثاني كبريتيد الحديد)
LiFeS 2 |
لي | FeS 2 | 1.8 | 1.5 | 1070 | مكلفة.
تستخدم في البطاريات "الإضافية" أو "الإضافية". |
337 [69] |
| بطارية الليثيوم(الليثيوم - ثاني أكسيد المنغنيز)
LiMnO 2 |
لي | MnO 2 | 3.0 | 830-1010 | مكلفة.
تستخدم فقط في الأجهزة عالية التصريف أو العمر الافتراضي الطويل بسبب معدل التفريغ الذاتي المنخفض للغاية " عادةً ما يشير الليثيوم وحده إلى هذا النوع من الكيمياء. |
||
| بطارية الليثيوم(الليثيوم - فلوريد الكربون)
لي- (CF) ن |
لي | (CF) ن | 3.6 | 3.0 | 120 | ||
| بطارية الليثيوم(ليثيوم - أكسيد الكروم)
Li – CrO 2 |
لي | CrO 2 | 3.8 | 3.0 | 108 | ||
| بطارية الليثيوم
(بطارية ليثيوم سليكون) |
Li 22 Si 5 | ||||||
| بطارية أكسيد الزئبق | Zn | HgO | 1.34 | 1.2 | جهد عالي واستنزاف ثابت.
محظور في معظم البلدان بسبب مخاوف صحية. |
36 | |
| بطارية الزنك الهوائية | Zn | س 2 | 1.6 | 1.1 | 1590 [70] | تستخدم في الغالب في المعينات السمعية. | |
| بطارية زامبوني | Zn | Ag أو Au | 0.8 | عمر طويل جدا
تيار منخفض جدًا (nanoamp، nA) |
> 2000 | ||
| بطارية أكسيد الفضة (الفضة - الزنك) | Zn | Ag 2 O | 1.85 | 1.5 | 470 | غالي جدا.
تُستخدم تجاريًا فقط في خلايا "الزر". |
30 |
| بطارية المغنيسيوم | ملغ | MnO 2 | 2.0 | 1.5 | 40 |
البطاريات الثانوية (القابلة لإعادة الشحن) وخصائصها
| نوع البطارية | زنزانة
الجهد الكهربى |
محددالطاقة (كيلو جول / كجم) | طاقةكثافة (كيلوجول / لتر) | تعليقات |
|---|---|---|---|---|
| بطارية نيكل-كادميوم (NiCd) | 1.2 | 140 |
| |
| بطارية الرصاص | 2.1 | 140 |
| |
| بطارية نيكل-هيدريد فلز | 1.2 | 360 |
| |
| بطارية من النيكل والزنك (NiZn) | 1.6 | 360 |
| |
| بطارية أكسيد الفضة | 1.86
1.5 |
460 |
| |
| بطارية فوسفات حديد-ليثيوم | 3.3
3 |
360 | 790 |
|
| بطارية أيون الليثيوم | 3.6 | 460 |
|
بطاريات الحالة الصلبة
في 28 فبراير 2017، أصدرت جامعة تكساس في أوستن بيانًا صحفيًا حول نوع جديد من بطاريات الحالة الصلبة، تم تطويره بواسطة فريق بقيادة مخترع بطاريات الليثيوم أيون جون جودينو، «يمكن أن يؤدي إلى شحن أكثر أمانًا وسرعة، بطاريات قابلة لإعادة الشحن تدوم طويلاً للأجهزة المحمولة والسيارات الكهربائية وتخزين الطاقة الثابتة».[71] تم نشر المزيد من التفاصيل حول التكنولوجيا الجديدة في المجلة العلمية التي راجعها النظراء في الطاقة وعلوم البيئة .
تناقش المراجعات المستقلة للتقنية مخاطر نشوب حريق وانفجار من بطاريات الليثيوم أيون في ظل ظروف معينة لأنها تستخدم الإلكتروليتات السائلة. يجب أن تكون البطارية المطورة حديثًا أكثر أمانًا لأنها تستخدم إلكتروليتات زجاجية من شأنها التخلص من الدوائر القصيرة. ويقال أيضًا أن بطارية الحالة الصلبة تتمتع «بثلاثة أضعاف كثافة الطاقة»، مما يزيد من عمرها الإنتاجي في السيارات الكهربائية، على سبيل المثال. يجب أن تكون أيضًا أكثر سلامة من الناحية البيئية لأن التكنولوجيا تستخدم مواد أقل تكلفة وصديقة للأرض مثل الصوديوم المستخرج من مياه البحر. لديهم أيضًا حياة أطول ؛ «أظهرت الخلايا أكثر من 1200 دورة مع مقاومة خلايا منخفضة». لا يُتوقع أن تؤدي الأبحاث والنماذج الأولية إلى منتج قابل للتطبيق تجاريًا في المستقبل القريب، هذا إن حدث، وفقًا لكريس روبنسون من أبحاث إل يو إكس. «لن يكون لهذا تأثير ملموس على استخدام السيارة الكهربائية في السنوات الـ 15 المقبلة، إذا حدث ذلك على الإطلاق. وهناك عقبة رئيسية أن العديد من الشوارد الحالة الصلبة الوجه هو عدم وجود تحجيم وعملية التصنيع فعالة من حيث التكلفة، وقال» إن الأخبار الطاقة الأمريكية في رسالة عبر البريد الإلكتروني.[72]
خلايا محلية الصنع
يمكن أن يكون أي جسم سائل أو رطب يحتوي على ما يكفي من الأيونات ليكون موصل للكهرباء بمثابة إلكتروليت للخلية. كإثبات جديد أو علمي، من الممكن إدخال قطبين مصنوعين من معادن مختلفة في الليمون، [73] البطاطس، [74] إلخ، وتوليد كميات صغيرة من الكهرباء. كما تتوفر «ساعتا البطاطس» على نطاق واسع في متاجر الهوايات والألعاب ؛ إنها تتكون من زوج من الخلايا، كل منها يتكون من بطاطس (ليمون، وما إلى ذلك) مع قطبين كهربائيين مدخلين فيه، موصلين على التوالي لتشكيل بطارية ذات جهد كافي لتشغيل ساعة رقمية.[75] الخلايا محلية الصنع من هذا النوع ليس لها فائدة عملية.
يمكن صنع كومة فولتية من عملتين (مثل النيكل وبنس واحد) وقطعة من المناديل الورقية مغموسة في الماء المالح. تولد مثل هذه الكومة جهدًا منخفضًا للغاية، ولكن عندما يتم تكديس العديد منها في سلسلة، يمكنها استبدال البطاريات العادية لفترة قصيرة.[76]
طورت سوني بطارية بيولوجية تولد الكهرباء من السكر بطريقة مشابهة للعمليات التي لوحظت في الكائنات الحية. تولد البطارية الكهرباء من خلال استخدام الإنزيمات التي تكسر الكربوهيدرات.[77]
يمكن تصنيع خلايا الرصاص الحمضية بسهولة في المنزل، ولكن هناك حاجة إلى دورة شحن / تفريغ مملة «لتشكيل» الألواح. هذه عملية تتشكل فيها كبريتات الرصاص على الألواح، وأثناء الشحن، تتحول إلى ثاني أكسيد الرصاص (لوحة موجبة) ورصاص نقي (صفيحة سالبة). ينتج عن تكرار هذه العملية سطح خشن مجهريًا، مما يؤدي إلى زيادة مساحة السطح، وزيادة التيار الذي يمكن للخلية توصيله.[78]
من السهل صنع خلايا دانييل في المنزل. يمكن إنتاج بطاريات الألمنيوم الهوائية بألمنيوم عالي النقاء. تنتج بطاريات رقائق الألومنيوم بعض الكهرباء، لكنها ليست فعالة، ويرجع ذلك جزئيًا إلى إنتاج كمية كبيرة من غاز الهيدروجين (القابل للاحتراق).
كهرباء يعتمد عليها .. وبطاريات قابلة للشحن
كانت خلية دانييل أول مصدر يعتمد عليه للحصول على الكهرباء. فكانت هذه الخلية تنتج جهداً كهربائياً مستمراً لفترة لا بأس بها من الوقت، وتشتمل الخلية على قطب كهربائي من النحاس مغموس في محلول كبريتات النحاس وقطب كهربائي آخر من الزنك مغمور في حمض الكبريتيك. وكانت السوائل تحفظ منفصلة في وعاء مسامي.
كان العالم الفرنسي «جاستون بلانتي» رائدا في مجال تصميم بطارية الحمض والرصاص، والذي يمكن إعادة شحنها عندما تنفذ منها الكهرباء. تشتمل هذه البطاريات على أقطاب كهربائية من الرصاص وأكسيد الرصاص توضع في حمض الكبريتيك.
وظلت البطاريات في حالة تطوير حتى وصلت في عصرنا إلى ما هي عليه من اشكال واحجام وسعات مختلفة لكل الأجهزة الكهربائية في حياتنا واصبحت صناعة تجني المليارات حول العالم لاستخدامها الواسع في مختلف الصناعات والمجالات .[3][79]
تصنيف البطاريات الكهربائية
يمكن تصنيف المدخرات الكهربائية في مجموعتين أساسيتين هما:
- مدخرات كهربائية رئيسية غير قابلة للشحن مرة أخرى. هذا النوع يستنفذ طاقة التفاعل الكيميائية بإنتاج طاقة كهربائية مكافئة حتى تنتهي عملية التفاعل ولا يمكن استرجاعها. تتميز هذه المدخرات بسعتها العالية ومن أمثلتها مدخرات الزنك والكربون، المدخرات القلوية.
- مدخرات ثانوية قابلة للشحن مرة أخرى. هذا النوع يشترط شحنها بالكهرباء قبل استعمالها ومن أمثلتها مدخرة الرصاص ومدخرة النيكل كادميوم.
أنواع خلايا المدخرة
يمكن لأي من الصنفين السابقين أن يكون مؤلفاً من أحد أنواع الخلايا التالية:
- خلايا سائلة
- خلايا جافة
أداء المدخرة
يختلف أداء وخواص المدخرات بحسب أنواعها ومع دورة التحميل، دورة الشحن بسبب عوامل عدة منها كيميائية، التيار المأخوذ والحرارة.
ظاهرة الذاكرة
تعاني بعض المدخرات القابلة للشحن مثل مدخرات النيكل كادميوم من مشكلة تدعى تأثير الذاكرة أو تأثير المدخرة الكسلة. تنجم هذه المشكلة بسبب تشغيل المدخرة تحت ظروف التشغيل الخاصة بها لفترة من الزمن. يتلخص هذا التشغيل الخاطئ في أمرين:
- شحن المدخرة (خاصة الشحن لأول مرة) حتى تصل إلى جهد أدنى من الجهد الاسمي لها.
- تشغيل أو تحميل أو تفريغ المدخرة ثم إعادة شحنها قبل تفريغها تماماً.
عند حدوث أمور كهذه فإن خلايا المدخرة تتعامل (وكأنها تبرمجت) مع الوضع الجديد متناسية الخصائص الأصلية لها وبالتالي بكفاءة أدنى من المتوقع.
هناك مقترحات لتجنب مثل هذه المشكلة منها ما يلي:
- عند شحن المدخرة لأول مرة ينبغي شحنها لأطول فترة ممكنة (تحدد عادة من قبل المنتج) وكذلك التأكد من وصولها للجهد الاسمي لها أو أعلى قليلاً.
- عند إعادة شحن المدخرة ينبغي التأكد من وصولها للجهد الاسمي لها.
- بعد مرور فترة على شحن وتفريغ المدخرة العشوائي (لا يؤثر كثيراً على الأداء) ينصح بإعادة تفريغها تماما ثم إعادة شحنها للجهد الاسمي مرة كل أسبوعين تقريباُ من أجل إنعاش ذاكرة الخلايا.
مميزات البطارية
- خفيفة.
- متعددة الأحجام والأشكال.
- توفر طاقة عالية.
- سعتها كبيرة.
- الطاقة الكهربية فيها متواصلة بنفس القوة إلى أن تنفد البطارية.
- عمرها طويل مقارنة مع الأنواع السابقة.
انظر أيضًا
- جدار طاقة تسلا
- بطارية قابلة للشحن
- مركم
- خلية جلفانية
- بطارية السيارة
- خلية ثانوية
- بطارية نظائر مشعة
- بطارية الليمون
- تفاعل أكسدة-اختزال
- بطارية ليثيوم أيون
- تآكل جلفاني
- شاحن البطارية
المراجع
- ^ Q112315598، ص. 114، QID:Q112315598
- ^ Crompton، T. R. (20 مارس 2000). Battery Reference Book (ط. third). Newnes. ص. Glossary 3. ISBN:978-0-08-049995-6. مؤرشف من الأصل في 2021-01-22. اطلع عليه بتاريخ 2016-03-18.
- ^ Pauling، Linus (1988). "15: Oxidation-Reduction Reactions; Electrolysis". General Chemistry. New York: Dover Publications, Inc. ص. 539. ISBN:978-0-486-65622-9. مؤرشف من الأصل في 2020-08-02.
- ^ أ ب Schmidt-Rohr، Klaus (2018). "How Batteries Store and Release Energy: Explaining Basic Electrochemistry". Journal of Chemical Education. ج. 95 ع. 10: 1801–1810. Bibcode:2018JChEd..95.1801S. DOI:10.1021/acs.jchemed.8b00479.
- ^ Pistoia، Gianfranco (25 يناير 2005). Batteries for Portable Devices. Elsevier. ص. 1. ISBN:978-0-08-045556-3. مؤرشف من الأصل في 2021-01-22. اطلع عليه بتاريخ 2016-03-18.
- ^ "من سرق بطارية بغداد العجيبة؟". RT Arabic. مؤرشف من الأصل في 2020-08-08. اطلع عليه بتاريخ 2020-08-08.
- ^ Pickover, Clifford A. "250 avant J.-C. : la pile de Bagdad". Futura (بfrançais). Archived from the original on 2020-08-04. Retrieved 2020-08-08.
- ^ Bellis, Mary. History of the Electric Battery. About.com. Retrieved 11 August 2008. نسخة محفوظة 2023-03-07 على موقع واي باك مشين.
- ^ National Geographic Society. "Quiz: What You Don't Know About Batteries". National Geographic. مؤرشف من الأصل في 2018-03-23.
- ^ Bellis, Mary. Biography of Alessandro Volta – Stored Electricity and the First Battery. About.com. Retrieved 7 August 2008. نسخة محفوظة 2023-03-07 على موقع واي باك مشين.
- ^ Stinner, Arthur. Alessandro Volta and Luigi Galvani نسخة محفوظة 10 September 2008 على موقع واي باك مشين. (PDF). Retrieved 11 August 2008.
- ^ Electric Battery History – Invention of the Electric Battery نسخة محفوظة 22 February 2019 على موقع واي باك مشين.. The Great Idea Finder. Retrieved 11 August 2008.
- ^ Battery History, Technology, Applications and Development. MPower Solutions Ltd. Retrieved 19 March 2007. نسخة محفوظة 7 نوفمبر 2020 على موقع واي باك مشين.
- ^ Borvon، Gérard (10 سبتمبر 2012). "History of the electrical units". Association S-EAU-S. مؤرشف من الأصل في 2020-11-05.
- ^ "Columbia Dry Cell Battery". National Historic Chemical Landmarks. American Chemical Society. مؤرشف من الأصل في 2013-02-23. اطلع عليه بتاريخ 2013-03-25.
- ^ Ashcroft، N.W.؛ Mermin (1976). Solid State Physics. N.D. Belmont, CA: Brooks/Cole.
- ^ Dingrando 665.
- ^ Saslow 338.
- ^ Dingrando 666.
- ^ أ ب Knight 943.
- ^ أ ب Knight 976.
- ^ Terminal Voltage – Tiscali Reference نسخة محفوظة 11 April 2008 على موقع واي باك مشين.. Originally from Hutchinson Encyclopaedia. Retrieved 7 April 2007.
- ^ Dingrando 674.
- ^ Dingrando 677.
- ^ Dingrando 675.
- ^ Fink, Ch. 11, Sec. "Batteries and Fuel Cells."
- ^ فرانكلين ليونارد بوب, Modern Practice of the Electric Telegraph 15th Edition, D. Van Nostrand Company, New York, 1899, pp. 7–11. Available on the أرشيف الإنترنت
- ^ أ ب Duracell: Battery Care. Retrieved 10 August 2008. نسخة محفوظة 3 سبتمبر 2011 على موقع واي باك مشين.
- ^ أ ب Alkaline Manganese Dioxide Handbook and Application Manual (PDF). Energizer. Retrieved 25 August 2008. نسخة محفوظة 14 مارس 2020 على موقع واي باك مشين.
- ^ Dynasty VRLA Batteries and Their Application نسخة محفوظة 6 February 2009 على موقع واي باك مشين.. C&D Technologies, Inc. Retrieved 26 August 2008.
- ^ USBCELL – Revolutionary rechargeable USB battery that can charge from any USB port. Retrieved 6 November 2007. نسخة محفوظة 2 يناير 2021 على موقع واي باك مشين.
- ^ "Spotlight on Photovoltaics & Fuel Cells: A Web-based Study & Comparison" (PDF). ص. 1–2. مؤرشف من الأصل (PDF) في 2020-10-03. اطلع عليه بتاريخ 2007-03-14.
- ^ أ ب Battery Knowledge – AA Portable Power Corp. Retrieved 16 April 2007. نسخة محفوظة 23 May 2007 على موقع واي باك مشين.
- ^ "Battery Capacity". techlib.com. مؤرشف من الأصل في 2020-11-26.
- ^ A Guide to Understanding Battery Specifications, MIT Electric Vehicle Team, December 2008 نسخة محفوظة 11 ديسمبر 2020 على موقع واي باك مشين.
- ^ Kang، B.؛ Ceder، G. (2009). "Battery materials for ultrafast charging and discharging". Nature. ج. 458 ع. 7235: 190–193. Bibcode:2009Natur.458..190K. DOI:10.1038/nature07853. PMID:19279634. 1:00–6:50 (audio) نسخة محفوظة 22 فبراير 2012 على موقع واي باك مشين.
- ^ "Elon Musk wins $50m bet with giant battery for South Australia". Sky News. 24 نوفمبر 2017. مؤرشف من الأصل في 2020-12-19. اطلع عليه بتاريخ 2018-09-20.
- ^ Dillow، Clay (21 ديسمبر 2012). "China Builds the World's Largest Battery, a Building-Sized, 36-Megawatt-Hour Behemoth | Popular Science". Popsci.com. مؤرشف من الأصل في 2020-07-25. اطلع عليه بتاريخ 2013-07-31.
- ^ Conway, E. (2 September 2008) "World's biggest battery switched on in Alaska" Telegraph.co.uk نسخة محفوظة 24 سبتمبر 2020 على موقع واي باك مشين.
- ^ Biello, D. (22 December 2008) "Storing the Breeze: New Battery Might Make Wind Power More Reliable" Scientific American نسخة محفوظة 22 يناير 2021 على موقع واي باك مشين.
- ^ "Auwahi Wind | Energy Solutions | Sempra U.S. Gas & Power, LLC". Semprausgp.com. مؤرشف من الأصل في 2014-05-02. اطلع عليه بتاريخ 2013-07-31.
- ^ Amos, J. (24 August 2008) "Solar plane makes record flight" BBC News نسخة محفوظة 17 ديسمبر 2020 على موقع واي باك مشين.
- ^ Self discharge of batteries – Corrosion Doctors. Retrieved 9 September 2007. نسخة محفوظة 17 فبراير 2020 على موقع واي باك مشين.
- ^ Energizer Rechargeable Batteries and Chargers: Frequently Asked Questions نسخة محفوظة 9 February 2009 على موقع واي باك مشين.. Energizer. Retrieved 3 February 2009.
- ^ [1] نسخة محفوظة 2 February 2010 على موقع واي باك مشين.
- ^ أ ب Rechargeable battery Tips – NIMH Technology Information. Retrieved 10 August 2007. نسخة محفوظة 8 August 2007 على موقع واي باك مشين.
- ^ battery myths vs battery facts – free information to help you learn the difference. Retrieved 10 August 2007. نسخة محفوظة 3 ديسمبر 2013 على موقع واي باك مشين.
- ^ Filip M. Gieszczykiewicz. "Sci.Electronics FAQ: More Battery Info". repairfaq.org. مؤرشف من الأصل في 2020-10-03.
- ^ RechargheableBatteryInfo.com، المحرر (28 أكتوبر 2005)، What does 'memory effect' mean?، مؤرشف من الأصل في 2007-07-15، اطلع عليه بتاريخ 2007-08-10
- ^ Rich, Vincent (1994). The International Lead Trade. Cambridge: Woodhead. 129.
- ^ Deep Cycle Battery FAQ. Northern Arizona Wind & Sun. Retrieved 3 February 2009. نسخة محفوظة 12 نوفمبر 2020 على موقع واي باك مشين.
- ^ Car and Deep Cycle Battery FAQ. Rainbow Power Company. Retrieved 3 February 2009. نسخة محفوظة 6 نوفمبر 2020 على موقع واي باك مشين.
- ^ Deep cycle battery guide نسخة محفوظة 17 February 2009 على موقع واي باك مشين.. Energy Matters. Retrieved 3 February 2009.
- ^ Ask Yahoo: Does putting batteries in the freezer make them last longer? نسخة محفوظة 27 April 2006 على موقع واي باك مشين.. Retrieved 7 March 2007.
- ^ Schweber، Bill (4 أغسطس 2015). "Lithium Batteries: The Pros and Cons". GlobalSpec. GlobalSpec. مؤرشف من الأصل في 2020-11-26. اطلع عليه بتاريخ 2017-03-15.
- ^ Fowler، Suzanne (21 سبتمبر 2016). "Samsung's Recall – The Problem with Lithium Ion Batteries". نيويورك تايمز. New York. مؤرشف من الأصل في 2018-10-03. اطلع عليه بتاريخ 2016-03-15.
- ^ Hislop، Martin (1 مارس 2017). "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough". North American Energy News. The American Energy News. مؤرشف من الأصل في 2020-11-12. اطلع عليه بتاريخ 2017-03-15.
- ^ "battery hazards". YouTube. مؤرشف من الأصل في 2021-01-22. اطلع عليه بتاريخ 2018-09-20.
- ^ Batteries – Product Stewardship نسخة محفوظة 29 September 2006 على موقع واي باك مشين.. EPA. Retrieved 11 September 2007.
- ^ Battery Recycling » Earth 911. Retrieved 9 September 2007. نسخة محفوظة 12 أكتوبر 2008 على موقع واي باك مشين.
- ^ "San Francisco Supervisor Takes Aim at Toxic Battery Waste". Environmental News Network (11 July 2001).
- ^ Mercury-Containing and Rechargeable Battery Management Act نسخة محفوظة 6 February 2009 على موقع واي باك مشين.
- ^ أ ب [2] نسخة محفوظة 4 يونيو 2009 على موقع واي باك مشين. "نسخة مؤرشفة". مؤرشف من الأصل في 2018-04-25. اطلع عليه بتاريخ 2021-01-22.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Disposal of spent batteries and accumulators. European Union. Retrieved 27 July 2009. نسخة محفوظة 9 سبتمبر 2019 على موقع واي باك مشين.
- ^ Guidelines on Portable Batteries Marking Requirements in the European Union 2008 – EPBA-EU نسخة محفوظة 7 October 2011 على موقع واي باك مشين.
- ^ Product Safety DataSheet – Energizer (p. 2). Retrieved 9 September 2007. نسخة محفوظة 28 سبتمبر 2020 على موقع واي باك مشين.
- ^ "Swallowed a Button Battery? | Battery in the Nose or Ear?". Poison.org. 3 مارس 2010. مؤرشف من الأصل في 2013-08-16. اطلع عليه بتاريخ 2013-07-26.
- ^ "Disk Battery Ingestion: Background, Pathophysiology, Epidemiology". 9 يونيو 2016. مؤرشف من الأصل في 2020-11-26.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) والوسيط غير المعروف|بواسطة=تم تجاهله يقترح استخدام|via=(مساعدة) - ^ "Lithium Iron Disulfide Handbook and Application Manual" (PDF). energizer.com. مؤرشف من الأصل (PDF) في 2021-01-09. اطلع عليه بتاريخ 2018-09-20.
- ^ Excludes the mass of the air oxidizer.
- ^ "Lithium-Ion Battery Inventor Introduces New Technology for Fast-Charging, Noncombustible Batteries". University of Texas at Austin. University of Texas. 28 فبراير 2017. مؤرشف من الأصل في 2021-01-05. اطلع عليه بتاريخ 2017-03-15.
...first all-solid-state battery cells that could lead to safer, faster-charging, longer-lasting rechargeable batteries for handheld mobile devices, electric cars and stationary energy storage.
- ^ Hislop، Martin (1 مارس 2017). "Solid-state EV battery breakthrough from Li-ion battery inventor John Goodenough". North American Energy News. The American Energy News. مؤرشف من الأصل في 2020-11-12. اطلع عليه بتاريخ 2017-03-15.
But even John Goodenough's work doesn't change my forecast that EVs will take at least 50 years to reach 70 to 80 percent of the global vehicle market.
- ^ ushistory.org: The Lemon Battery. Accessed 10 April 2007. نسخة محفوظة 27 نوفمبر 2020 على موقع واي باك مشين.
- ^ ZOOM activities: phenom Potato Battery. Accessed 10 April 2007. نسخة محفوظة 12 سبتمبر 2018 على موقع واي باك مشين.
- ^ Two-Potato Clock – Science Kit and Boreal Laboratories[وصلة مكسورة]. Accessed 10 April 2007. نسخة محفوظة 24 نوفمبر 2020 على موقع واي باك مشين.
- ^ Howstuffworks "Battery Experiments: Voltaic Pile". Accessed 10 April 2007. نسخة محفوظة 12 يوليو 2011 على موقع واي باك مشين.
- ^ Sony Develops A Bio Battery Powered By Sugar. Accessed 24 August 2007. نسخة محفوظة 19 فبراير 2008 على موقع واي باك مشين.
- ^ "Home made lead acid batteries". Windpower.org.za. 16 سبتمبر 2007. مؤرشف من الأصل في 2013-07-31. اطلع عليه بتاريخ 2013-07-26.
- ^ "قصص 26: اختراعات | قصة اختراع البطاريات الكهربائية". قصص 26 (بar-EG). Archived from the original on 2018-02-28. Retrieved 2018-02-27.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link)
روابط خارجية
| بطارية في المشاريع الشقيقة: | |
- Batteries على مشروع الدليل المفتوح
- البطاريات غير القابلة لإعادة الشحن
- HowStuffWorks: كيف تعمل البطاريات
- أنواع خلايا البطارية الأخرى
- حزمة التدريس والتعلم DoITPoMS- «البطاريات»
- The Physics arXiv Blog (17 أغسطس 2013). "First Atomic Level Simulation of a Whole Battery | MIT Technology Review". Technologyreview.com. مؤرشف من الأصل في 2015-06-14. اطلع عليه بتاريخ 2013-08-21.