|
تضامنًا مع حق الشعب الفلسطيني |
إنزيم محفز
الإنزيم المُحفز هو زيادة في معدل رد الفعل الكيميائي بواسطة الموقع النشِط للبروتين.[1] قد يكون المحفز البروتيني (الإنزيم) جزءًا من مركب البروتين المتعدد الفرعي، و/أو قد يرتبط بشكل عابر أو دائم مع عامل مساعد (على سبيل المثال أدينوسين ثلاثي الفوسفات). تحفيز التفاعلات الكيميائية الحيوية في الخلية هو أمر حيوي نظرًا لمعدلات رد الفعل المنخفض جدًا من ردود الفعل غير المُحفزة في درجة حرارة الغرفة والضغط. أحد العوامل الرئيسية لتطور البروتين هو تحسين هذه الأنشطة التحفيزية عن طريق ديناميتات البروتين.[1]
آلية تحفيز الإنزيم مماثلة من حيث المبدأ لأنواع أخرى من التحفيز الكيميائي.من خلال توفير مسار رد فعل بديل يقلل الإنزيم من الطاقة المطلوبة للوصول إلى أعلى حالة انتقال الطاقة لرد الفعل. ويؤدي تخفيض طاقة التنشيط (ط.ت) إلى زيادة كمية الجزيئات المتفاعلة التي تحقق مستوى كافٍ من الطاقة، بحيث تصل إلى طاقة التنشيط وتشكل المُنتج.وكما هو الحال مع المواد المحفزة الأخرى، لا يُستهلك الإنزيم خلال التفاعل (كركيزة) ولكن يتم إعادة تدويره بحيث يقوم إنزيم واحد بعدة جولات من التحفيز.
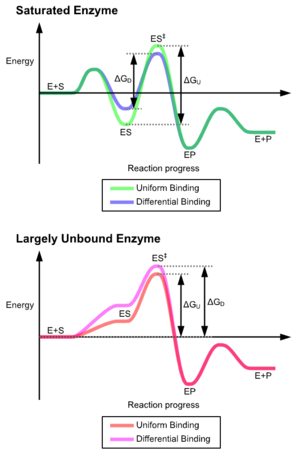
ويُعد النموذج المفضل لتفاعل ركيزة الإنزيم هو النموذج المناسب المُحفزة.[2]هذا النموذج يقترح أن التفاعل الأولي بين الإنزيم والركيزة ضعيف نسبيًا، ولكن هذه التفاعلات الضعيفة تحفز بسرعة التغيرات التوافقية في الإنزيم الذي يعزز الربط.
وتنشأ مزايا آلية التناسب المُستحثة بسبب تأثير استقرار انزيم قوي مُلزم.هناك آليتان مختلفتان من روابط الركائز: رابطة موحدة، وهي بها رابطة ركيزة قوية، ورابطة تفاضلية، وهي بها رابطة حالة انتقال قوي.تأثير استقرار رابطة موحدة يزيد من كل من الركيزة وصلة رابطة حالة الانتقال، في حين يزيد الارتباط التفاضلي من صلة رابطة حالة الانتقال.كلاهما يستخدم من قبل الانزيمات وتم اختيارها بشكلٍ تطوري لتقليل طاقة تنشيط التفاعل. الإنزيمات المشبعة، وهي، لديها رابطة ركيزة عالية التقارب، تتطلب رابطة تفاضلية للحد من طاقة التنشيط، في حين أن إنزيمات الركيزة الصغيرة غير المربوطة قد تستخدم إما رابطة تفاضلية أو موحدة.[3]
وقد أدت هذه الآثار إلى استخدام معظم البروتينات لآلية الربط التفاضلي للحد من طاقة التنشيط، لذلك تشمل معظم الركائز على تقارب عالي للإنزيم بينما هي في حالة الانتقال.يتم تنفيذ الربط التفاضلي بواسطة آلية التناسب المُستحثة - ترتبط الركيزة أولاً بشكلٍ ضعيف، ثم يُغير الإنزيم التشكل مما يزيد من تقارب حالة الانتقال والاستقرار، وبذلك يُحد من طاقة التنشيط للوصول إليه.
ومن المهم أن نوضح، مع ذلك، أنه لا يمكن استخدام المفهوم المناسب المُستحث لترشيد التحفيز.وهذا هو، ما يُعرف بالتحفيز الكيميائي بأنه الحد من تنشيط الطاقة ‡ (عندما يكون النظام هو بالفعل ضمن وضع تنشيط الطاقة ‡) نسبةً إلى تنشيط الطاقة ‡ في رد الفعل غير المُحفز في الماء (بدون الإنزيم). ولا يدل هذا التناسب المُستحث إلا أن الحاجز أقل في الشكل المغلق للإنزيم، لكنه لا يطلعنا على سبب تخفيض الحاجز.
وقد يكون التناسب المُستحث مفيدًا لدقة الاعتراف الجزيئي في وجود المنافسة والضوضاء من خلال آلية التدقيق التصحيحي التوافقي.
آليات مسار رد الفعل البديل
تأتي هذه التغيرات التوافقية أيضًا ببقايا مُحفزة في الموقع النشِط على مقربة من الروابط الكيميائية في الركيزة التي سيتم تعديلها في رد الفعل. بعد حدوث عملية الربط، تقوم آلية واحدة أو أكثر من آليات التحفيز بتقليل طاقة الحالة الانتقالية للرد التفاعلي، من خلال توفير مسار كيميائي بديل للتفاعل. وهناك ست آليات ممكنة للتحفيز «على الحاجز» وكذلك آلية «من خلال الحاجز»:
التقريب والتوجيه
تحاكي ردود أفعال ركيزة الإنزيم المجموعات الكيميائية التفاعلية وتعقدها معًا بالقرب من بعضهم البعض في أفضل علم هندسي، مما يزيد من معدل رد الفعل. وهذا يقلل من تداخل من المتفاعلات وبالتالي يقلل من ردود أفعال الإضافة أو النقل غير مؤاتية، منذ انخفاض التداخل العام عندما يصبح متفاعلين منتجًا واحدًا.
هذا التأثير هو مماثل لزيادة فعالة في تركيز المواد الكاشفة. يمنحنا ربط المواد الكاشفة بالإنزيم سلسلة من التفاعلات بين الجزيئات، مما يعطي زيادة معدل كبيرة.
على سبيل المثال، ستقع ردود الفعل المماثلة بشكلٍ أسرع بكثير إذا كان رد الفعل داخل الجزيء.
يمكن تقدير التركيز الفعال للأسيتيت في التفاعل الجزيئي كـ k2/k1 = 2 x 105 Molar.
ومع ذلك، قد يكون الوضع أكثر تعقيدًا، لأن الدراسات الحسابية الحديثة قد أثبتت أن الأمثلة التقليدية للآثار القرب لا يمكن أن تكون ذات صلة مباشرة بآثار التدهور الحتمي للإنزيم. وأيضًا، تم اكتشاف أن المقترح الأصلي للانتروبيا يساهم بشدة في انتروبيا التوجيه للمُحفز.
مانحو ومستقبلو البروتون
يمكن للمانحين والمستقبلين للبروتون، أي أن الأحماض والقاعدة قد تقوم بالتبرع بالبروتونات أو استقبالها لتحقيق الاستقرار بالنسبة لتكاليف التطوير في الحالة الانتقالية. هذا عادةً ما يكون له تأثير تفعيل مجموعات النيوكليوفيل والإلكتروفيل، أو استقرار مجموعات المغادرة. الهستيدينوغالبًا ما يكون الهستيدين عبارة عن بقايا تشارك في هذه التفاعلات الحمضية / القاعدية، لأنه على ثابت تفكك الحمضمقربة من المحايدة درجة الحموضة، وبالتالي يمكن لكليهما قبول البروتونات أو التبرع بها.
تفترض العديد من آليات التفاعل التي تنطوي على التحفيز الحمضي / القاعدي تغيرًا كبيرًا في ثابت تفكك الحمض.هذا التغير الواقع في ثابت تفكك الحمض محتملاً من خلال البيئة المحلية للبقايا.
| الحالات | الأحماض | القواعد |
| بيئة كارهة للماء | زيادة ثابت تفكك الحمض | خفض ثابت تفكك الحمض |
| البقايا الناجمة لمثل هذه الشحنات | زيادة ثابت تفكك الحمض | خفض ثابت تفكك الحمض |
| تشكيل القنطرة الملحية (والرابطة الهيدروجينية) | خفض ثابت تفكك الحمض | زيادة ثابت تفكك الحمض |
يمكن أيضًا أن يتأثر ثابت تفكك الحمض بشكلٍ كبير من البيئة المحيطة، للحد من البقايا التي هي أساسية في الحل قد تكون بمثابة متبرعي البروتون، والعكس صحيح.
على سبيل المثال:-
الثالوث التحفيزي لـ بروتييز السيرين

من المهم توضيح أن تعديل ثابت تفكك الحمض هو جزء نقي من الآلية الكهربية.[10]وعلاوة على ذلك، فإن تأثير المُحفز للمثال أعلاه يرتبط أساسًا مع الحد من ثابت تفكك الحمض من أوكسيانيون والزيادة في ثابت تفكك الحمض من الهستيدين، في حين أن نقل البروتون من السيرين إلى الهستيدين غير مُحفز كثيرًا، لأنه ليس هو معدل تحديد الحاجز.
التحفيز الكهربائي
يمكن أيضًا تحقيق استقرار حالات النقل المشحونة بواسطة البقايا في الموقع النشِط مكونة بذلك روابط أيونية (أو تداخلات شحن أيونية جزئية) مع الوسيط.ويمكن أن تأتي هذه الروابط إما من سلاسل جانبية حمضية أو قاعدية موجودة على الأحماض الأمينية مثل ليسين أو أرجينين أو حمض الأسبارتيك أو حمض الجلوتاميك أو تأتي من عوامل مساعدة معدنية مثل الزنك. الأيونات المعدنية فعالة بشكل خاص ويمكن أن تقلل من ثابت تفكك الحمض من الماء بما فيه الكفاية لجعله نوكليوفيل فعال.
وقد أثبتت دراسات المحاكاة الحاسوبية المنهجية أن التأثيرات الكهروستاتيكية تعطي، إلى حد بعيد، أكبر مساهمة في التحفيز على وجه الخصوص، وفقد تبين أن الإنزيم يوفر بيئة قطبية أكثر من الماء، وأن حالات الانتقال الأيونية تستقر بواسطة ثنائيات القطب الثابتة.وهذا يختلف كثيرًا عن استقرار الحالة الانتقالية في الماء، حيث جزيئات الماء يجب أن تدفع بما يُسمى «إعادة تنظيم الطاقة». من أجل تحقيق استقرار الحالات الأيونية والمشحونة. وهكذا، يرتبط التحفيز مع حقيقة أن مجموعات الإنزيم القطبية أعيد ترتيبها.
وقد تبين أن حجم الحقل الكهروستاتيكي المبذول بفعل موقع الإنزيم النشط مرتبط ارتباطًا وثيقًا بتحسن معدل التحفيز الإنزيمي.
عادةً ما يتبع ربط الركيزة استبعاد المياه من الموقع النشِط، وبالتالي يتم خفض ثابت العزل المحلي لذلك المذيب العضوي. وهذا يقوي التفاعلات الكهروستاتيكية بين الركائز المشحونة/القطبية والمواقع النشطة. وبالإضافة إلى ذلك، أظهرت الدراسات أن توزيع الشحنات حول المواقع النشطة يتم ترتيبها من أجل تحقيق الاستقرار في حالات الانتقال من ردود الفعل المُحفزة. وفي العديد من الإنزيمات، على ما يبدو أن توزيع هذه الشحنات لتوجيه الركائز القطبية نحو مواقع الربط ولذلك معدلات هذه التفاعلات الأنزيمية أكبر من حدودها الظاهرة التي يسيطر عليها الانتشار.

أمثلة على الآليات التحفيزية
كتب مرجعية
Kamerlin, S. C.; Warshel, A (2010). "At the dawn of the 21st century: Is dynamics the missing link for understanding enzyme catalysis?". Proteins: Structure, Function, and Bioinformatics. 78 (6): 1339–75. doi:10.1002/prot.22654. PMC 2841229 Freely accessible. PMID 20099310.
Koshland DE (February 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proc. Natl. Acad. Sci. U.S.A. 44 (2): 98–104. Bibcode:1958PNAS...44...98K. doi:10.1073/pnas.44.2.98. PMC 335371 Freely accessible. PMID 16590179.
Anslyn, E.V.; Dougherty, D.A. (2006). Modern Physical Organic Chemistry. University Science Books. ISBN 1-891389-31-9.
Savir Y; Tlusty T (2007). Scalas, Enrico, ed. "Conformational Proofreading: The Impact of Conformational Changes on the Specificity of Molecular Recognition" (PDF). PLOS ONE. 2 (5): e468. Bibcode:2007PLoSO...2..468S. doi:10.1371/journal.pone.0000468. PMC 1868595 Freely accessible. PMID 17520027.open access publication – free to read
Stanton, R.V.; Perakyla, M.; Bakowies, D.; Kollman, P.A. (1998). "Combined ab initio and Free Energy Calculations To Study Reactions in Enzymes and Solution: Amide Hydrolysis in Trypsin and Aqueous Solution". J. Am. Chem. Soc. 120 (14): 3448–3457. doi:10.1021/ja972723x.
Kuhn, B.; Kollman, P.A. (2000). "QM-FE and Molecular Dynamics Calculations on Catechol O-Methyltransferase: Free Energy of Activation in the Enzyme and in Aqueous Solution and Regioselectivity of the Enzyme-Catalyzed Reaction". J. Am. Chem. Soc. 122 (11): 2586–2596. doi:10.1021/ja992218v.
Bruice, T.C.; Lightstone, F.C. (1999). "Ground State and Transition State Contributions to the Rates of Intramolecular and Enzymatic Reactions". Acc. Chem. Res. 32 (2): 127–136. doi:10.1021/ar960131y.
Page, M.I.; Jencks, W.P. (1971). "Entropic Contributions to Rate Accelerations in Enzymic and Intramolecular Reactions and the Chelate Effect". Proc. Natl. Acad. Sci. USA. 68: 1678–1683. Bibcode:1971PNAS...68.1678P. doi:10.1073/pnas.68.8.1678. PMC 389269 Freely accessible. PMID 5288752.
Warshel, A.; Parson, W.W. (2001). "Dynamics of Biochemical and Biophysical Reactions: Insight from Computer Simulations". Quart. Rev. Biophys. 34: 563–679. doi:10.1017/s0033583501003730.
Warshel, A.; Sharma, P.K.; Kato, M.; Xiang, Y.; Liu, H.; Olsson, M.H.M. (2006). "Electrostatic Basis of Enzyme Catalysis". Chem. Rev. 106: 3210–3235. doi:10.1021/cr0503106. PMID 16895325.
Warshel, A.; Naray-Szabo, G.; Sussman, F.; Hwang, J.-K. (1989). "How do Serine Proteases Really Work?". Biochemistry. 28: 3629–37. doi:10.1021/bi00435a001. PMID 2665806.
Holmes, KC; Angert, I; Kull, FG; Jahn, W; Schroder, RR. (2003). "Electron cryo-microscopy shows how strong binding of myosin to actin releases nucleotide". Nature. 425: 423–427. Bibcode:2003Natur.425..423H. doi:10.1038/nature02005. PMID 14508495.
Warshel, A (1978). "Energetics of Enzyme Catalysis". Proc. Natl. Acad. Sci. USA. 75: 5250–5254. Bibcode:1978PNAS...75.5250W. doi:10.1073/pnas.75.11.5250. PMC 392938 Freely accessible. PMID 281676.
"EXTREME ELECTRIC FIELDS POWER CATALYSIS IN THE ACTIVE SITE OF KETOSTEROID ISOMERASE", [1]
"How Enzymes Work"
Lymn, RW; Taylor, EW. (1971). "Mechanism of adenosine triphosphate hydrolysis by actomyosin". Biochemistry. 10: 4617–4624. doi:10.1021/bi00801a004.
Siemankowski, RF; Wiseman, MO; White, HD. (1985). "ADP dissociation from actomyosin subfragment 1 is sufficiently slow to limit the unloaded shortening velocity in vertebrate muscle". Proc. Natl. Acad. Sci. USA. 82: 658–662. Bibcode:1985PNAS...82..658S. doi:10.1073/pnas.82.3.658.
White, HD; Belknap, B; Webb, MR. (1997). "Kinetics of nucleoside triphosphate cleavage and phosphate release steps by associated rabbit skeletal actomyosin, measured using a novel fluorescent probe for phosphate". Biochemistry. 36: 11828–11836. doi:10.1021/bi970540h.
Tirosh, R; Low, WZ; Oplatka, A. (1990). "Translational motion of actin filaments in the presence of heavy meromyosin and MgATP as measured by Doppler broadening of laser light scattering". Biochim. Biophys. Acta. 1037: 274–280. doi:10.1016/0167-4838(90)90025-b.
مطالعة إضافية
- Alan Fersht, Structure and Mechanism in Protein Science : A Guide to Enzyme Catalysis and Protein Folding. W. H. Freeman, 1998. (ردمك 0-7167-3268-8)
- Dedicated issue of Philosophical Transactions B on Quantum catalysis in enzymes freely available.[وصلة مكسورة]
مراجع
- ^ "معلومات عن إنزيم محفز على موقع thes.bncf.firenze.sbn.it". thes.bncf.firenze.sbn.it. مؤرشف من الأصل في 2019-12-10.
| في كومنز صور وملفات عن: إنزيم محفز |