|
تضامنًا مع حق الشعب الفلسطيني |
إعادة التركيب الجيني
تحتاج هذه المقالة إلى الاستشهاد بمصادر إضافية لتحسين وثوقيتها. |
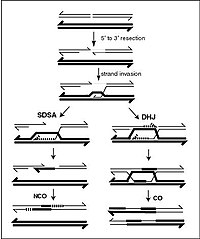
التأشيب الجيني أو إعادة التركيب الجيني[1] أو التوليف الجيني[1] Genetic recombination أو إعادة الخلط الجيني[2] أيضا : إحدى العمليات الجينية الناقلة يتم فيها خلط تجمعات الأليلات[؟] alleles الموجودة في مواقع جينية locus (موضع صبغوي على مورثة) مختلفة عند الأبوين عند انتقالهما إلى أفراد الخلف (الذرية) .
هذا التعريف يستخدم عادة في علم الوراثة الكلاسيكي، والبيولوجيا التطورية، وعلم الوراثة التجمعي population genetics. مثل هذا الخلط في الأليلات يمكن ان يكون نتيجة التوليف بطريقتين لحصول هذا التأشيب : تأشيب داخل-صبغي (تأشيب داخل-كروموسومي) intra-chromososomal recombination (تدعى هذه الطريقة أيضا تصالب crossing over) أو تأشيب بين-صبغي inter-chromososomal recombination (يدعى أيضا تناسق مستقل independent assortment).
التأشيب إذا يقوم بخلط التباينات الجينية الموجودة مسبقا ولا يقوم بخلط تباينات (اختلافات) جينية جديدة ضمن المواقع loci التي تشملها هذه العملية. في البيولوجيا التطورية، يكون التأشيب الجيني، بين-صبغي أو داخل-صبغي، ذو أهمية خاصة للسماح الكائنات المتوالدة جنسيا من تجنب سقاطة مولر Muller's ratchet.
في البيولوجيا الجزيئية، التأشيب يشير عادة إلى عملية جزيئية يتم بها تفريق (خلط) تباين جيني genetic variation يتواجد عادة مترافقا في موقعين مختلفين ضمن قطعة مستمرة وحيدة من الدنا. ففي هذه العملية أحد أو كلي الجينتين المتباينتين يتم استبدالها بجينتين متباينتين مختلفتين، الجينتين الجديديتين تأتيان من نفس الموقعين لكن على قطعة دي أن إيه ثانية.
التشابك الصبغي
يسبق التشابك الصبغي (عملية اقتران الكروموسومات المتماثلة) إعادة التركيب الجيني وذلك خلال الانقسام المنصف.
الآلية
يتم تحفيز التأشيب الجيني بواسطة العديد من الإنزيمات المختلفة. المؤتشبات هي الإنزيمات الرئيسية التي تتوسط خطوة نقل الطاق خلال التأشيب. RecA هو المؤتشب الرئيسي في الإشريكية القولونية وهو المسؤول عن إصلاح التكسرات في طاق الحمض النووي المضاعف(DSBs) . يتطلب إصلاح التكسرات في طاق الحمض النووي المضاعف في الفطور وباقي الكائنات الأخرى حقيقية النواة وجود نوعين من الريكومبينازات. بروتين RAD51 من أجل التأشيب المتساو والمنصف، في حين أن بروتين إصلاح الحمض النووي DMC1 مخصص للتأشيب المنصف. نظير البروتين البكتيري RecA في العتائق هو RadA.
التأشيب لدى البكتيريا
- تأشيب بكتيري منتظم ونقل غير فعال للمادة الوراثية ليتم التعبير عنها
- نقل فاشل أو غير ناجح وهو نقل الحمض النووي البكتيري لمستلمي الخلايا المانحة الذين قاموا بتعيين الحمض النووي الوارد كجزء من المادة الوراثية للمستلم. تم تسجيل النقل الفاشل في التحويل والاقتران التالي. في جميع الحالات، يتم تخفيف القطعة المنقولة عن طريق وسط الزرع.[3][4][5]
التعابر الكروموسومي
يتم تسهيل إعادة التركيب الجيني لدى حقيقيات النوى خلال الانقسام المنصف عن طريق التعابر الكروموسومي. تؤدي عملية التعابر إلى إنتاج نسل يحتوي على مجموعات مختلفة من الجينات عن تلك الخاصة بوالديهم، ويمكن أن ينتج أحيانًا أليلات خيمر جديدة. ينتج عن خلط الجينات الناتج عن إعادة التركيب الجيني تباين جيني متزايد. كما يسمح أيضًا للكائنات الحية التي تتكاثر جنسياً بتجنب تصادم مولر، حيث تتراكم المحتويات الوراثية الخاصة بالسكان اللاجنسيين في عمليات الحذف الجيني بطريقة غير عكوسة.
ينطوي التعابر الكروموسومي على التأشيب بين أزواج الكروموسومات الموروثة من كل من الوالدين، والتي تحدث بشكل عام خلال الانقسام المنصف. تكون الكروماتيدات الأربعة الموجودة خلال الطور التمهيدي الأول متراصة ببعضها بشدة. في حين أن المواقع المتجانسة على أزواج الكروماتيدات الموجودة بهذا الشكل تستطيع أن تقترن ببعضها بشكل وثيق وتتبادل المعلومات الوراثية.[6]
نظراً لأن إعادة التركيب يمكن أن تحدث باحتمال صغير في أي مكان على طول الكروموسوم، فإن تكرار إعادة التركيب بين موقعين يعتمد على المسافة التي تفصل بينهما. لذلك، بالنسبة للجينات المتباعدة بما فيه الكفاية على نفس الصبغي، تكون كمية التبادل مرتفعة بدرجة كافية لتدمير الترابط بين الأليلات. ثبت أن تتبع حركة الجينات الناتجة عن عمليات التعابر مفيدة للغاية لعلماء الوراثة. نظراً لأن احتمال انفصال جينين متقاربين أقل من احتمال انفصال جينين متباعدين عن بعضهما فيمكن لعلماء الوراثة أن يستنتجوا المسافة التقريبية بين جينين على كروموسوم إذا كانوا يعرفون تواتر عمليات التعابر. يستطيع علماء الوراثة أيضاً استخدام هذه الطريقة للاستدلال وجود جينات معينة. يقال إن الجينات التي تبقى معاً أثناء إعادة التركيب تكون مرتبطة ببعضها البعض لذا يمكن أحياناً استخدام جين موجود ضمن زوج مترابط كواصم للاستدلال على وجود الجين الآخر. تستخدم هذه الطريقة عادةً لتحري وجود جين مسبب لمرض.[7]
تحدد مراقبة تواتر إعادة التركيب بين موقعين جينيين قيمة التعابر وهو تواتر التعابر بين موقعين جينيين (واصمين) ويعتمد على المسافة المشتركة بين هذين الموقعين. بالنسبة لأي مجموعة ظروف بيئية وجينية ثابتة فإن إعادة التركيب في منطقة معينة من بنية الربط (الكروموسوم) تميل إلى أن تكون ثابتة وينطبق نفس الشيء على قيمة التعابر التي تستخدم في إنشاء الخرائط الوراثية.[3][8]
التحويل الجيني
يتم في التحويل الجيني نسخ قسم من المادة الوراثية من كروموسوم إلى آخر دون أن يطرأ تغيير على الكروموسوم المتبرع. يحدث التحويل الجيني بتواتر عالي في الموقع الفعلي لعملية إعادة التركيب خلال الانقسام المنصف. إنها عملية يتم من خلالها نسخ تسلسل لولب الحمض النووي (الذي لا يطرأ عليه أي تغيير) إلى لولب آخر وهو الذي يطرأ تغيير على تسلسله. غالباً ما يتم دراسة التحويل الجيني ضمن إطار التقاطعات الفطرية[9] حيث يتم مراقبة النواتج الأربعة للانقسام المنصف بسهولة. يمكن تمييز أحداث التحويل الجيني على أنها انحرافات في الانقسام المنصف الفردي عن نمط الفصل 2: 2 العادي (مثل نمط 3: 1).
إعادة التركيب غير المماثل
يمكن أن يحصل التركيب بين متواليات الحمض النووي التي لا تحوي تسلسل متماثل. هذا من شأنه أن يسبب الإزفاء الكروموسومي الذي قد يؤدي إلى الإصابة بالسرطان.
في الخلايا البائية
تقوم الخلايا البائية التي ينتجها الجهاز المناعي بإعادة التركيب الجيني والتي تسمى هنا التأشيب البدالي الصنفي وهي آلية حيوية يتم من خلالها تغيير الصف الضدي من الصف الذي يسمى IGM مثلاً إلى IgG.
في الهندسة الوراثية
يمكن أن تشير إعادة التركيب أيضاً إلى إعادة التركيب الاصطناعي والمتعمد لقطع متباينة من الحمض النووي ومن كائنات مختلفة غالباً مما قد ينتج عنه ما يسمى الحمض النووي المؤتشب. ومن الأمثلة الرئيسية على مثل هذا الاستخدام لإعادة التركيب الجيني استهداف الجينات، والذي يمكن استخدامه لإضافة أو حذف أو تغيير جينات الكائن الحي. هذه التقنية مهمة للباحثين الطبيين الحيويين لأنها تتيح لهم الفرصة لدراسة تأثيرات جينات معينة. يتم تطبيق التقنيات المعتمدة على التأشيب الوراثي أيضاً في هندسة البروتين لتطوير بروتينات جديدة ذات أهمية بيولوجية.
الإصلاح التأشيبي
يمكن إصلاح أضرار الحمض النووي الناجمة عن العديد من العوامل الخارجية (مثل الأشعة فوق البنفسجية والأشعة السينية وعوامل الارتباط الكيميائي المتصالبة) خلال كل من الانقسام المتساو والمنصف عن طريق الإصلاح التأشيبي المتماثل(HRR).[10]
تقترح هذه النتائج بأنه يتم إصلاح أضرار الحمض النووي الناتجة عن العمليات الطبيعية كالتعرض للجذور الأوكسجينية الناتجة عن عمليات الاستقلاب الطبيعي أيضاً من خلال الإصلاح التأشيبي المتماثل. تسبب العيوب في المنتجات الجينية لدى البشر والقوارض والتي تعتبر ضرورية لعمليات الإصلاح التأشيبي المتماثل الإصابة بالعقم.[10]
تزيد العيوب في المنتجات الجينية الضرورية للإصلاح الجيني المتماثل لدى البشر مثل BRCA1 و BRCA2 من نسبة الإصابة بسرطان الثدي.
التحول الجيني لدى البكتيريا هو عملية نقل الجين التي تحصل عادةً ما بين الخلايا الفردية لنفس النوع الجرثومي. ينطوي التحول على دمج الحمض النووي المانح بكروموسومات المستقبل عن طريق إعادة التركيب. هذه العملية على ما يبدو هي إجراء تكيفي لإصلاح أضرار الحمض النووي في كروموسومات المستلم وذلك من خلال الإصلاح التأشيبي المتماثل.[11]
قد يكون التحول مفيداً للبكتيريا الممرضة من خلال السماح بإصلاح أضرار الحمض النووي وخصوصاً الأضرار التي تحصل خلال الالتهاب والبيئة المؤكسدة المرتبطة بإلحاق الضرر بالمضيف.
عندما يصيب فيروسان أو أكثر يحتويان على مادة وراثية قاتلة نفس المضيف فيمكن لهذه الفيروسات أن تقترن ببعضها البعض وتخضع للإصلاح التأشيبي المتماثل لإنتاج ذرية قابلة للحياة. تمت دراسة هذه العملية التي يشار إليها باسم التفعيل المتعدد في بكتيريا لمبدا والT4 [12] بالإضافة إلى العديد من الفيروسات الممرضة. قد يكون التفعيل المتعدد في حالة الفيروسات الممرضة ذو فائدة تكيفية للفيروس نظراً لأنه يسمح بإصلاح أضرار الحمض النووي الناجمة عن التعرض للبيئة المؤكسدة التي ينتجها المضيف كوسيلة دفاعية.
انظر أيضا
وصلات خارجية
- The Holliday Model of Genetic Recombination
- Genetic+recombination في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
مراجع
- Alberts, B. et al., Molecular Biology of the Cell, 3rd Edition. Garland Publishing, 1994.
- Mayerhofer R, Koncz-Kalman Z, Nawrath C, Bakkeren G, Crameri A, Angelis K, Redei GP, Schell J, Hohn B, Koncz C. T-DNA integration: a mode of illegitimate recombination in plants. EMBO J. 1991 Mar;10(3):697-704.
- ^ أ ب جامعة الملك عبد الله للعلوم والتقنية، تاريخ الولوج 5 يوليو 2015. نسخة محفوظة 09 أبريل 2016 على موقع واي باك مشين.
- ^ مقرر علم الأحياء للصف السادس العلمي، الطبعة الثانية 2013، صفحة 290، دولة العراق. نسخة محفوظة 25 يونيو 2017 على موقع واي باك مشين.
- ^ أ ب Rieger R. Michaelis A., Green M. M. (1976). Glossary of genetics and cytogenetics: Classical and molecular. Heidelberg - New York: Springer-Verlag. ISBN:978-3-540-07668-1.
{{استشهاد بكتاب}}: صيانة الاستشهاد: يستخدم وسيط المؤلفون (link) - ^ King R. C., Stransfield W. D. (1998). Dictionary of genetics. New York, Oxford: Oxford University Press. ISBN:978-0-19-50944-1-1.
{{استشهاد بكتاب}}: صيانة الاستشهاد: يستخدم وسيط المؤلفون (link) - ^ Bajrović K., Jevrić-Čaušević A., Hadžiselimović R., Eds (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN:978-9958-9344-1-4.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Alberts، Bruce (2002). Molecular Biology of the Cell, Fourth Edition. New York: Garland Science. ISBN:978-0-8153-3218-3.
- ^ "Access Excellence". Crossing-over: Genetic Recombination. The National Health Museum Resource Center. مؤرشف من الأصل في 2015-05-10. اطلع عليه بتاريخ 2011-02-23.
- ^ King R. C., Stransfield W. D. (1998): Dictionary of genetics. Oxford University Press, New York, Oxford, (ردمك 0-19-50944-1-7); (ردمك 0-19-509442-5).
- ^ Stacey, K. A. 1994. Recombination. In: Kendrew John, Lawrence Eleanor (eds.). The Encyclopedia of Molecular Biology. Oxford: Blackwell Science, 945–950.
- ^ أ ب Bernstein، Harris؛ Bernstein، Carol؛ E، Richard (2011). "Meiosis as an Evolutionary Adaptation for DNA Repair". DNA Repair. DOI:10.5772/25117. ISBN:978-953-307-697-3.
- ^ Michod RE، Bernstein H، Nedelcu AM (مايو 2008). "Adaptive value of sex in microbial pathogens" (PDF). Infect. Genet. Evol. ج. 8 ع. 3: 267–85. DOI:10.1016/j.meegid.2008.01.002. PMID:18295550. مؤرشف من الأصل (PDF) في 2019-11-30.
- ^ Bernstein C (مارس 1981). "Deoxyribonucleic acid repair in bacteriophage". Microbiol. Rev. ج. 45 ع. 1: 72–98. PMC:281499. PMID:6261109.
![]() تتضمن هذه المقالة مواد في الملكية العامة خاصة في NCBI - "Science Primer".
تتضمن هذه المقالة مواد في الملكية العامة خاصة في NCBI - "Science Primer".
| في كومنز صور وملفات عن: إعادة التركيب الجيني |