|
تضامنًا مع حق الشعب الفلسطيني |
ألدهيد
| ألدهيد | |
|---|---|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل |
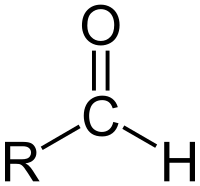
الألدهيدات هي صنف من المركبات العضوية التي تحوي مجموعة وظيفية كربونيلية وهي مجموعة فعالة لها دور كبير في التفاعلات الكيميائية، فتكون الصيغة العامة للألدهيدات R-CHO، وبهذا يتميز عن الكيتونات التي تحوي بديلين.[1][2][3] ويمثل R في الصيغة ذرة هيدروجين أو جذراً ألكيلياً وإذا أزلنا R من الصيغة العامة للألديهايد فإننا نحصل على مجموعة الفورميل (بالإنجليزية: formyl group).
تتم تسمية الالديهايدات الاليفاتيه حسب نظام الايوباك كما يأتي :
1_ يتم تحديد اسم أطول سلسلة كاربونية متصلة (مستمرة) تحتوي على مجموعة ألديهايد.
2_ ترقم السلسلة بحيث تكون ذرة الكاربون في مجموعة الالديهايد رقم 1، وليس هناك داع لتحديد مكانها عند التسمية.
الطرق المخبرية المستخدمة لتحضير الألدهيد
- أكسدة الكحولات الأولية عن طريق انتزاع الهيدروجين من الكحول الأولي بوجود عامل مساعد ومن العوامل الأكسدة الأكثر شيوعاً هي الأكسدة بواسطة حمض الكروميك.
- اختزال كلوريدات الحموض وتعرف هذه الطريقة باختزال روزن موند (بالإنجليزية: Rosenmund reduction).
الطرق الصناعية لتحضير الألدهيد
إضافة أول أكسيد الكربون والهيدروجين إلى الألكينات في وجود عامل مساعد هو الكوبالت (تفاعل أوكسو) ومن الأمثلة على ذلك اصطناع البيوتانال من البروبين.
الخواص الفيزيائية للألدهيد
يتمتع بالصفة القطبية ولذا فإن درجات غليان الأفراد الدنيا من الألدهيد أعلى من درجات الغليان المركبات الهيدروكربونية المماثلة في الوزن الجزيئي ولكنها ما زالت أقل من درجات غليان الكحولات المقابلة نظراً لعدم قدرة الألدهيدات على تكوين روابط هيدروجينية قوية بين جزيئاتها . تذوب الألدهيدات ذات الأوزان الجزيئية المنخفضة في الماء .
الكشف عن الألدهيدات
يستعمل كاشف فهلنغ للكشف عن الألدهيدات وتستعمل كذلك كواشف أخرى للكشف عن الألديهيدات مثل تفاعل تولاينس (Tollens) الذي يعتمد أساسا على تفاعل نترات الفضة في وسط أمونياكي (نترات الفضة + محلول الأمونياك) ([Ag(NH3)2]+ ; NO3-) حسب المعادلة التالية:
- R-CHO + 2Ag+(aq) + 3HO- → RCOO- + 2Ag(s) + 2H2O
وتفاعل شيف (réaction de Schiff) الذي يعتمد أساسا على تفاعل مركب عضوي معقد في وسط بارد وغير قاعدي مع الروابط الألديهيدية.
وتفاعل المركب العضوي ثنائي نيترو فينيل هيدرازين 2,4-DNPH الذي يكشف عن وجود المركبين الألدهيد والأسيتون وهو بصفة عامة يكشف عن وجود الرابطة R1(CO)R2.
انظر أيضًا
مراجع
- ^ "معلومات عن ألدهيد على موقع universalis.fr". universalis.fr. مؤرشف من الأصل في 2019-07-25.
- ^ "معلومات عن ألدهيد على موقع jstor.org". jstor.org. مؤرشف من الأصل في 2020-01-26.
- ^ "معلومات عن ألدهيد على موقع dx.doi.org". dx.doi.org. مؤرشف من الأصل في 2019-12-08.
| ألدهيد في المشاريع الشقيقة: | |