|
تضامنًا مع حق الشعب الفلسطيني |
ثيويوريا
| ثيويوريا | |
|---|---|
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Thiourea[1] |
|
| أسماء أخرى | |
Thiourea |
|
| الخواص | |
| الصيغة الجزيئية | CH4N2S |
| الكتلة المولية | 76.12 غ/مول |
| المظهر | صلب أبيض |
| الكثافة | 1.41 غ/سم3 |
| نقطة الانصهار | 176–178 °س |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | 137 غ/ل ماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
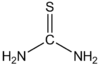
ثيويوريا هو مركب كيميائي صيغته CH4N2S، والتي يمكن كتابتها على الشكل SC(NH2)2، ويوجد على شكل صلب أبيض.
يعد الثيويوريا ذا صلة بمركب اليوريا، حيث تحل فيه ذرة كبريت مكان ذرة أكسجين.
التحضير
يحضر المركب من تسخين مركب ثيوسيانات الأمونيوم حيث يحدث توازن بين الصيغيتين:[2]
أما التحضير التقني للمركب فيمكن أن يتم انطلاقاً من تمرير كبريتيد الهيدروجين على محلول من مستعلق من سياناميد الكالسيوم:[2]
الخواص
يوجد المركب في الشروط القياسية على شكل صلب بلوري أبيض اللون؛ وهو جيد الانحلال في الماء. للمركب بنية جزيئية مستوية، ويبلغ فيها طول الرابطة C=S مقدار 1.71 أنغستروم؛ أما الرابطة C-N فيبلغ طولها 1.33 أنغستروم.[3]
التطبيقات
لا توجد الكثير من التطبيقات العملية لمركب الثيويوريا، ويمكن أن يستخدم لتحضير ثنائي أكسيد الثيويوريا، والمستخدم من ضمن المختزلات في الصناعات النسيجية.[2]
طالع أيضاً
مراجع
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: Royal Society of Chemistry. 2014. ص. 98, 864. DOI:10.1039/9781849733069. ISBN:978-0-85404-182-4.
- ^ أ ب ت Mertschenk, B.; Knott, A.; Bauer, W.: Thiourea and Thiourea Derivatives, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; دُوِي:10.1002/14356007.a26_803.pub3.
- ^ D. Mullen؛ E. Hellner (1978). "A Simple Refinement of Density Distributions of Bonding Electrons. IX. Bond Electron Density Distribution in Thiourea, CS(NH2)2, at 123K". Acta Crystallogr. ج. B34: 2789–2794. DOI:10.1107/S0567740878009243.
| ثيويوريا في المشاريع الشقيقة: | |
