|
تضامنًا مع حق الشعب الفلسطيني |
صيغة ريدبرغ
صيغة ريدبرغ تستخدم في الفيزياء الذرية لوصف الخطوط الطيفية للعديد من العناصر الكيميائية وقد صاغها العالم السويدي يوهانس رايدبيرغ وأعلنها في 5 نوفمبر 1888 .[1][2]
مجموعة خطوط لايمان
في الفيزياء والكيمياء سلسلة لايمان أو مجموعة خطوط لايمان (Lyman series) سلسلة انبعاث الأشعة فوق البنفسجية لطيف ذرة الهيدروجين عند انتقال الإلكترون من المستوى n ≥ 2 إلى 1=n) n عدد كم رئيسي ويشير إلى مستوى الطاقة للذرة) عند انتقال الإلكترون من المستوى n=2 إلى المستوى n=1 يسمى انتقال لايمان–ألفا، أما انتقال الإلكترون من المستوى n=3 إلى المستوى n=1 يسمى انتقال لايمان–بيتا، وكذلك فإن انتقال ليمان–جاما هو انتقال الإلكترون من المستوى n=4 إلى n=1 ...الخ سميت هذه السلاسل بعد أن اكتشفها لايمان Theodore Lyman في لندن عام 1934
تاريخيا
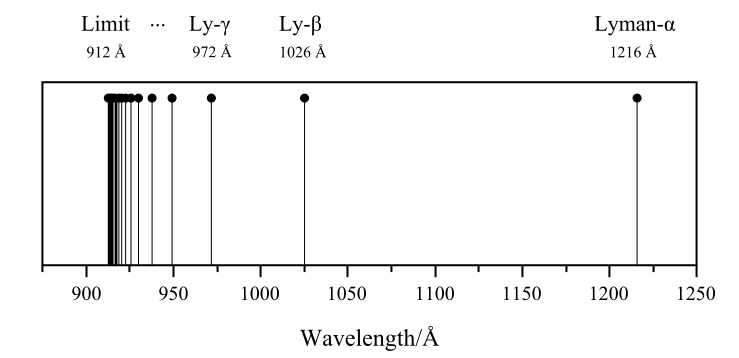
الخط الطيفي الأول من سلسلة ليمان اكتشفه الفيزيائي ثيودور لايمان Theodore Lyman من جامعة هارفارد عام 1906 ,عندما كان يدرس طيف الأشعة فوق البنفسجية لغاز الهيدروجين , الخطوط الطيفية الأخرى للأشعة الفووق بنفسجية اكتشفها ليمان لاحقا عام 1906-1914. الطيف المنبعث من من ذرة الهيدروجين طيف غير مستمر، أي تصدر الفوتونات الضوئية من الذرة ولها أطوال موجات محددة .الرسم يوضح السلسة الأولى لخطوط طيف الهيدروجين وطول موجة كل خط بالأنجستروم
تاريخيا,كان من الصعب شرح طبيعة أطياف ذرة الهيدروجين ولم يستطع أحد التنبؤ بالطول الموجي لطيف الهيدروجين حتى عام 1885, عندما وضع بالمر صيغته التجريبية لطيف الهيدروجين المرئي . في غضون خمس أعوام وضع ريدبرغ صيغة تجريبية لأول مرة عام 1888 وووضع شكلها النهائي 1890 حيث تمكنت من التنبؤ بخطوط الانبعاث لسلسة ليمان .ويمكن توليد سلسلة خطوط مختلفة من صيغة ريدبرغ باختلافات بسيطة في الأرقام .
صيغة ريدبرغ التي يمكن استنتاج مجموعة خطوط لايمان منها:
حيث n عدد طبيعي أكبر أو يساوي 2(n=2,3,4,…atc)
الجدول التالي :يوضح الأطوال الموجية للأشعة فوق بنفسجية في سلسلة ليمان
| العدد | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | ∞ |
| الطول الموجي (نانومتر) | 121.5 | 102.5 | 97.2 | 94.9 | 93.7 | 93.0 | 92.6 | 92.3 | 92.0 | 91.9 | حدليمان 91.12 |
الاستنتاج والشرح
في عام 1913 عندما وضع نيلز بور نموذجه(نموذج بور) ,الذي بين تناسب خطوط طيف الهيدروجين مع صيغة ريدبرغ، كما وضع صيغة تصف طاقة للمستوى الذي يقع فيه الإلكترون حول ذرة الهيدروجين
وفقا لافتراض بور الثالث أنه عندما يهبط الإلكترون من مستويات طاقة ابتدائية (عالية) Ei لإلى مستويات طاقة نهائية Ef فإن الذرة تصدر اشعاعات بطول موجي
وتبسيطا للشكل السابق عندما تكون وحدة الطاقة إلكترون فولت ووحدة الطول الموجي أنجستروم وباستبدال الطاقة في الصيغة السابقة بطاقة الربط ل ذرة الهيدروجين ، وبالربط بين صيغة ريدبرغ وبور وليمان واستبدال m بــ1 نحصل على صيغة ريدبرغ لمجموعة خطوط لايمان
حيث R ثابت ريدبرغ
انظر أيضا
مراجع
- ^ Bohr، N. (1985). "Rydberg's discovery of the spectral laws". في Kalckar، J. (المحرر). Collected works. Amsterdam: North-Holland Publ. Cy. ج. 10. ص. 373–379.
- ^ Ritz, W. (1908). "Magnetische Atomfelder und Serienspektren". Annalen der Physik (بDeutsch). 330 (4): 660–696. Bibcode:1908AnP...330..660R. DOI:10.1002/andp.19083300403.