ثيويوريا
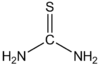
ثيويوريا هو مركب كيميائي صيغته CH4N2S، والتي يمكن كتابتها على الشكل SC(NH2)2، ويوجد على شكل صلب أبيض.
| ثيويوريا | |
|---|---|
 |
 |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Thiourea[1] |
|
| أسماء أخرى | |
Thiourea |
|
| الخواص | |
| الصيغة الجزيئية | CH4N2S |
| الكتلة المولية | 76.12 غ/مول |
| المظهر | صلب أبيض |
| الكثافة | 1.41 غ/سم3 |
| نقطة الانصهار | 176–178 °س |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | 137 غ/ل ماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
يعد الثيويوريا ذا صلة بمركب اليوريا، حيث تحل فيه ذرة كبريت مكان ذرة أكسجين.
التحضير
يحضر المركب من تسخين مركب ثيوسيانات الأمونيوم حيث يحدث توازن بين الصيغيتين:[2]
أما التحضير التقني للمركب فيمكن أن يتم انطلاقاً من تمرير كبريتيد الهيدروجين على محلول من مستعلق من سياناميد الكالسيوم:[2]
الخواص
يوجد المركب في الشروط القياسية على شكل صلب بلوري أبيض اللون؛ وهو جيد الانحلال في الماء. للمركب بنية جزيئية مستوية، ويبلغ فيها طول الرابطة C=S مقدار 1.71 أنغستروم؛ أما الرابطة C-N فيبلغ طولها 1.33 أنغستروم.[3]
التطبيقات
لا توجد الكثير من التطبيقات العملية لمركب الثيويوريا، ويمكن أن يستخدم لتحضير ثنائي أكسيد الثيويوريا، والمستخدم من ضمن المختزلات في الصناعات النسيجية.[2]
طالع أيضاً
مراجع
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: Royal Society of Chemistry. 2014. ص. 98, 864. DOI:10.1039/9781849733069. ISBN:978-0-85404-182-4.
- ^ أ ب ت Mertschenk, B.; Knott, A.; Bauer, W.: Thiourea and Thiourea Derivatives, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; دُوِي:10.1002/14356007.a26_803.pub3.
- ^ D. Mullen؛ E. Hellner (1978). "A Simple Refinement of Density Distributions of Bonding Electrons. IX. Bond Electron Density Distribution in Thiourea, CS(NH2)2, at 123K". Acta Crystallogr. ج. B34: 2789–2794. DOI:10.1107/S0567740878009243.
| ثيويوريا في المشاريع الشقيقة: | |