ثنائي أكسجينيل
ثنائي أكسجينيل هو كاتيون نادر الوجود للأكسجين له الصيغة +O2 ويكون للأكسجين حالة أكسدة مقدارها +½.
| ثنائي أكسجينيل | |
|---|---|
| أسماء أخرى | |
Dioxygenyl |
|
| المعرفات | |
| رقم CAS | 12185-07-8 |
|
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
التحضير
يحصل على هذا الأيون من عملية نزع إلكترون من الأكسجين وفق التالي:
تدعى الطاقة اللازمة لحدوث هذه العملية باسم طاقة تأين جزيء الأكسجين، وتبلغ قيمتها 1175 كيلوجول/مول.[1]
يحصل على ثنائي أكسجينيل عملياً من تفاعل الأكسجين مع سداسي فلوريد البلاتين PtF6، حيث يحصل على Dioxygenyl hexafluoroplatinate (سداسي فلورو بلاتينات ثنائي الأكسجينيل):
الخصائص
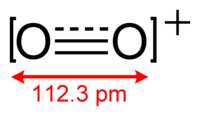
لأيون +O2 رتبة رابطة مقدارها 2.5، وطول رابطة مقدارها 112.3 بيكومتر في وسط شبكي من [O2[AsF6 الصلب،[2] وله نفس العدد من إلكترونات التكافؤ مثل أكسيد النتريك وله مغناطيسية مسايرة،[3] أما طاقة الرابطة فتبلغ 625.1 كيلوجول/مول، في حين أن تردد الامتطاط مقداره 1858 سم-1.[4]
الاستخدامات
كنتيجة لارتفاع طاقة تأين ثنائي أكسجينيل فإن الهدف من كيمياء ثنائي الأكسجينيل هو بحثي بحت، ويستخدم فقط كمؤكسد أحادي الإلكترون.[5]
المراجع
- ^ Michael Clugston; Rosalind Flemming (2000). Advanced Chemistry, Oxford University Press, ISBN 0-19-914633-0, ISBN 978-0-19-914633-8, p. 355.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419. p. 616
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ J. Shamir, J. Binenboym, H. H. Claassen (1968). "The vibrational frequency of the O2+ cation". Journal of the American Chemical Society. ج. 90 ع. 22: 6223–6224. DOI:10.1021/ja01024a054.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Foote، Christopher S.؛ Valentine، Joan S. (1995). Active oxygen in chemistry. Joel F. Liebman, A. Greenberg. Springer.
| ثنائي أكسجينيل في المشاريع الشقيقة: | |