اعتلال تاو
هذه مقالة غير مراجعة. (يوليو 2020) |
اعتلال الطوباوية هو أحد الأمراض التنكسية العصبية التي تتميز بتراكم بروتين تاو في التشابك العصبي في الدماغ البشرية. ينتج هذا التشابك من فرط فسفرة بروتين الأنابيب الدقيقة المعروفة باسم تاو، مما يتسبب في انفصال البروتين عن الأنابيب الدقيقة وتشكيل تجمعات غير قابلة للذوبان.[1] (تسمى هذه التجمعات أيضًا خيوط حلزونية مزدوجة). آلية تكوين التشابك غير مفهومة جيدًا حتى الآن، وما إذا كانت التشابك سببًا رئيسيًا لمرض الزهايمر أو تلعب دورًا هامًا غير معروف.
| Tauopathy | |
|---|---|
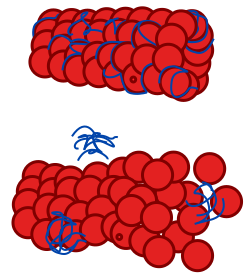
رسم تخطيطي للأنبوب الصغير الطبيعي والآخر يتأثر باعتلال الطوباوية
| |
| تعديل مصدري - تعديل |
الكشف والتصوير
- بعد الوفاة
- تشابك Tau تشابك مجهريًا في عينات الدماغ الملطخة.
مرض الزهايمر
تم وصف التشابك الليفي العصبي لأول مرة من قبل ألويس الزهايمر في أحد مرضاه الذين يعانون من مرض الزهايمر (م). تعتبر التشابك اعتلالًا ثانويًا. تصنف AD أيضًا على أنها داء النشواني بسبب وجود لويحات الشيخوخة.[3]
عندما يصبح تاو مفرط الفسفرة، ينفصل البروتين عن الأنابيب الدقيقة في المحاور.[4] بعد ذلك، يشتت تاو ويبدأ البروتين في التجمع، مما يشكل في النهاية التشابك الليفي العصبي الذي يشاهده مرضى الزهايمر. [1] تزعزع الأنابيب الدقيقة أيضًا عندما ينفصل تاو. يؤدي الجمع بين التشابك الليفي العصبي والأنابيب الدقيقة غير المستقرة إلى اضطراب في العمليات مثل النقل المحوري والاتصال العصبي.[5]
يتم تحديد درجة مشاركة NFT في م من خلال مراحل براك. يتم استخدام مرحلتي براك الأولى والثانية عندما يقتصر تدخل NFT بشكل أساسي على المنطقة العابرة للقولون في الدماغ، والمرحلتين الثالثة والرابعة عندما يكون هناك أيضًا مشاركة في المناطق الحوفية مثل الحُصين، والخامس والسادس عندما يكون هناك تدخل واسع النطاق في القشرة المخية. لا ينبغي الخلط بين هذا ودرجة مشاركة لوحة الشيخوخة، والتي تتقدم بشكل مختلف.[6]
أمراض أخرى
- اعتلال الطوباوية المرتبط بالعمر الأساسي (PART) / الخرف الليفي السائد في الخرفات السائدة في الشيخوخة، مع NFTs مشابهة لمرض الزهايمر، ولكن بدون لويحات. [3] [7] [8]
- اعتلال دماغي مزمن (CTE) [9] [10]
- الشلل التقدمي فوق النووي (PSP) [11]
- الضمور القشري (CBD)
- الخرف الجبهي الصدغي والباركنسونية المرتبطة بالكروموسوم 17 (FTDP-17) [12]
- مرض ليتيك بوديج (مجمع باركنسون - الخرف في غوام) [13]
- ورم أرومي دبقي وورم أرومي دبقي [14]
- داء الأوعية الدموية السحائي [15]
- باركنسونية ما بعد الدماغ
- التهاب الدماغ الشامل المصلب دون الحاد (SSPE) [16]
- بالإضافة إلى اعتلال دماغي بالرصاص، والتصلب الدرني، والتنكس العصبي المرتبط بالكينوزات، والعضلات الدهنية [17]
في كل من مرض بيك والانحلال القشري، يتم ترسب بروتينات تاو كجسم متضمن داخل الخلايا العصبية المتورمة أو «المنتفخة».
يتميّز مرض الحبوب المقهقر (AGD)، وهو نوع آخر من الخرف، [18] [19] [20] بوفرة من الحبوب المحبة للأرجام والأجسام الملتفة عند الفحص المجهري لأنسجة المخ.[21] يعتبره البعض نوعًا من مرض الزهايمر. قد تتعايش مع أمراض أخرى مثل الشلل التدريجي فوق النووي والنكس القشري، [3] وكذلك مرض بيك.[22]
غالبًا ما تتداخل اعتلالات Tauopathies مع اعتلال synucleinopathies ، ربما بسبب التفاعل بين synuclein وبروتينات tau.[23]
في بعض الأحيان يتم تجميع اعتلال الأعصاب غير المصاب بمرض الزهايمر معًا على أنه «معقد بيك» بسبب ارتباطه بالخرف الجبهي الصدغي، أو تنكس الفص الجبهي الجبهي.[24]
انظر أيضًا
- العلاج البدئي
المراجع
- ^ أ ب "Propagation of Tau aggregates". Molecular Brain. ج. 10 ع. 1: 18. مايو 2017. DOI:10.1186/s13041-017-0298-7. PMID:28558799.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Alzheimer 'tau' protein far surpasses amyloid in predicting toll on brain tissue نسخة محفوظة 19 فبراير 2020 على موقع واي باك مشين.
- ^ أ ب ت "Neuropathology of non-Alzheimer degenerative disorders". International Journal of Clinical and Experimental Pathology. ج. 3 ع. 1: 1–23. أغسطس 2009. PMID:19918325.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Abnormal hyperphosphorylation of tau: sites, regulation, and molecular mechanism of neurofibrillary degeneration". Journal of Alzheimer's Disease. 33 Suppl 1: S123-39. 2013. DOI:10.3233/JAD-2012-129031. PMID:22710920.
- ^ "Tau in physiology and pathology". Nature Reviews. Neuroscience. ج. 17 ع. 1: 5–21. يناير 2016. DOI:10.1038/nrn.2015.1. PMID:26631930.
- ^ "Neuropathological stageing of Alzheimer-related changes". Acta Neuropathologica. ج. 82 ع. 4: 239–59. 1991. DOI:10.1007/BF00308809. PMID:1759558.
- ^ "The MAPT H1 haplotype is associated with tangle-predominant dementia". Acta Neuropathologica. ج. 124 ع. 5: 693–704. نوفمبر 2012. DOI:10.1007/s00401-012-1017-1. PMID:22802095.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Neurofibrillary tangle-predominant dementia: comparison with classical Alzheimer disease". Acta Neuropathologica. ج. 113 ع. 2: 107–17. فبراير 2007. DOI:10.1007/s00401-006-0156-7. PMID:17089134.
- ^ "The first NINDS/NIBIB consensus meeting to define neuropathological criteria for the diagnosis of chronic traumatic encephalopathy" (PDF). Acta Neuropathologica. ج. 131 ع. 1: 75–86. يناير 2016. DOI:10.1007/s00401-015-1515-z. PMID:26667418. مؤرشف من الأصل (PDF) في 2017-09-23.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Immunocytochemistry of neurofibrillary tangles in dementia pugilistica and Alzheimer's disease: evidence for common genesis". Lancet. ج. 2 ع. 8626–8627: 1456–8. 1988. DOI:10.1016/S0140-6736(88)90934-8. PMID:2904573.
- ^ "Progressive supranuclear palsy: clinicopathological concepts and diagnostic challenges". The Lancet. Neurology. ج. 8 ع. 3: 270–9. مارس 2009. DOI:10.1016/S1474-4422(09)70042-0. PMID:19233037.
- ^ "Deciphering the genetic basis of Alzheimer's disease". Annual Review of Genomics and Human Genetics. ج. 3: 67–99. 2002. DOI:10.1146/annurev.genom.3.022502.103022. PMID:12142353.
- ^ "Amyotrophic lateral sclerosis/parkinsonism-dementia complex of Guam: quantitative neuropathology, immunohistochemical analysis of neuronal vulnerability, and comparison with related neurodegenerative disorders". Acta Neuropathologica. ج. 88 ع. 5: 397–404. 1994. DOI:10.1007/BF00389490. PMID:7847067.
- ^ "Tau-associated neuropathology in ganglion cell tumours increases with patient age but appears unrelated to ApoE genotype". Neuropathology and Applied Neurobiology. ج. 27 ع. 3: 197–205. يونيو 2001. DOI:10.1046/j.1365-2990.2001.00311.x. PMID:11489139.
- ^ "Meningio-angiomatosis: a report of six cases with special reference to the occurrence of neurofibrillary tangles". Journal of Neuropathology and Experimental Neurology. ج. 45 ع. 4: 426–46. يوليو 1986. DOI:10.1097/00005072-198607000-00005. PMID:3088216.
- ^ "Neurofibrillary changes in the cerebral cortex of a patient with subacute sclerosing panencephalitis (SSPE)". Acta Neuropathologica. ج. 48 ع. 2: 157–60. نوفمبر 1979. DOI:10.1007/BF00691159. PMID:506699.
- ^ "Alzheimer neurofibrillary tangles in diseases other than senile and presenile dementia". Annals of Neurology. ج. 5 ع. 3: 288–94. مارس 1979. DOI:10.1002/ana.410050311. PMID:156000.
- ^ "Argyrophilic grain disease". Brain. ج. 131 ع. Pt 6: 1416–32. يونيو 2008. DOI:10.1093/brain/awm305. PMID:18234698.
- ^ "Argyrophilic grains: a distinct disease or an additive pathology?". Neurobiology of Aging. ج. 29 ع. 4: 566–73. أبريل 2008. DOI:10.1016/j.neurobiolaging.2006.10.032. PMID:17188783.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "[Argyrophilic grain disease: synergistic component of dementia?]" [Argyrophilic grain disease: synergistic component of dementia?]. Revue Neurologique (بالفرنسية). 166 (4): 428–32. Apr 2010. DOI:10.1016/j.neurol.2009.10.012. PMID:19963233.
- ^ "[Argyrophilic grain disease: differentiation from Alzheimer disease]". Der Pathologe. ج. 20 ع. 3: 159–68. مايو 1999. DOI:10.1007/s002920050339. PMID:10412175.
- ^ "Dementia with grains (argyrophilic grain disease)". Brain Pathology. ج. 8 ع. 2: 377–86. أبريل 1998. DOI:10.1111/j.1750-3639.1998.tb00161.x. PMID:9546294.
- ^ "Alpha-synuclein and tau: teammates in neurodegeneration?". Molecular Neurodegeneration. ج. 9: 43. أكتوبر 2014. DOI:10.1186/1750-1326-9-43. PMID:25352339.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) والوسيط غير المعروف|last-author-amp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ "Extrapyramidal syndromes in frontotemporal degeneration". Journal of Molecular Neuroscience. ج. 45 ع. 3: 336–42. نوفمبر 2011. DOI:10.1007/s12031-011-9616-1. PMID:21887521.
روابط خارجية
| اعتلال تاو في المشاريع الشقيقة: | |