|
تضامنًا مع حق الشعب الفلسطيني |
إندين
| إندين | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
1H-Indene |
|
| تسمية الاتحاد الدولي للكيمياء | |
Bicyclo[4.3.0]nona-1,3,5,7-tetraene |
|
| أسماء أخرى | |
Indene |
|
| المعرفات | |
| رقم CAS | 95-13-6 |
| بوب كيم (PubChem) | 7219 |
| الخواص | |
| الصيغة الجزيئية | C9H8 |
| الكتلة المولية | 116.16 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.99 غ/سم3 |
| نقطة الانصهار | −2 °س |
| نقطة الغليان | 182 °س |
| الذوبانية في الماء | غير منحل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
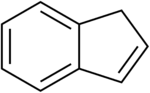
إندين[1] هو مركب كيميائي من الهيدروكربونات ثنائية الحلقة له الصيغة الكيميائية C9H8، ويكون على شكل سائل عديم اللون.
يتركب الإندين بنيوياً من حلقة بنزين مدمجة مع حلقي البنتين، وهو يشبه في تركيبه الإندان مع وجود رابطة مضاعفة، وهو بذلك من الهيدروكربونات العطرية.
الوفرة الطبيعية والتحضير
يوجد الإندين طبيعياً في قطران الفحم، ويمكن الحصول عليه من القطفات الحاوية عليه عند درجات حرارة بين 175–185 °س بالتسخين مع الصوديوم ثم بالتقطير.[2]
الخواص
يوجد الإندين في الشروط القياسية على هيئة سائل عديم اللون، وله رائحة عطرية، وهو سهل التفاعل مع نفسه حيث يوجد غالباً على شكل ديمر (ثنائي الوحدات). كما يتفاعل مع العديد من الكواشف الكيميائية ليشكل المركبات الموافقة؛ فهو يتفاعل مع أكسالات الإيثيل بوجود إيثوكسيد الصوديوم ليشكل إستر إندين أوكساليك، كما يتفاعل مع الألدهيدات والكيتونات بوجود قلوي ليشكل بنزوالفولفينات.
الاستخدامات
يستخدم الإندين في الكيمياء العضوية الفلزية وذلك كربيطة، وله دور مهم في التحفيز المتجانس، كما يستخدم في تحضير الآزولين.
اقرأ أيضاً
المراجع
- ^ Q113378673، ص. 259، QID:Q113378673
- ^ Gerd Collin, Rolf Mildenberg, Mechthild Zander, Hartmut Höke, William McKillip, Werner Freitag, Wolfgang Imöhl “Resins, Synthetic” Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2000.
| في كومنز صور وملفات عن: إندين |