|
تضامنًا مع حق الشعب الفلسطيني |
هيستون أسيتيل ترانسفيراز
إنزيمات هيستون أسيتيل ترانسفيراز ( HATs )Histone acetyltransferases هي إنزيمات تؤستل بحفظ الأحماض الأمينية الليسين على بروتينات هيستون عن طريق نقل مجموعة الأسيتيل من أسيتيل كو-أ لتكوين ε- N -أسيتليسين. يلتف الحمض النووي حول الهستونات، ومن خلال نقل مجموعة الأسيتيل إلى الهستونات، يمكن تشغيل الجينات وإيقافها. بشكل عام، أستلة هيستون تزيد من التعبير الجيني.
بشكل عام، يرتبط أستيل الهستون بتنشيط النسخ ويرتبط بالكروماتين الحقيقي . يسمح الكروماتين الحقيقي، وهو أقل كثافة، لعوامل النسخ بالارتباط بسهولة أكبر بالمواقع التنظيمية على الحمض النووي، مما يتسبب في تنشيط النسخ. عندما تم اكتشافه لأول مرة، كان يُعتقد أن أستلة اللايسين تحيد الشحنة الموجبة الموجودة عادة، وبالتالي تقلل التقارب بين الهيستون والحمض النووي (المشحون سالبًا)، مما يجعل الحمض النووي أكثر سهولة في الوصول إلى عوامل النسخ . أظهرت الأبحاث منذ ذلك الحين أن أستلة اللايسين وغيرها من تعديلات الهستونات بعد الترجمة تولد مواقع ربط لمجالات تفاعل محددة بين البروتين -بروتين، مثل مجال البرومودومين المرتبط بالأسيتليسين.[بحاجة لمصدر] . يمكن أيضًا أن يقوم هيستون أسيتيل ترانسفيراز بأستلة البروتينات غير الهيستونية، مثل المستقبلات النووية وعوامل النسخ الأخرى لتسهيل التعبير الجيني.
عائلات هيستون أسيتيل ترانسفيراز
تنقسم عائلات هيستون أسيتيل ترانسفيراز إلى فئتين مختلفتين بناءً على موقعها في الخلية. [2] توجد '''هات ''' (هيستون أسيتيل ترانسفيراز) من النوع A في النواة وتشارك في تنظيم التعبير الجيني من خلال أستلة الهستونات النووية في سياق الكروماتين. [3] أنها تحتوي على برومودومين ، مما يساعدهم على التعرف على بقايا الليسين المؤستل وربطه على ركائز الهيستون. تعد Gcn5 و p300/CBP وTAFII250 بعض الأمثلة لـ HATs من النوع A التي تتعاون مع المنشطات لتحسين النسخ. توجد هات من النوع B في السيتوبلازم وتكون مسؤولة عن أستلة الهستونات المصنعة حديثًا قبل تجميعها في النيوكليوسومات . تفتقر هذه هيستونات أسيتيل ترانسفيراز إلى مجال البرومودومين، حيث أن أهدافها ليست مؤستلة. تتم إزالة مجموعات الأسيتيل المضافة بواسطة النوع B HATs إلى الهستونات بواسطة HDACs بمجرد دخولها النواة ويتم دمجها في الكروماتين . هيستون أسيتيل ترانسفيراز 1 هو أحد الأمثلة القليلة المعروفة لهيستونات أسيتيل ترانسفيراز النوع B. [4] على الرغم من هذا التصنيف التاريخي لـ HAT، تعمل بعض بروتينات HAT في معقدات متعددة أو في مواقع متعددة، وبالتالي لا يمكن وضعها بسهولة في فئة معينة. [5]

N-أسيتيل ترانسفيراز (GNATs) المرتبطة بـ Gcn5
يمكن تجميع HATs في عدة عائلات مختلفة بناءً على التماثل التسلسلي بالإضافة إلى الميزات الهيكلية المشتركة والأدوار الوظيفية. تشتمل عائلة N -أسيتيلترانسفيراز (GNAT) المرتبطة بـ Gcn5 على Gcn5 و PCAF وHat1 و Elp3 وHpa2 وHpa3 و ATF-2 و Nut1. تتميز هذه الـ HATs بشكل عام بوجود البرومودومين، وقد وجدت أنها تقوم بأستلة الليسين على الهستونات H2B ، هستون هـ3 ، [6] و H4 . [7] يتميز جميع أفراد عائلة GNAT بما يصل إلى أربعة أشكال محفوظة (AD) موجودة ضمن مجال HAT التحفيزي. يتضمن ذلك الشكل A الأكثر حفظًا، والذي يحتوي على تسلسل Arg/Gln-XX-Gly-X-Gly/Ala وهو أمر مهم للتعرف على الأسيتيل-CoA وربطه. [8] تم العثور على الشكل C في معظم GNATs، لكنه غير موجود في غالبية HATs المعروفة الأخرى. [9] الخميرة Gcn5 (التحكم العام غير القابل للضغط -5) HAT هي واحدة من أفضل أعضاء هذه العائلة. يحتوي على أربعة مجالات وظيفية، بما في ذلك مجال الطرف-N، ومجال محفز محفوظ (HAT)، ومجال تفاعل Ada2، ومجال برومودومين الطرف-C. PCAF (العامل المرتبط بـ p300 / CBP) و GCN5 عبارة عن GNAT للثدييات تشترك في درجة عالية من التماثل خلال تسلسلاتها. تحتوي هذه البروتينات على منطقة الطرف-- مكونة من 400 بقايا وهي غائبة في الخميرة Gcn5، لكن وظائف HAT الخاصة بها محفوظة تطوريًا فيما يتعلق بالأخيرة. كان Hat1 أول بروتين HAT يتم تحديده. وهو مسؤول عن معظم نشاط HAT السيتوبلازمي في الخميرة، ويرتبط بقوة بالهيستون H4 بحكم ارتباطه بوحدة فرعية إضافية، Hat2. Elp3 هو مثال على نوع A HAT الموجود في الخميرة. وهو جزء من إنزيم RNA بوليميريز II ويلعب دورًا في استطالة النسخ.
MYST هيستون أسيتيل ترانسفيراز
تمت تسمية عائلة HATs MYST على اسم أعضائها المؤسسين الأربعة MOZ وYbf2 (Sas3) وSas2 و Tip60 . [7] ومن بين الأعضاء المهمين الآخرين Esa1 ، و MOF ، و MORF ، و HBO1 . تتميز هذه" الهاتات" عادةً بوجود أصابع الزنك ومجالات الكرومودومين ، وقد تم العثور عليها بقايا أإستيلات الليسين على الهستونات H2A ، H3، وH4. كما تحتوي العديد من بروتينات عائلة MYST على أصابع الزنك بالإضافة إلى الشكل المحفوظ دائما A الموجود في GNATs والذي يسهل ربط الأسيتيل كو-أ. [8] توجد منطقة غنية بالسيستين في الطرف -N من مجال HAT لبروتينات MYST تشارك في ربط الزنك، وهو أمر ضروري لنشاط هات. [10] كان Tip60 (بروتين Tat التفاعلي، 60 كيلو دالتون) أول عنصر بشري في عائلة MYST يُظهر نشاط هات. Sas3 الموجود في الخميرة هو مماثل لـ MOZ (بروتين إصبع الزنك لسرطان الدم الوحيد)، وهو أحد الجينات المسرطنة الموجودة في البشر. كان Esa1 هو أول هات أساسي يتم العثور عليه في الخميرة، والإطار العضوي العضوي (MOF) هو نظيره في ذباب الفاكهة. إن نشاط هات للأخير مطلوب من أجل النسخ المتزايد للكروموسوم الذكري X ( تعويض الجرعة ) في الذباب. كان HBO1 البشري (هات المرتبط بـ ORC1) هو أول HAT يُظهر ارتباطه بمكونات أصل معقد النسخ . يُظهر MORF (العامل المرتبط بـ MOZ) تماثلًا وثيقًا مع MOZ بطوله الكامل. [9] فهو يحتوي على منطقة قمع طرف- N تقلل من نشاط هات في المختبر بالإضافة إلى مجال تنشيط الطرف-C الذي يعمل في غياب مجال HAT.
آخرون
بالإضافة إلى تلك التي تنتمي إلى عائلتي GNAT وMYST، هناك العديد من البروتينات الأخرى الموجودة عادةً في حقيقيات النوى الأعلى والتي تظهر نشاط HAT. وتشمل هذه p300/CBP، ومنشطات المستقبلات النووية (على سبيل المثال، ACTR/SRC-1)، وTAF II 250، وTFIIIC، وRtt109 ،و CLOCK . و بالنسبة إلى p300/CBP فهو خاص بالميتازوان [11] ويحتوي على عدة مناطق لأصابع الزنك، ومجال برومودومين، ومجال تحفيزي (HAT)، ومناطق تتفاعل مع عوامل النسخ الأخرى. [8] الأهم من ذلك، أن "مجال هات" لا يُظهر أي تماثل تسلسلي لـ HATs المعروفة الأخرى، [12] وهو مطلوب لكي يعمل p300/CBP على تنشيط النسخ. [4] بالإضافة إلى ذلك، تحتوي هذه البروتينات على العديد من نماذج مجال هات (A، B، وD) التي تشبه تلك الموجودة في GNATs. كما أنها تمتلك نموذج جديد E تشبه التسلسلات الموجودة في مجالات HAT الخاصة بـ GNATs. كذلك TFIIIC هو أحد عوامل النسخ العامة المشاركة في النسخ بوساطة بوليميراز RNA III . لقد ثبت أن ثلاثة مكونات في البروتين البشري تمتلك نشاط هات مستقل ( hTFIIIC220 ، hTFIIIC110 ، و hTFIIIC90 ). [13] Rtt109 عبارة عن HAT خاص بالفطريات ويتطلب الارتباط مع بروتينات هيستون مرافقة للنشاط. [11] لم تتم دراسة أنشطة هات الخاصة بمنشطات TAF II 250 وCLOCK البشرية على نطاق واسع. TAF II 250 هي إحدى الوحدات الفرعية للعامل المرتبط بـ TBP لـ TFIID ، وهي تشترك في نمط Gly-X-Gly مع Gcn5 المهم لنشاط [9] هات . CLOCK هو منظم رئيسي لإيقاع الساعة البيولوجية التي تعمل مع BMAL1 لتنفيذ نشاط هات الخاص به. [14]
منشطات المستقبلات النووية
ثلاثة منشطات مستقبلات نووية مهمة تعرض نشاط HAT هي SRC-1 و ACTR و TIF-2 . من المعروف أن في الإنسان SRC-1 (منشط مستقبل الستيرويد-1) يتفاعل مع p300/CBP وPCAF، ويقع مجال HAT الخاص به في منطقة الطرف-C الخاصة به. ويشترك ACTR (المعروف أيضًا باسم RAC3 و AIB1 و TRAM-1 في البشر) في تماثل تسلسلي مهم مع SRC-1، ولا سيما في مناطق الطرف- N الطرف والطرف- C في هات. وكذلك في مجالات تفاعل المستقبل والمنشط. . [9] يتفاعل ACTR أيضًا مع p300/CBP وPCAF. يمكن للأول أن يمنع ACTR من الارتباط بمستقبله وتنشيطه عن طريق أستيله في مجال تفاعل المستقبل الخاص به. TIF-2 (العامل الوسيط النسخي 2؛ المعروف أيضًا باسم GRIP1) هو منشط مستقبلات نووية آخر مع نشاط HAT، ويتفاعل أيضًا مع p300/CBP.
ويرد أدناه جدول يلخص عائلات HATs المختلفة إلى جانب الأعضاء المرتبطين بها، والكائنات الأم، والمعقدات متعددة الوحدات، وركائز الهيستون، والسمات الهيكلية. [7] [9] [15] [16] [17] [18] [19] [20] [21] [22]
الهيكل العام

بشكل عام تتميز HATs بمنطقة أساسية محفوظة هيكليًا مكونة من صفائح بيتا ثلاثية الجدائل يتبعها حلزون ألفا طويل موازٍ ويمتد على جانب واحد منها. [23] [15] المنطقة الأساسية، التي تتوافق مع الأشكال A وB وD لبروتينات GNAT، [8] محاطة من الجانبين المتقابلين بقطاعات α/β الطرفية N وC والتي تعتبر فريدة من الناحية الهيكلية لعائلة هات معينة. [10] [11] يشكل اللب المركزي والأجزاء المحيطة به شقًا فوق الأول، وهو المكان الذي يمكن أن ترتبط فيه ركائز الهيستون قبل التحفيز. [11] في حين أن المجال الأساسي المركزي (الشكل A في GNATs) يشارك في ربط الأسيتيل-كو-أ والتحفيز، فإن الأجزاء الطرفية N وC تساعد في ربط ركائز الهيستون. [10] قد تساعد الميزات الفريدة المتعلقة بتسلسل و/أو بنية مناطق N وC لعائلات هات المختلفة في تفسير بعض الاختلافات الملحوظة بين "الهاتات" (HATs) في خصوصية ركيزة هيستون. وقد لوحظ أن ربط كو-أ يعمل على توسيع أخدود ربط هيستون في القلب المركزي عن طريق تحريك الجزء C- الطرفي من Gcn5 إلى الخارج. بالإضافة إلى ذلك، نظرًا لأن الاتصالات بين CoA والبروتين تسهل تكوين اتصالات مواتية بين بروتين هيستون، فمن المحتمل أن يسبق ربط كو-أ ربط هيستون في الجسم الحي .
عائلات GNAT وMYST
تتميز HATs في عائلة GNAT بشكل ملحوظ بنطاق هات مكون من 160 بقية تقريبًا وبرومودومين طرفي C، والذي يرتبط ببقايا ليسين الأسيتيلية. [23] تلك الموجودة في عائلة MYST لديها نطاقات هات يبلغ طولها حوالي 250 وحدة بنائية. تحتوي العديد من بروتينات MYST أيضًا على مجال ربط غني بالسيستين والزنك داخل منطقة هات بالإضافة إلى كرومودومين طرفي N، والذي يرتبط ببقايا الليسين الميثيلية .
على نطاق أوسع، تظهر هياكل المجالات التحفيزية لبروتينات GNAT (Gcn5، PCAF) طية كروية α/β مختلطة بإجمالي خمس حلزونات α وستة خيوط-β. [8] تشبه البنية العامة الملزمة ، حيث يوجد النواة المركزية للبروتين في القاعدة والقطاعات الطرفية N وC على الجانبين.
عائلة p300/CBP
تحتوي HATs p300/CBP على مجالات هات أكبر (حوالي 500 وحدة بنائية) من تلك الموجودة في عائلات GNAT وMYST. [23] كما أنها تحتوي على برومودومين بالإضافة إلى ثلاثة مجالات غنية بالسيستين/الهيستيدين والتي يُعتقد أنها تتوسط التفاعلات مع البروتينات الأخرى. يتميز هيكل p300 / CBP بمجال كروي ممدود (بيضوي) ، والذي يحتوي على شريحة بيتا مكونة من سبعة خيوط في المركز محاطة بتسعة حلزونات-ألفا وعدة حلقات. [24] يتم الحفاظ على بنية المنطقة الأساسية المركزية المرتبطة بربط أسيتيل كو-أ بالنسبة لـ GNAT وMYST HATs، ولكن هناك العديد من الاختلافات الهيكلية في المناطق المحيطة بهذه النواة المركزية. بشكل عام تتوافق البيانات الهيكلية مع حقيقة أن p300/CBP HATs أكثر اختلاطًا من GNAT وMYST HATs فيما يتعلق بربط الركيزة.
Rtt109
إن هيكل Rtt109 مشابه جدًا لهيكل p300، على الرغم من وجود تكوين تسلسلي بنسبة 7٪ فقط بين البروتينين. [24] هناك صفائح-بيتا ذات سبعة جدائل محاطة بحلقات ألفا بالإضافة إلى حلقة تشارك في ربط ركيزة أسيتيل كو-أ. على الرغم من البنية المحفوظة، فإن Rtt109 وp300/CBP فريدان من الناحية الوظيفية. على سبيل المثال، موقع ربط الركيزة الأول يشبه إلى حد كبير موقع GNAT وMYST HATs. بالإضافة إلى ذلك، فإن البقايا الموجودة في الموقع النشط لكل إنزيم متميزة، مما يشير إلى أنها تستخدم آليات تحفيزية مختلفة لنقل مجموعة الأسيتيل.
الآليات التحفيزية
تتضمن الآلية الأساسية التي تحفزها HATs نقل مجموعة الأسيتيل من أسيتيل كو-أ إلى مجموعة ε-أمين لسلسلة جانبية ليسين مستهدفة داخل هيستون. [15] تستخدم عائلات هات المختلفة استراتيجيات فريدة من أجل إحداث مثل هذا التحول.

عائلة جنات
يمتلك أفراد عائلة GNAT بقايا غلوتامات محفوظة تعمل كقاعدة عامة لتحفيز الهجوم المحب للنواة لأمين اللايسين على رابطة ثيوستر الأسيتيل كو-أ . [15] تستخدم هذه الـ HATs آلية ثنائية- ثنائية ( bi-bi )متسلسلة مرتبة حيث يجب أن ترتبط كلا الركيزتين (أسيتيل مرافق الإنزيم-أ والهيستون) لتكوين مركب ثلاثي مع الإنزيم قبل أن يحدث التحفيز. يرتبط أسيتيل كو-أ أولاً، يليه ركيزة الهيستون. تعمل بقايا الغلوتامات المحفوظة (Glu173 في الخميرة Gcn5) على تنشيط جزيء الماء لإزالة بروتون من المجموعة الأمينية على الليسين، مما ينشطه لهجوم مباشر محب للنواة على كربون الكربونيل في الأسيتيل كو-أ المرتبط بالإنزيم. ويتم بعد التفاعل إطلاق هستون الأسيتيل أولاً يليه كو-أ . [8] [11]
عائلة ميست
كشفت الدراسات التي أجريت على الخميرة Esa1 من عائلة MYST من HATs عن آلية بينج بونج تتضمن بقايا الغلوتامات والسيستين المحفوظة. [25] يتضمن الجزء الأول من التفاعل تكوين وسيط تساهمي حيث تصبح بقايا السيستين أسيتيل بعد الهجوم المحب للنواة لهذه البقايا على كربون الكربونيل في أسيتيل كو-أ. بعد ذلك، تعمل بقايا الغلوتامات كقاعدة عامة لتسهيل نقل مجموعة الأسيتيل من السيستين إلى ركيزة الهيستون بطريقة مشابهة للآلية المستخدمة بواسطة GNATs. عندما يتم تجميع Esa1 في مركب بيكولو NuA4 ، فإنه يفقد اعتماده على بقايا السيستين للتحفيز، مما يشير إلى أن التفاعل قد يستمر عبر آلية bi-bi ثلاثية عندما يكون الإنزيم جزءًا من مركب متعدد البروتينات ذي صلة من الناحية الفسيولوجية.
عائلة p300/CBP
في p300 البشري، يعمل Tyr1467 كحمض عام ويساعد Trp1436 في توجيه بقايا اللايسين المستهدفة من ركيزة هيستون إلى الموقع النشط. [15] يتم حفظ هاتين المخلفات بشكل كبير ضمن عائلة p300/CBP هات، وعلى عكس الإنزيمات الموجودة في عائلات GNAT وMYST، لا يستخدم p300 قاعدة عامة للتحفيز الكيميائي. بدلاً من ذلك، من المحتمل أن تستخدم أفراد عائلة p300/CBP آلية نقل الأسيتيل Theorell-Chance (آلية "الضرب والهروب").
Rtt109
من المرجح أن يستخدم Rtt109 آلية مختلفة عن تلك الخاصة بـ HATs الأخرى. [24] يمتلك إنزيم الخميرة نشاطًا تحفيزيًا منخفضًا للغاية في غياب بروتينات الهيستون المرافقة Asf1 وVps75، والتي قد تشارك في توصيل ركائز الهيستون إلى الإنزيم من أجل الأستلة. [15] علاوة على ذلك، لم يتم بعد تحديد حمض أو قاعدة عامة لهذه الـ هات .
ربط الركيزة وخصوصيتها
تكشف هياكل العديد من مجالات HAT المرتبطة بأسيتيل كو-أ وببتيدات ركيزة الهيستون أن الأخير يرتبط عبر أخدود في البروتين الذي يتكون من المنطقة المركزية الداخلية في القاعدة ويحيط به من الجانبين المتقابلين المتغيران الطرفان N وC - الأجزاء الطرفية التي تتوسط غالبية التفاعلات مع الببتيد الركيزة. [15] من المحتمل أن تكون هذه المناطق المتغيرة مسؤولة جزئيًا عن الخصوصية الملحوظة للـ هاتات المختلفة لمختلف ركائز الهيستون.
يُظهر أعضاء عائلات GNAT و MYST وكذلك Rtt109 انتقائية أكبر للركيزة مقارنة بـ p300 / CBP ، وهو أمر غير عادي إلى حد ما فيما يتعلق بربط الركيزة. [15] في حين يبدو أن ثلاثة إلى خمسة بقايا فقط على جانبي الليسين المراد أستيلتها ضرورية لربط الركيزة الفعال والتحفيز من قبل أعضاء عائلات GNAT و p300 / CBP، قد تكون المناطق البعيدة من الركيزة مهمة للأستلة الفعالة بواسطة هاتات عائلية من MYST. [26]
انتقائية اللايسين
لقد ثبت أن HATs المختلفة، عادة في سياق المعقدات متعددة الوحدات تعمل على أستلة بقايا ليسين معينة في الهستونات.
عائلة جنات
لا يستطيع Gcn5 أستلة الهيستونات النووية في غياب عوامل البروتين الأخرى. [9] في سياق معقدات مثل SAGA وADA يكون Gcn5 قادر ا على أستلة H3K14 من بين مواقع أخرى داخل الهيستونات H2B، H3، وH4 (على سبيل المثال، H3K9، H3K36، H4K8، H4K16). [27] [8] [23] [28] يتمتع كل من Gcn5 وPCAF بأقوى تفضيل للموقع لـ H3K14، إما كهيستون حر أو داخل جسيم نووي. [4] [10] Hat1 تؤستل Hat1 H4K5 وH4K12، و Hpa2 تؤستل H3K14 في المختبر . [4] [5]
عائلة ميست
في الذباب، يرتبط أستلة H4K16 على كروموسوم X الذكري بواسطة MOF في سياق معقد MSL بتنظيم النسخ كآلية لتعويض الجرعة في هذه الكائنات. [7] في البشر، ينفذ معقد MSL غالبية أستلة H4K16 على مستوى الجينوم. وفي سياق المعقدات المشابهة، يقوم Sas2 (SAS) وEsa1 (NuA4) أيضًا بإجراء أستلة H4K16، خاصة في مناطق التيلومير في الكروموسومات. ويلاحظ أيضًا أن Sas2 يقوم بأستلة H3K14 في المختبر على الهستونات الحرة. [29] يمكن لـ Esa1 أيضًا أستلة H3K14 في المختبر على الهستونات الحرة وكذلك H2AK5 وH4K5 وH4K8 وH4K12 إما في المختبر أو في الجسم الحي على الهستونات النووية. ويلاحظ أيضًا أن H2AK7 و H2BK16 يتم أستلتهما بواسطة Esa1 في الجسم الحي . والجدير بالذكر أنه لا يمكن لأي من Sas2 أو Esa1 أستلة الهستونات النووية في المختبر باعتبارها إنزيمًا حرًا. وهذا هو الحال أيضًا بالنسبة لـ Sas3، والذي لوحظ أنه يؤستل H3K9 وH3K14 في الجسم الحي ، بالإضافة إلى بقايا اللايسين على H2A وH4. يمكن لـ MOZ أيضًا أستلة H3K14. [28]
آخرون
p300 / CBP يؤستل (acetylate) جميع الهستونات الأساسية النووية الأربعة بشكل جيد على قدم المساواة. [8] في المختبر ، لوحظ أنه يؤستل H2AK5، H2BK12، H2BK15، H3K14، H3K18، H4K5، وH4K8. [9] كذلك SRC-1 يؤستل H3K9 وH3K14، و
TAF II 230 (في ذبابة الفاكهة تماثل TAF II 250 البشري) يؤستل H3K14، وRtt109 يؤستل
، H3K23 ،H3K9 [28] ؛ وكذلك H3K56 في وجود إما Asf1 أو Vps75. [24]
ركائز غير هيستونية ( في المختبر )
بالإضافة إلى الهستونات الأساسية، تقوم بعض HATs بأستلة عدد من البروتينات الخلوية الأخرى بما في ذلك المنشطات النسخية ، وعوامل النسخ القاعدية ، والبروتينات الهيكلية، والبوليامينات ، والبروتينات المشاركة في الاستيراد النووي. [8] يمكن أن تؤدي أستلة هذه البروتينات إلى تغيير قدرتها على التفاعل مع الحمض النووي المشابه لها و/أو ركائز البروتين. أدت فكرة أن الأسيتيل يمكن أن يؤثر على وظيفة البروتين بهذه الطريقة إلى تفكير بشأن دور ناقلات الأسيتيل في مسارات نقل الإشارة وما إذا كان من الممكن إجراء تشبيه مناسب لأحداث الكينازات والفسفرة في هذا الصدد.
PCAF
PCAF وp300/CBP هما HATs الرئيسيان اللذان لوحظ أنهما يعملان على أستلة عدد من البروتينات غير الهيستونية. بالنسبة لـ PCAF، تشمل هذه بروتينات الكروماتين غير الهيستوني ( المجموعة عالية الحركة (HMG) ) HMG-N2/HMG17 و HMG-I(Y) والمنشطات النسخية p53 و MyoD و E2F(1-3) و HIV Tat . وعوامل النسخ العامة TFIIE و TFIIF . [9] تشمل البروتينات الأخرى CIITA ، وBrm (معيد تشكيل الكروماتين)، و NF-κB (p65)، و TAL1/SCL ، و Beta2/NeuroD ، و C/EBPβ ، و IRF2 ، وIRF7 ، و YY1 ، و KLF13 ، و EVI1 ، وAME، و ER81 ، ومستقبلات الأندروجين (AR) ) . [30] وقد لوحظ أيضًا أن PCAF يحتوي على أسيتيل c-MYC و GATA-2 والورم الأرومي الشبكي (Rb) و Ku70 وبروتين الفيروس الغدي E1A . [31] يمكنه أيضًا أن يقوم بتكوين أسيتيل تلقائي، مما يسهل التفاعلات داخل الجزيئات مع مجال البرومو الخاص به والذي قد يشارك في تنظيم نشاط HAT الخاص به. [8]
p300/CBP
تحتوي p300/CBP على العديد من الركائز غير الهيستونية، بما في ذلك بروتينات الكروماتين غير الهيستونية HMG1 ، وHMG-N1/HMG14 ، وHMG-I(Y)، والمنشطات النسخية p53، وc-Myb ، و GATA-1 ، وEKLF ، و TCF ، وHIV Tat، ومنشطات المستقبلات النووية ACTR، وSRC-1، وTIF-2، وعوامل النسخ العامة TFIIE وTFIIF. [9] تشمل الركائز الأخرى عوامل النسخ Sp1، و KLF5 ، وFOXO1 ، و MEF2C ، و SRY ، و GATA-4 ، و HNF-6 ، [29] HMG-B2 ، [32] STAT3 ، ومستقبلات الاندروجين والإستروجين (α) ، GATA-2، GATA-3 ، MyoD، E2F(1-3)، p73 α، الورم الأرومي الشبكي (Rb)، NF-κB (p50، p65)، Smad7 ، importin-α ، Ku70، YAP1 ، [33] بروتين الفيروس الغدي E1A، وS- HDAG ( مستضد دلتا الصغير لفيروس التهاب الكبد الوبائي). [31] وقد لوحظ أيضًا أن p300/CBP يحتوي على أسيتيل β-كاتينين ، و RIP140 ، وPCNA ، والإنزيمات الأيضية للحمض النووي (DNA) ترفرف نوكلياز-1 ، وثيمين جليكوسيلاز الحمض النووي ، ومتلازمة فيرنر DNA هيليكاز ، STAT6 ، Runx1 (AML1) ، UBF، Beta2/ NeuroD، CREB ، c-Jun ، C/EBPβ، NF-E2 ، SREBP ، IRF2، Sp3 ، YY1، KLF13، EVI1، BCL6 ، HNF-4 ، ER81 و FOXO4 (AFX) . [34]
معقدات HAT متعددة الوحدات
وقد لوحظ تشكيل مجمعات متعددة الوحدات لتعديل خصوصية الركيزة للقبعات. [29] بشكل عام، في حين أن HATs المؤتلفة قادرة على أستلة الهستونات الحرة، فإن HATs يمكنها أستلة الهستونات النووية فقط عندما تكون في مجمعات HAT الخاصة بها. [9] تعمل بعض البروتينات المرتبطة بـ HATs في هذه المجمعات عن طريق استهداف مجمع HAT للجسيمات النووية في مناطق محددة في الجينوم . [7] [17] على سبيل المثال، لوحظ أن مجمعات HAT (على سبيل المثال SAGA، NuA3) غالبًا ما تستخدم الهستونات الميثيلية كمواقع لرسو السفن بحيث يمكن للوحدة الفرعية HAT الحفزية تنفيذ أستلة هيستون بشكل أكثر فعالية. [2]
بالإضافة إلى ذلك، فإن تكوين مجمعات HAT متعددة الوحدات يؤثر على خصوصية الليسين في HATs. [29] قد تصبح بقايا اللايسين المحددة التي تحتوي على أسيتيلات HAT إما أوسع أو أكثر تقييدًا في النطاق عند الارتباط مع المجمع الخاص بها. على سبيل المثال، تصبح خصوصية اللايسين لعائلات MYST تجاه ركائز الهيستون الخاصة بها أكثر تقييدًا عندما ترتبط بمجمعاتها. في المقابل، يكتسب Gcn5 القدرة على أستيل مواقع متعددة في كل من الهستونات H2B وH3 عندما ينضم إلى وحدات فرعية أخرى لتكوين مجمعات SAGA وADA. [8] علاوة على ذلك، فإن خصوصية موقع الأستيل لـ Rtt109 يتم تحديدها من خلال ارتباطها إما بـ Vps75 أو Asf1. [28] عندما يكون Rtt109 معقدًا مع الأول، فإنه يقوم بأسيتيل H3K9 وH3K27، ولكن عندما يكون معقدًا مع الأخير، فإنه يقوم بشكل تفضيلي بأسيتيل H3K56. [15]
تنظيم نشاط HAT
يتم تنظيم النشاط التحفيزي لـ HATs من خلال نوعين من الآليات: (1) التفاعل مع الوحدات الفرعية للبروتين التنظيمي و (2) الأسيتيل الذاتي. [15] قد يتم تنظيم HAT معين بطرق متعددة، وقد يؤدي نفس المؤثر في الواقع إلى نتائج مختلفة في ظل ظروف مختلفة. [8] على الرغم من أنه من الواضح أن ارتباط HATs بمجمعات متعددة البروتينات يوفر آلية لتنظيم نشاط HAT وخصوصية الركيزة في الجسم الحي ، إلا أن الأساس الجزيئي لكيفية حدوث ذلك فعليًا لا يزال غير معروف إلى حد كبير. [11] ومع ذلك، تشير البيانات إلى أن الوحدات الفرعية المرتبطة قد تساهم في التحفيز جزئيًا على الأقل عن طريق تسهيل الارتباط الإنتاجي لمجمع HAT مع ركائز الهيستون الأصلية.
لقد ثبت أن عائلة MYST المكونة من HATs وp300/CBP وRtt109 يتم تنظيمها عن طريق الأسيتيل الذاتي. [15] يتم إجراء الأسيتيل تلقائيًا على وزارة المالية البشرية وكذلك الخميرة Esa1 وSas2 في بقايا ليسين في الموقع النشط المحفوظ، وهذا التعديل مطلوب لوظيفتها في الجسم الحي . يحتوي الإنسان p300 على حلقة أساسية للغاية مدمجة في منتصف مجال HAT الخاص به، والتي تكون مفرطة الأسيتيل في الشكل النشط للإنزيم. [11] [24] لقد تم اقتراح أنه عند الاستيل الذاتي، يتم تحرير هذه الحلقة من موقع ربط الركيزة السالبة كهربيًا حيث توجد في HAT غير النشطة. [35] مطلوب أيضًا أستلة الخميرة Rtt109 في Lys290 لإظهار النشاط الحفاز الكامل. [36] يتم أيضًا تثبيط بعض HATs عن طريق الأسلة. على سبيل المثال، يتم تثبيط نشاط HAT لمنشط المستقبل النووي ACTR عند الأستلة بواسطة p300/CBP. [8]
التفاعل مع HDACs
يتم تجنيد هيستون أسيتيل ترانسفيراز (HATs) وديستيل هيستون (HDACs) للمروجين المستهدفين من خلال التفاعلات الجسدية مع عوامل النسخ الخاصة بالتسلسل. تعمل عادةً ضمن مجمع متعدد الوحدات تكون فيه الوحدات الفرعية الأخرى ضرورية لتعديل بقايا الهستونات حول موقع الارتباط. يمكن لهذه الإنزيمات أيضًا تعديل البروتينات غير الهيستونية.
الدور البيولوجي
إعادة تشكيل الكروماتين
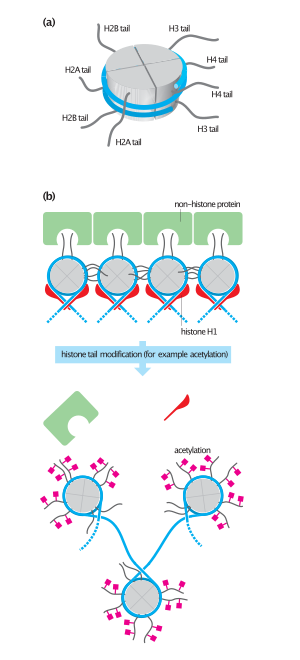
تخدم ناقلات أسيتيل هيستون العديد من الأدوار البيولوجية داخل الخلية. الكروماتين هو مزيج من البروتينات والحمض النووي الموجود في النواة ، ويخضع للعديد من التغييرات الهيكلية مع حدوث أحداث خلوية مختلفة مثل تكرار الحمض النووي وإصلاح الحمض النووي والنسخ . [37] يمكن العثور على الكروماتين في الخلية في حالتين: مكثف وغير مكثف. الأخير، المعروف باسم الكروماتين الحقيقي ، نشط من الناحية النسخية، في حين أن الأول، المعروف باسم الهيتروكروماتين ، غير نشط من الناحية النسخية. [37] [38] تتكون الهستونات من جزء البروتين من الكروماتين. هناك خمسة بروتينات هيستون مختلفة: H1، H2A، H2B، H3، وH4. يتشكل الهستون الأساسي عندما يشكل اثنان من كل نوع فرعي من الهستون، باستثناء H1، مركبًا رباعيًا. يشكل هذا المركب الثماني، بالاشتراك مع 147 زوجًا أساسيًا من الحمض النووي الملتف حوله، الجسيم النووي . [8] يقوم الهيستون H1 بتأمين المركب النووي معًا، وهو البروتين الأخير الذي يرتبط بالمركب.
تميل الهيستونات إلى أن تكون بروتينات موجبة الشحنة ذات ذيول طرفية-N تنبع من المركز. العمود الفقري للحمض النووي فوسفوديستر سلبي، مما يسمح بتفاعلات أيونية قوية بين بروتينات الهيستون والحمض النووي. تقوم ناقلات أسيتيل الهيستون بنقل مجموعة الأسيتيل إلى بقايا ليسين محددة على الهستونات، مما يحيد شحنتها الإيجابية وبالتالي يقلل من التفاعلات القوية بين الهستون والحمض النووي. [39] يُعتقد أيضًا أن الأسيتيل يزعج التفاعلات بين النيوكليوسومات الفردية ويعمل كمواقع تفاعل للبروتينات الأخرى المرتبطة بالحمض النووي. [8]
يمكن أن تكون هناك مستويات مختلفة من أستلة الهيستون بالإضافة إلى أنواع أخرى من التعديلات، مما يسمح للخلية بالتحكم في مستوى تعبئة الكروماتين أثناء الأحداث الخلوية المختلفة مثل النسخ والنسخ وإعادة التركيب والإصلاح. الأسيتيل ليس هو التعديل التنظيمي الوحيد بعد التحويلي للهستونات الذي يحدد بنية الكروماتين؛ تم أيضًا الإبلاغ عن المثيلة والفسفرة والريبوسيل ADP والتواجد في كل مكان. [8] [39] تمت الإشارة إلى هذه المجموعات من التعديلات التساهمية المختلفة على الطرف-N للهستونات باسم رمز هيستون ، ويُعتقد أن هذا الرمز قد يكون قابلاً للتوريث والحفاظ عليه في الجيل التالي من الخلايا. [40]
تعد بروتينات هيستون H3 وH4 هي الأهداف الرئيسية لـ HATs، ولكن يتم أستيل H2A وH2B أيضًا في الجسم الحي . إن اللايسينات 9 و14 و18 و23 من H3 و الايسينات 5 و 12 و16 من H4 كلها مستهدفة للأستلة. [8] [39] يتم أستلة الليسينات 5 و12 و15 و20 على هيستون H2B، في حين لوحظ أن اللايسينات 5 و9 فقط يتم أستلتها على الهيستون H2A. [4] [37] [40] مع وجود العديد من المواقع المختلفة للأستلة، يمكن تحقيق مستوى عالٍ من الخصوصية في إثارة استجابات محددة. مثال على هذه الخصوصية هو عندما يتم أستيل الهستون H4 عند الليسين 5 و12. وقد شوهد هذا النمط من الأستيل أثناء تخليق الهيستون. مثال آخر هو أستلة H4K16، والتي ارتبطت بتعويض جرعة كروموسوم X الذكري في ذبابة الفاكهة السوداء . [7] [4]
التعبير الجيني

تعديلات هيستون تعدل تعبئة الكروماتين. يعد مستوى تعبئة الحمض النووي مهمًا لنسخ الجينات، حيث يجب أن تتمتع آلية النسخ بإمكانية الوصول إلى المحفز حتى يحدث النسخ. [8] يسمح تحييد بقايا اللايسين المشحونة بواسطة HATs للكروماتين بالتخلص من التكثيف بحيث تتمكن هذه الآلة من الوصول إلى الجين المراد نسخه. ومع ذلك، لا يرتبط الأستيل دائمًا بنشاط النسخ المعزز. على سبيل المثال، ارتبط أستلة H4K12 بالكروماتين المكثف وغير النشط نسخيًا. [41] بالإضافة إلى ذلك، ترتبط بعض تعديلات الهيستون بالنشاط المعزز والمكبوت، بطريقة تعتمد على السياق. [42]
تعمل HAT كمنشطات مساعدة نسخية أو كاتمات صوت للجينات، وغالبًا ما توجد في مجمعات كبيرة تتكون من 10 إلى 20 وحدة فرعية، بعضها مشترك بين مجمعات HAT مختلفة. [39] تشمل هذه المجمعات SAGA (Spt/Ada/Gcn5L acetyltransferase)، PCAF، ADA (محول النسخ)، TFIID (عامل النسخ II D)، TFTC (مجمع يحتوي على TAF خالي من TBP)، وNuA3/NuA4 (ناقلات الأسيتيل النووية لـ H3 و ح4). [7] [37] تقوم هذه المجمعات بتعديل خصوصية HAT عن طريق جلب HAT إلى جيناتها المستهدفة حيث يمكنها بعد ذلك أستيل الهستونات النووية. [37] تحتوي بعض المنشطات المساعدة للنسخ HAT على برومودومين ، وهو وحدة من الأحماض الأمينية 110 تتعرف على بقايا الليسين الأسيتيل وترتبط وظيفيًا بالمنشطات المساعدة في تنظيم النسخ. [43]
الأهمية السريرية
إن قدرة ناقلات أسيتيل هيستون على معالجة بنية الكروماتين ووضع إطار جيني يجعلها ضرورية في صيانة الخلية وبقائها. تتضمن عملية إعادة تشكيل الكروماتين العديد من الإنزيمات، بما في ذلك HATs، التي تساعد في إعادة تشكيل النيوكليوسومات وهي ضرورية لأنظمة إصلاح تلف الحمض النووي لتعمل.[44] تم استخدام الهاتات كملحقات لتطور المرض، وتحديدًا في الاضطرابات التنكسية العصبية. على سبيل المثال، مرض هنتنغتون هو مرض يؤثر على المهارات الحركية والقدرات العقلية. الطفرة الوحيدة المعروفة المتورطة في المرض هي في المنطقة الطرفية N من بروتين هنتنغتين (htt).[45] تم الإبلاغ عن أن HTT يتفاعل بشكل مباشر مع الهاتات ويقمع النشاط التحفيزي لـ p300 / CBP و PCAF في المختبر .
تنجم متلازمة الشيخوخة المبكرة البشرية "هاتشينسون جيلفورد" عن خلل طفري في معالجة اللامين-أ، وهو بروتين المصفوفة النووية. في نموذج الفأر المصاب بهذه الحالة، يتأخر توظيف بروتينات الإصلاح في مواقع تلف الحمض النووي. تتضمن الآلية الجزيئية الكامنة وراء استجابة الإصلاح المتأخرة هذه خللًا في أستلة الهيستون.[46] على وجه التحديد يتم إزالة أسيتيل هيستون H4 عند بقية لايسين 16 (H4K16) ويعود هذا العيب إلى انخفاض ارتباط هيستون أسيتيل ترانسفيراز، Mof، بالمصفوفة النووية.[46]
الرنح المخيخي الشوكي من النوع 1 هو مرض تنكس عصبي ينشأ نتيجة لخلل في بروتين Ataxin-1 المتحول. يخقض المتحول Ataxin-1 من أستلة الهيستون مما يؤدي إلى قمع النسخ بوساطة ناقلة أسيتيل الهيستون.[47]
ارتبطت الهاتات (HATs)أيضًا بالتحكم في وظائف التعلم والذاكرة. وقد أظهرت الدراسات أن الفئران التي لا تحتوي على PCAF أو CBP تظهر دليلاً على التنكس العصبي.[31] الفئران التي لديها حذف PCAF تكون غير كفؤة فيما يتعلق بالتعلم، ويبدو أن الفئران التي لديها حذف CBP تعاني من فقدان الذاكرة على المدى الطويل.[48]
كما ارتبط سوء تنظيم التوازن بين الأسيتيل ونزع الأسيتيل بظهور بعض أنواع السرطان. إذا تم تثبيط إنزيم هيستون أسيتيل ترانسفيراز، فقد لا يتم إصلاح الحمض النووي التالف، مما يؤدي في النهاية إلى موت الخلايا. إن التحكم في عملية إعادة تشكيل الكروماتين داخل الخلايا السرطانية قد يوفر هدفًا دوائيًا جديدًا لأبحاث السرطان.[49] يمكن أن تؤدي مهاجمة هذه الإنزيمات داخل الخلايا السرطانية إلى زيادة موت الخلايا المبرمج بسبب التراكم العالي لتلف الحمض النووي. أحد هذه المثبطات لنواقل الأسيتيل هيستون يسمى جارسينول. تم العثور على هذا المركب داخل قشور فاكهة غاركينيا إنديكا، والمعروفة باسم مانغوستين. لاستكشاف تأثيرات الجارسينول على ناقلات أسيتيل الهيستون، استخدم الباحثون خلايا هيلا. خضعت الخلايا للإشعاع، مما أدى إلى حدوث فواصل مزدوجة داخل الحمض النووي، وتم إدخال الجارسينول إلى الخلايا لمعرفة ما إذا كان يؤثر على استجابة تلف الحمض النووي. إذا نجح الجارسينول في تثبيط عملية الانضمام غير المتماثل، وهي آلية إصلاح الحمض النووي التي تظهر الأفضلية في تثبيت الفواصل المزدوجة، [50] فقد يكون بمثابة محسس إشعاعي، وهو جزيء يزيد من حساسية الخلايا للإشعاع ضرر. الزيادات في الحساسية الإشعاعية قد تزيد من فعالية العلاج الإشعاعي.[49]
مراجع
- ^ Wang Y، Guo Y، Liu K، Yin Z، Liu R، Xia Y، Tan L، Yang P، Lee J، وآخرون (6 ديسمبر 2017). "KAT2A coupled with the α-KGDH complex acts as a histone H3 succinyltransferase". Nature. ج. 552 ع. 7684: 273–277. Bibcode:2017Natur.552..273W. DOI:10.1038/nature25003. PMC:5841452. PMID:29211711.
- ^ أ ب "Histone acetyltransferase complexes: one size doesn't fit all". Nature Reviews. Molecular Cell Biology. ج. 8 ع. 4: 284–95. أبريل 2007. DOI:10.1038/nrm2145. PMID:17380162. مؤرشف من الأصل في 2022-10-21.
- ^ Weaver R (2007). Molecular Biology. McGraw-Hill. ISBN:978-0073319940.
- ^ أ ب ت ث ج ح "Histone acetyltransferases". Annual Review of Biochemistry. ج. 70: 81–120. 2001. DOI:10.1146/annurev.biochem.70.1.81. PMID:11395403. مؤرشف من الأصل في 2023-06-05.
- ^ أ ب "Acetylation of histones and transcription-related factors". Microbiology and Molecular Biology Reviews. ج. 64 ع. 2: 435–59. يونيو 2000. DOI:10.1128/MMBR.64.2.435-459.2000. PMID:10839822.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^
Müller، Manuel M.؛ Muir، Tom W. (20 أكتوبر 2014). "Histones: At the Crossroads of Peptide and Protein Chemistry". الجمعية الكيميائية الأمريكية. ج. 115 ع. 6: 2296–2349. DOI:10.1021/cr5003529. ISSN:0009-2665. PMID:25330018.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب ت ث ج ح خ "Histone acetyltransferase complexes: one size doesn't fit all". Nature Reviews. Molecular Cell Biology. ج. 8 ع. 4: 284–95. أبريل 2007. DOI:10.1038/nrm2145. PMID:17380162. مؤرشف من الأصل في 2022-10-21.Lee KK, Workman JL (April 2007).
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع "Histone acetyltransferases". Annual Review of Biochemistry. ج. 70: 81–120. 2001. DOI:10.1146/annurev.biochem.70.1.81. PMID:11395403. مؤرشف من الأصل في 2023-06-05.Roth SY, Denu JM, Allis CD (2001).
- ^ أ ب ت ث ج ح خ د ذ ر "Acetylation of histones and transcription-related factors". Microbiology and Molecular Biology Reviews. ج. 64 ع. 2: 435–59. يونيو 2000. DOI:10.1128/MMBR.64.2.435-459.2000. PMID:10839822.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)Sterner DE, Berger SL (June 2000). - ^ أ ب ت ث "Structure of histone acetyltransferases". Journal of Molecular Biology. ج. 311 ع. 3: 433–44. أغسطس 2001. DOI:10.1006/jmbi.2001.4859. PMID:11492997. مؤرشف من الأصل في 2023-02-03.
- ^ أ ب ت ث ج ح خ "Histone acetyltransferases: Rising ancient counterparts to protein kinases". Biopolymers. ج. 99 ع. 2: 98–111. فبراير 2013. DOI:10.1002/bip.22128. PMID:23175385.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Histone modifying enzymes: structures, mechanisms, and specificities". Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms. ج. 1789 ع. 1: 58–68. يناير 2009. DOI:10.1016/j.bbagrm.2008.07.009. PMID:18722564.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Mammalian histone acetyltransferases and their complexes". Cellular and Molecular Life Sciences. ج. 58 ع. 5–6: 683–92. مايو 2001. DOI:10.1007/PL00000892. PMID:11437230. مؤرشف من الأصل في 2022-09-29.
- ^ "Circadian regulator CLOCK is a histone acetyltransferase". Cell. ج. 125 ع. 3: 497–508. مايو 2006. DOI:10.1016/j.cell.2006.03.033. PMID:16678094.
- ^ أ ب ت ث ج ح خ د ذ ر ز "Histone acetyltransferases: Rising ancient counterparts to protein kinases". Biopolymers. ج. 99 ع. 2: 98–111. فبراير 2013. DOI:10.1002/bip.22128. PMID:23175385.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)Yuan H, Marmorstein R (February 2013). - ^ "Mammalian histone acetyltransferases and their complexes". Cellular and Molecular Life Sciences. ج. 58 ع. 5–6: 683–92. مايو 2001. DOI:10.1007/PL00000892. PMID:11437230. مؤرشف من الأصل في 2022-09-29.Ogryzko VV (May 2001).
- ^ أ ب "A decade of histone acetylation: marking eukaryotic chromosomes with specific codes". Journal of Biochemistry. ج. 138 ع. 6: 647–62. ديسمبر 2005. DOI:10.1093/jb/mvi184. PMID:16428293. مؤرشف من الأصل في 2022-09-24.
- ^ "Histone acetyltransferases: function, structure, and catalysis". Current Opinion in Genetics & Development. ج. 11 ع. 2: 155–61. أبريل 2001. DOI:10.1016/S0959-437X(00)00173-8. PMID:11250138. مؤرشف من الأصل في 2022-10-11.
- ^ "Lessons from genome-wide studies: an integrated definition of the coactivator function of histone acetyl transferases". Epigenetics & Chromatin. ج. 3 ع. 1: 18. أكتوبر 2010. DOI:10.1186/1756-8935-3-18. PMID:20961410.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ https://linkinghub.elsevier.com/retrieve/pii/S016895250300115X?showall%3Dtrue "The diverse functions of histone acetyltransferase complexes". Trends in Genetics. ج. 19 ع. 6: 321–9. يونيو 2003. DOI:10.1016/S0168-9525(03)00115-X. PMID:12801725. مؤرشف من https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS016895250300115X%3Fshowall%3Dtrue الأصل في 2022-09-29.
{{استشهاد بدورية محكمة}}: تحقق من قيمة|مسار أرشيف=(مساعدة) وتحقق من قيمة|مسار=(مساعدة) - ^ Torok MS، Grant PA (2004). "Histone acetyltransferase proteins contribute to transcriptional processes at multiple levels". Proteins in Eukaryotic Transcription. Advances in Protein Chemistry. Academic Press. ج. 67. ص. 181–99. DOI:10.1016/S0065-3233(04)67007-0. ISBN:9780120342679. PMID:14969728.
- ^ "Tuning acetylated chromatin with HAT inhibitors: a novel tool for therapy". Epigenetics. ج. 5 ع. 2: 105–11. فبراير 2010. DOI:10.4161/epi.5.2.10942. PMID:20160510.
- ^ أ ب ت ث "Structure of histone acetyltransferases". Journal of Molecular Biology. ج. 311 ع. 3: 433–44. أغسطس 2001. DOI:10.1006/jmbi.2001.4859. PMID:11492997. مؤرشف من الأصل في 2023-02-03.Marmorstein R (August 2001).
- ^ أ ب ت ث ج "Histone modifying enzymes: structures, mechanisms, and specificities". Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms. ج. 1789 ع. 1: 58–68. يناير 2009. DOI:10.1016/j.bbagrm.2008.07.009. PMID:18722564.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)Marmorstein R, Trievel RC (January 2009). - ^ "Catalytic mechanism of a MYST family histone acetyltransferase". Biochemistry. ج. 46 ع. 3: 623–9. يناير 2007. DOI:10.1021/bi602513x. PMID:17223684.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Catalysis and substrate selection by histone/protein lysine acetyltransferases". Current Opinion in Structural Biology. ج. 18 ع. 6: 682–9. ديسمبر 2008. DOI:10.1016/j.sbi.2008.11.004. PMID:19056256.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Weaver R (2007). Molecular Biology. McGraw-Hill. ISBN:978-0073319940.Weaver R (2007).
- ^ أ ب ت ث "Catalysis and substrate selection by histone/protein lysine acetyltransferases". Current Opinion in Structural Biology. ج. 18 ع. 6: 682–9. ديسمبر 2008. DOI:10.1016/j.sbi.2008.11.004. PMID:19056256.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)Berndsen CE, Denu JM (December 2008). - ^ أ ب ت ث "A decade of histone acetylation: marking eukaryotic chromosomes with specific codes". Journal of Biochemistry. ج. 138 ع. 6: 647–62. ديسمبر 2005. DOI:10.1093/jb/mvi184. PMID:16428293. مؤرشف من الأصل في 2022-09-24.Kimura A, Matsubara K, Horikoshi M (December 2005).
- ^ "Lysine acetylation and the bromodomain: a new partnership for signaling". BioEssays. ج. 26 ع. 10: 1076–87. أكتوبر 2004. DOI:10.1002/bies.20104. PMID:15382140.
- ^ أ ب "Acetylation and deacetylation of non-histone proteins". Gene. ج. 363: 15–23. ديسمبر 2005. DOI:10.1016/j.gene.2005.09.010. PMID:16289629. مؤرشف من الأصل في 2023-05-08.
- ^ "Acetylation and deacetylation of non-histone proteins". Gene. ج. 363: 15–23. ديسمبر 2005. DOI:10.1016/j.gene.2005.09.010. PMID:16289629. مؤرشف من الأصل في 2023-05-08.Glozak MA, Sengupta N, Zhang X, Seto E (December 2005).
- ^ "A novel acetylation cycle of transcription co-activator Yes-associated protein that is downstream of Hippo pathway is triggered in response to SN2 alkylating agents". The Journal of Biological Chemistry. ج. 287 ع. 26: 22089–98. يونيو 2012. DOI:10.1074/jbc.M111.334714. PMID:22544757.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Lysine acetylation and the bromodomain: a new partnership for signaling". BioEssays. ج. 26 ع. 10: 1076–87. أكتوبر 2004. DOI:10.1002/bies.20104. PMID:15382140.Yang XJ (October 2004).
- ^ "The structural basis of protein acetylation by the p300/CBP transcriptional coactivator". Nature. ج. 451 ع. 7180: 846–50. فبراير 2008. Bibcode:2008Natur.451..846L. DOI:10.1038/nature06546. PMID:18273021. مؤرشف من الأصل في 2023-03-28.
- ^ "Autoacetylation of the histone acetyltransferase Rtt109". The Journal of Biological Chemistry. ج. 286 ع. 28: 24694–701. يوليو 2011. DOI:10.1074/jbc.M111.251579. PMID:21606491.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب ت ث ج Voet D، Voet JG (2004). Biochemistry (ط. 3rd). Hoboken, N.J.: John Wiley & Sons. ISBN:978-0-471-19350-0.
- ^ Tropp BE (2008). Molecular biology : genes to proteins (ط. 3rd). Sudbury, Mass.: Jones and Bartlett Publishers. ISBN:9780763709167.
- ^ أ ب ت ث Voet D، Voet JG (2004). Biochemistry (ط. 3rd). Hoboken, N.J.: John Wiley & Sons. ISBN:978-0-471-19350-0.Voet D, Voet JG (2004).
- ^ أ ب Tropp BE (2008). Molecular biology : genes to proteins (ط. 3rd). Sudbury, Mass.: Jones and Bartlett Publishers. ISBN:9780763709167.Tropp BE (2008).
- ^ "Histone acetylation in chromatin structure and transcription". Nature. ج. 389 ع. 6649: 349–52. سبتمبر 1997. Bibcode:1997Natur.389..349G. DOI:10.1038/38664. PMID:9311776. مؤرشف من الأصل في 2022-10-16.
- ^ "Expression homeostasis during DNA replication". Science. ج. 351 ع. 6277: 1087–90. مارس 2016. Bibcode:2016Sci...351.1087V. DOI:10.1126/science.aad1162. PMID:26941319. مؤرشف من الأصل في 2022-09-29.
- ^ "Structure and ligand of a histone acetyltransferase bromodomain". Nature. ج. 399 ع. 6735: 491–6. يونيو 1999. Bibcode:1999Natur.399..491D. DOI:10.1038/20974. PMID:10365964. مؤرشف من الأصل في 2023-03-14.
- ^ Rossetto D، Truman AW، Kron SJ، Côté J (سبتمبر 2010). "Epigenetic modifications in double-strand break DNA damage signaling and repair". Clinical Cancer Research. ج. 16 ع. 18: 4543–52. DOI:10.1158/1078-0432.CCR-10-0513. PMC:2940951. PMID:20823147.
- ^ Klein G، Vande Woude GF (2002). Advances in Cancer Research, Volume 86. Boston: Academic Press. ISBN:978-0-12-006686-5.
- ^ أ ب Krishnan V، Chow MZ، Wang Z، Zhang L، Liu B، Liu X، Zhou Z (يوليو 2011). "Histone H4 lysine 16 hypoacetylation is associated with defective DNA repair and premature senescence in Zmpste24-deficient mice". Proc. Natl. Acad. Sci. U.S.A. ج. 108 ع. 30: 12325–30. Bibcode:2011PNAS..10812325K. DOI:10.1073/pnas.1102789108. PMC:3145730. PMID:21746928.
- ^ Cvetanovic M، Kular RK، Opal P (ديسمبر 2012). "LANP mediates neuritic pathology in Spinocerebellar ataxia type 1". Neurobiol. Dis. ج. 48 ع. 3: 526–32. DOI:10.1016/j.nbd.2012.07.024. PMC:3987943. PMID:22884877.
- ^ Furdas SD، Kannan S، Sippl W، Jung M (يناير 2012). "Small molecule inhibitors of histone acetyltransferases as epigenetic tools and drug candidates". Archiv der Pharmazie. ج. 345 ع. 1: 7–21. DOI:10.1002/ardp.201100209. PMID:22234972. S2CID:3125138. مؤرشف من الأصل في 2023-03-20.
- ^ أ ب Oike T، Ogiwara H، Torikai K، Nakano T، Yokota J، Kohno T (نوفمبر 2012). "Garcinol, a histone acetyltransferase inhibitor, radiosensitizes cancer cells by inhibiting non-homologous end joining". International Journal of Radiation Oncology, Biology, Physics. ج. 84 ع. 3: 815–21. DOI:10.1016/j.ijrobp.2012.01.017. PMID:22417805. مؤرشف من الأصل في 2022-09-24.
- ^ Burma S، Chen BP، Chen DJ (سبتمبر 2006). "Role of non-homologous end joining (NHEJ) in maintaining genomic integrity". DNA Repair. ج. 5 ع. 9–10: 1042–8. DOI:10.1016/j.dnarep.2006.05.026. PMID:16822724. مؤرشف من الأصل في 2023-09-02.