|
تضامنًا مع حق الشعب الفلسطيني |
الفحص المجهري ثنائي الفوتون

الفحص المجهري ثنائي الفوتون (TPEF أو 2PEF)، هي تقنية تصوير مضان تسمح بتصوير الأنسجة الحية بسماكة تصل إلى حوالي مليمتر واحد. على عكس الفحص المجهري التقليدي، حيث يكون الطول الموجي للإثارة أقصر من الطول الموجي للانبعاث، تتطلب الإثارة ثنائية الفوتون إثارة متزامنة بواسطة فوتونين بطول موجة أطول من الضوء المنبعث. يستخدم الفحص المجهري للإثارة ثنائية الفوتون عادةً ضوء الإثارة القريب من الأشعة تحت الحمراء (NIR) والذي يمكن أن يثير أيضًا الأصباغ الفلورية. ومع ذلك، لكل إثارة، يتم امتصاص فوتونين من ضوء NIR. استخدام ضوء الأشعة تحت الحمراء يقلل من تشتت الأنسجة. نظرًا لامتصاص متعدد الفوتونات، يتم قمع إشارة الخلفية بشدة. يؤدي كلا التأثيرين إلى زيادة عمق الاختراق لهذه التقنية. يمكن أن يكون الإثارة ثنائية الفوتون بديلاً رائعًا عن الفحص المجهري متحد البؤر نظرًا لاختراقها العميق للأنسجة، وكشف الضوء الفعال، وتقليل التلاشي الضوئي.[1][2]

مفهوم
توظف الإثارة ثنائية الفوتون امتصاص ثنائي الفوتون، وهو مفهوم وصفته لأول مرة ماريا جوبرت ماير (1906-1972) في أطروحة الدكتوراه الخاصة بها في عام 1931،[3] ولوحظ لأول مرة في عام 1961 في CaF2: Eu2 + الكريستال باستخدام الإثارة بالليزر بواسطة فولفغانغ كايزر.[4] أظهر إسحاق أبيلا في عام 1962 في بخار السيزيوم أن الإثارة ثنائية الفوتون للذرات المفردة ممكنة.[5]
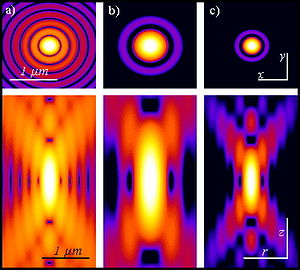
يشتمل الفحص المجهري للإثارة ثنائية الفوتون على أوجه تشابه مع تقنيات الفحص المجهري بالليزر متحد البؤر الأخرى مثل الفحص المجهري المتحد البؤر بالليزر وفحص رامان المجهري. تستخدم هذه التقنيات أشعة الليزر المركزة الممسوحة ضوئيًا في نمط نقطي لتوليد الصور، وكلاهما له تأثير التقسيم البصري. على عكس المجاهر متحد البؤر، لا تحتوي المجاهر متعددة الفوتون على فتحات ذات ثقوب تعطي المجاهر متحد البؤر جودة التقسيم البصري. التقسيم البصري الناتج عن مجاهر متعددة الفوتون هو نتيجة وظيفة انتشار نقطة الإثارة: وظيفة انتشار نقطة متعددة الفوتون عادةً ما تكون على شكل دمبل (أطول في المستوى xy)، مقارنة بوظيفة انتشار نقطة كرة الرجبي المستقيمة في البؤر المجاهر. يعتمد مفهوم الإثارة ثنائية الفوتون على فكرة أن فوتونين، لهما طاقة فوتونية أقل نسبيًا مما هو مطلوب لإثارة فوتون واحد، يمكنهما أيضًا إثارة فلوروفور في حدث كمومي واحد. يحمل كل فوتون ما يقرب من نصف الطاقة اللازمة لإثارة الجزيء. ينتج عن الإثارة الانبعاث اللاحق لفوتون مضان بنفس العائد الكمي الذي سينتج عن امتصاص الفوتون الفردي التقليدي. عادةً ما يكون الفوتون المنبعث طاقة أعلى (طول موجي أقصر) من أي من الفوتونين المثيرين. إن احتمال الامتصاص شبه المتزامن لفوتونين منخفض للغاية. لذلك، عادة ما تكون هناك حاجة إلى تدفق ذروة عالية من فوتونات الإثارة، وعادة ما يتم إنشاؤها بواسطة ليزر نبضي فيمتوثانية. الغرض من استخدام تأثير الفوتونين هو أن الانتشار المحوري لوظيفة انتشار النقطة أقل بكثير من إثارة الفوتون الفردي. نتيجة لذلك، تم تحسين المدى على طول البعد z، مما يسمح بقطع المقاطع البصرية الرقيقة. بالإضافة إلى ذلك، في كثير من الحالات المثيرة للاهتمام، يمكن تصميم شكل البقعة وحجمها لتحقيق أهداف مرغوبة محددة.[6] تعد أشعة الليزر ذات الطول الموجي الأطول والطاقة المنخفضة (عادةً الأشعة تحت الحمراء) للمجاهر متعددة الفوتونات مناسبة تمامًا للاستخدام في تصوير الخلايا الحية لأنها تسبب ضررًا أقل من الليزر قصير الطول الموجي المستخدم عادةً لإثارة الفوتون الفردي، لذلك يمكن ملاحظة الخلايا من أجل فترات أطول مع تأثيرات سامة أقل.

تحتوي الفلوروفورات الأكثر استخدامًا على أطياف الإثارة في نطاق 400-500 نانومتر، في حين أن الليزر المستخدم لإثارة التألق ثنائي الفوتون يقع في نطاق ~ 700-1000 نانومتر (الأشعة تحت الحمراء) الذي تنتجه ليزر Ti-sapphire. إذا قام الفلوروفور بامتصاص فوتونين من الأشعة تحت الحمراء في وقت واحد، فسوف يمتص طاقة كافية ليرتفع إلى الحالة المثارة. سيصدر الفلوروفور بعد ذلك فوتونًا واحدًا بطول موجة يعتمد على نوع الفلوروفور المستخدم (عادةً في الطيف المرئي). نظرًا لامتصاص فوتونين أثناء إثارة حامل الفلور، تزداد احتمالية انبعاث الفلورسنت من الفلوروفور بشكل تربيعي مع شدة الإثارة. لذلك، يتم إنشاء المزيد من الفلورة ثنائية الفوتون حيث يتم تركيز شعاع الليزر بإحكام أكثر من المكان الذي يكون فيه أكثر انتشارًا. على نحو فعال، يقتصر الإثارة على الحجم البؤري الصغير (~ 1 فيمتوليتر)، مما يؤدي إلى درجة عالية من رفض الأشياء خارج التركيز. يعتبر توطين الإثارة ميزة أساسية مقارنة بمجاهر الإثارة أحادية الفوتون، والتي تحتاج إلى استخدام عناصر مثل الثقوب لرفض التألق خارج التركيز. ثم يتم جمع الفلورة من العينة بواسطة كاشف عالي الحساسية، مثل أنبوب مضاعف ضوئي. تصبح شدة الضوء المرصودة بكسل واحدًا في الصورة النهائية؛ يتم مسح النقطة المحورية عبر المنطقة المرغوبة من العينة لتشكيل جميع وحدات البكسل في الصورة.
تطوير
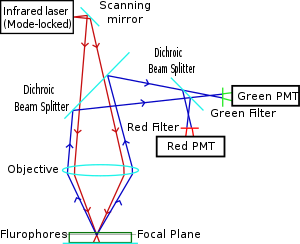
تم ابتكار الفحص المجهري ثنائي الفوتون وحصل على براءة اختراع من قبل وينفريد دينك وجيمس ستريكلر في مختبر وات دبليو ويب بجامعة كورنيل في عام 1990. لقد جمعوا فكرة امتصاص الفوتونين باستخدام ماسح ضوئي بالليزر.[7][8] في الفحص المجهري ثنائي الفوتون، يتم تركيز شعاع ليزر الأشعة تحت الحمراء من خلال عدسة موضوعية. ليزر Ti-sapphire المستخدم عادةً له عرض نبضة يبلغ حوالي 100 فمتوثانية (fs) ومعدل تكرار يبلغ حوالي 80 MHz، مما يسمح بكثافة الفوتون العالية والتدفق المطلوب لامتصاص فوتونين ويمكن ضبطه عبر نطاق واسع من الأطوال الموجية. تم أيضًا استخدام ألياف الليزر المغلقة بالنمط Yb مع 325 نبضة fs لتصوير الكولاجين، مما يدل على عمق اختراق يتجاوز 320 ميكرومتر في الكولاجين، والذي يتفوق بشكل كبير على أعماق من 250 إلى 300 ميكرومتر يمكن تحقيقه عند اقترانه بـ Ti- تقليدي ليزر الإثارة الياقوت.
استخدام ضوء الأشعة تحت الحمراء لإثارة الفلوروفور في الأنسجة المشتتة للضوء له فوائد إضافية.[9] تنتشر الأطوال الموجية الأطول بدرجة أقل من الموجات الأقصر، مما يعود بالفائدة على التصوير عالي الدقة. بالإضافة إلى ذلك، فإن هذه الفوتونات منخفضة الطاقة أقل احتمالا للتسبب في ضرر خارج الحجم البؤري. مقارنة بالمجهر متحد البؤر، يكون اكتشاف الفوتون أكثر فاعلية نظرًا لأن الفوتونات المتناثرة تساهم في الإشارة القابلة للاستخدام. تم التعرف على هذه الفوائد للتصوير في تناثر الأنسجة فقط بعد عدة سنوات من اختراع الفحص المجهري للإثارة ثنائية الفوتون.[10]
هناك العديد من المحاذير لاستخدام المجهر ثنائي الفوتون: الليزر النبضي اللازم لإثارة الفوتونين أغلى بكثير من ليزر الموجة المستمرة (CW) المستخدم في الفحص المجهري متحد البؤر. قد يختلف طيف امتصاص الفوتونين للجزيء اختلافًا كبيرًا عن نظيره من الفوتون الواحد. بالنسبة للأجسام الرقيقة جدًا مثل الخلايا المعزولة، يمكن أن تنتج المجاهر أحادية الفوتون (متحد البؤر) صورًا ذات دقة بصرية أعلى بسبب أطوال موجات الإثارة الأقصر. في تناثر الأنسجة، من ناحية أخرى، يؤدي التقسيم البصري الفائق وقدرات الكشف عن الضوء لمجهر الفوتونين إلى أداء أفضل.
التطبيقات
الأساسية
شارك الفحص المجهري ثنائي الفوتون في العديد من المجالات بما في ذلك: علم وظائف الأعضاء وعلم الأعصاب وعلم الأجنة وهندسة الأنسجة. حتى الأنسجة الرقيقة والشفافة تقريبًا (مثل خلايا الجلد) تم تخيلها بتفاصيل واضحة بسبب هذه التقنية.[11] يمكن أيضًا استخدام قدرات التصوير عالي السرعة للفوتونين المجهريين في الخزعة الضوئية غير الباضعة.[12] في بيولوجيا الخلية، تم استخدام الفحص المجهري ثنائي الفوتون بشكل مناسب لإنتاج تفاعلات كيميائية موضعية.[10] باستخدام مجهر ثنائي الفوتون ومجهري قائم على التوليد التوافقي الثاني، تبين أن جزيئات البورفيرين العضوية يمكن أن تحتوي لحظات انتقالية مختلفة ثنائية القطب لفلورة ثنائية الفوتون والتوليد التوافقي الثاني،[13] والتي يُعتقد أنها تحدث من نفس عزم الانتقال ثنائي القطب.[14] ثبت أن الإثارة غير التنكسية للفوتونين، أو باستخدام فوتونين بأطوال موجية غير متكافئة، تزيد من تألق جميع الجزيئات الصغيرة والبروتينات الفلورية المختبرة.[15]
ابحاث السرطان
كما ثبت أن 2PEF لها قيمة كبيرة في توصيف سرطان الجلد.[16] وقد ثبت أيضًا أنه يكشف عن توقف الخلايا السرطانية، والتفاعل بين الخلايا السرطانية والصفائح الدموية، والتفاعل بين الخلايا السرطانية والكريات البيض، وعمليات الاستعمار المنتشر.[17]
علوم الأعصاب
يتم استخدام 2PEF و 3 PEF لوصف الأنسجة العصبية السليمة.[18][19][20]
تصوير الدماغ في الجسم الحي
الفلورة متعددة الفوتون (2PEF و 3PEF) هي وسيلة مفيدة لتصوير الدماغ في الجسم الحي.[21] حاليًا، يستخدم الفحص المجهري ثنائي الفوتون على نطاق واسع لتصوير إطلاق الخلايا العصبية الحية في الكائنات الحية النموذجية بما في ذلك ذباب الفاكهة (Drosophila melanogaster) والفئران (Mus musculus) ودانيو مخطط.[22]
من خلال (حلق)، يتم نشر تصوير الجمجمة للشعيرات الدموية وكرات الدم الحمراء على الفئران، مما يشير إلى عمق أكبر ودقة عالية من أبعد من تطبيقات الفحص المجهري. هذا هو البحث، «التصوير ثنائي الفوتون في الجسم الحي يكشف عن تشنج وعائي دماغي حاد وتجلط دقيق بعد إصابة دماغ رضحية خفيفة في الفئران»
الإثارة الرفيعة المستوى
من الممكن أيضًا الامتصاص المتزامن لثلاثة فوتونات أو أكثر، مما يسمح بمجهر إثارة متعدد الفوتونات أعلى.[23] ما يسمى ب «الفوتونات الثلاثة المجهري الفلوريسنس المثير» (3PEF) هو الأسلوب الأكثر استخدامًا بعد 2PEF، وهو مكمل له.
الأصباغ والبروتينات الفلورية للفوتون المجهري المجهري
بشكل عام، يمكن إثارة جميع البروتينات الفلورية المستخدمة بشكل شائع (CFP ، GFP ، YFP ، RFP) والأصباغ في وضع ثنائي الفوتون. غالبًا ما تكون أطياف الإثارة ثنائية الفوتون أوسع بكثير، مما يجعل من الصعب إثارة الفلوروفور بشكل انتقائي عن طريق تبديل أطوال موجات الإثارة. هناك العديد من قواعد البيانات على الإنترنت لأطياف الفوتونين، وهي متاحة من جامعة كورنيل [1] والمعهد الوطني للفيزياء الكيميائية والفيزياء الحيوية في إستونيا.[24]
تم الإبلاغ عن العديد من الأصباغ الباعثة للأخضر والأحمر والأشعة تحت الحمراء (المجسات والملصقات التفاعلية) ذات المقاطع العرضية العالية للغاية لامتصاص الفوتونين.[25] نظرًا للهيكل من النوع المتبرع والمتقبل والمتبرع، تُظهر أصباغ سكورين مثل Seta-670 و Seta-700 و Seta-660 كفاءات عالية جدًا لامتصاص 2 فوتون (2PA) بالمقارنة مع الأصباغ الأخرى،[25][26][27] SeTau-647 و SeTau-665، وهو نوع جديد من سكوارين روتاكسان، يعرضان مقاطع عرضية عالية للغاية من الفوتونين تصل إلى 10000 جم في منطقة الأشعة تحت الحمراء القريبة، لا مثيل لها بأي فئة أخرى من الأصباغ العضوية.[25]
انظر أيضًا
المراجع
- ^ Denk W.؛ Strickler J.؛ Webb W. (1990). "Two-photon laser scanning fluorescence microscopy". Science. ج. 248 ع. 4951: 73–6. Bibcode:1990Sci...248...73D. DOI:10.1126/science.2321027. PMID:2321027. S2CID:18431535. مؤرشف من الأصل في 2021-10-08.
- ^ Juan Carlos Stockert, Alfonso Blázquez-Castro (2017). "Chapter 19 Non-Linear Optics". Fluorescence Microscopy in Life Sciences. Bentham Science Publishers. ص. 642–686. ISBN:978-1-68108-519-7. مؤرشف من الأصل في 2019-05-14. اطلع عليه بتاريخ 2017-12-24.
- ^ Goeppert-Mayer M. (1931). "Über Elementarakte mit zwei Quantensprüngen". Annals of Physics. ج. 9 ع. 3: 273–95. Bibcode:1931AnP...401..273G. DOI:10.1002/andp.19314010303.
- ^ Kaiser، W.؛ Garrett, C. (سبتمبر 1961). "Two-Photon Excitation in CaF2:Eu2+". Physical Review Letters. ج. 7 ع. 6: 229–231. Bibcode:1961PhRvL...7..229K. DOI:10.1103/PhysRevLett.7.229.
- ^ Abella، I. D. (ديسمبر 1962). "Optical Double-Photon Absorption in Cesium Vapor". Physical Review Letters. ج. 9 ع. 11: 453–455. Bibcode:1962PhRvL...9..453A. DOI:10.1103/PhysRevLett.9.453.
- ^ Kaminer، Ido؛ Nemirovsky Jonathan؛ Segev Mordechai (2013). "Optimizing 3D multiphoton fluorescence microscopy". Optics Letters. ج. 38 ع. 19: 3945–3948. Bibcode:2013OptL...38.3945K. DOI:10.1364/OL.38.003945. PMID:24081095.
- ^ Denk W.؛ Strickler J.H.؛ Webb W.W. (1990). "Two-photon laser scanning fluorescence microscopy". Science. ج. 248 ع. 4951: 73–76. Bibcode:1990Sci...248...73D. DOI:10.1126/science.2321027. PMID:2321027. S2CID:18431535. مؤرشف من الأصل في 2021-10-08.
- ^ US 5034613 "Two-photon laser microscopy."
- ^ Helmchen F.؛ Denk W. (2005). "Deep tissue two-photon microscopy". Nat Methods. ج. 2 ع. 12: 932–40. DOI:10.1038/nmeth818. PMID:16299478. S2CID:3339971.
- ^ أ ب Denk W.؛ Delaney K. (1994). "Anatomical and functional imaging of neurons using 2-photon laser scanning microscopy". J Neurosci Methods. ج. 54 ع. 2: 151–62. DOI:10.1016/0165-0270(94)90189-9. PMID:7869748. S2CID:3772937.
- ^ Masters BR.؛ So PTC؛ Gratton E. (1997). "Multiphoton excitation fluorescence microscopy and spectroscopy of in vivo human skin". Biophysical Journal. ج. 72 ع. 6: 2405–2412. Bibcode:1997BpJ....72.2405M. DOI:10.1016/s0006-3495(97)78886-6. PMC:1184440. PMID:9168018.
- ^ Bewersdorf J، Rainer P، Hell SW (1998). "Multifocal multiphoton microscopy". Optics Letters. ج. 23 ع. 9: 665–667. Bibcode:1998OptL...23..655B. DOI:10.1364/ol.23.000655. PMID:18087301. S2CID:17549598. مؤرشف من الأصل في 2021-10-09.
- ^ Khadria A، Coene Y، Gawel P، Roche C، Clays K، Anderson HL (2017). "Push–pull pyropheophorbides for nonlinear optical imaging". Organic and Biomolecular Chemistry. ج. 15 ع. 4: 947–956. DOI:10.1039/C6OB02319C. PMID:28054076. مؤرشف من الأصل في 2021-08-18.
- ^ Reeve JE، Corbett AD، Boczarow I، Wilson T، Bayley H، Anderson HL (2012). "Probing the Orientational Distribution of Dyes in Membranes through Multiphoton Microscopy". Biophysical Journal. ج. 103 ع. 5: 907–917. Bibcode:2012BpJ...103..907R. DOI:10.1016/j.bpj.2012.08.003. PMC:3433607. PMID:23009840.
- ^ Sadegh، Sanaz؛ Yang، Mu-Han؛ Ferri، Christopher G. L.؛ Thunemann، Martin؛ Saisan، Payam A.؛ Wei، Zhe؛ Rodriguez، Erik A.؛ Adams، Stephen R.؛ Kiliç، Kivilcim؛ Boas، David A.؛ Sakadžić، Sava؛ Devor، Anna؛ Fainman، Yeshaiahu (18 سبتمبر 2019). "Efficient non-degenerate two-photon excitation for fluorescence microscopy". Optics Express. ج. 27 ع. 20: 28022–28035. Bibcode:2019OExpr..2728022S. DOI:10.1364/OE.27.028022. PMC:6825618. PMID:31684560.
- ^ Paoli، John؛ Smedh، Maria؛ Ericson، Marica B. (سبتمبر 2009). "Multiphoton Laser Scanning Microscopy—A Novel Diagnostic Method for Superficial Skin Cancers". Seminars in Cutaneous Medicine and Surgery. ج. 28 ع. 3: 190–195. DOI:10.1016/j.sder.2009.06.007. PMID:19782943.
- ^ Tanaka، Koji؛ Toiyama، Yuji؛ Okugawa، Yoshinaga؛ Okigami، Masato؛ Inoue، Yasuhiro؛ Uchida، Keiichi؛ Araki، Toshimitsu؛ Mohri، Yasuhiko؛ Mizoguchi، Akira؛ Kusunoki، Masato (15 مايو 2014). "In vivo optical imaging of cancer metastasis using multiphoton microscopy: a short review". American Journal of Translational Research. ج. 6 ع. 3: 179–187. PMC:4058302. PMID:24936213.
- ^ Svoboda، Karel؛ Yasuda، Ryohei (يونيو 2006). "Principles of Two-Photon Excitation Microscopy and Its Applications to Neuroscience". Neuron. ج. 50 ع. 6: 823–839. DOI:10.1016/j.neuron.2006.05.019. PMID:16772166. S2CID:7278880.
- ^ Huang, Cheng; Maxey, Jessica R.; Sinha, Supriyo; Savall, Joan; Gong, Yiyang; Schnitzer, Mark J. (28 Feb 2018). "Long-term optical brain imaging in live adult fruit flies". Nature Communications (بEnglish). 9 (1): 872. Bibcode:2018NatCo...9..872H. DOI:10.1038/s41467-018-02873-1. ISSN:2041-1723. PMC:5830414. PMID:29491443.
- ^ Demas, Jeffrey; Manley, Jason; Tejera, Frank; Barber, Kevin; Kim, Hyewon; Traub, Francisca Martínez; Chen, Brandon; Vaziri, Alipasha (Sep 2021). "High-speed, cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy". Nature Methods (بEnglish). 18 (9): 1103–1111. DOI:10.1038/s41592-021-01239-8. ISSN:1548-7105. PMID:34462592. S2CID:237366015. Archived from the original on 2021-11-11.
- ^ Horton، Nicholas G.؛ Wang، Ke؛ Kobat، Demirhan؛ Clark، Catharine G.؛ Wise، Frank W.؛ Schaffer، Chris B.؛ Xu، Chris (2013). "In vivo three-photon microscopy of subcortical structures within an intact mouse brain". Nature Photonics. ج. 7 ع. 3: 205–209. Bibcode:2013NaPho...7..205H. DOI:10.1038/nphoton.2012.336. ISSN:1749-4885. PMC:3864872. PMID:24353743.
- ^ Benninger, Richard K. P.; Piston, David W. (2013). "Two-Photon Excitation Microscopy for the Study of Living Cells and Tissues". Current Protocols in Cell Biology (بEnglish). 59 (1): 4.11.1–4.11.24. DOI:10.1002/0471143030.cb0411s59. ISSN:1934-2616. PMC:4004770. PMID:23728746.
- ^ Xu، C؛ Zipfel، W؛ Shear، J B؛ Williams، R M؛ Webb، W W (1 أكتوبر 1996). "Multiphoton fluorescence excitation: new spectral windows for biological nonlinear microscopy". Proceedings of the National Academy of Sciences of the United States of America. ج. 93 ع. 20: 10763–10768. Bibcode:1996PNAS...9310763X. DOI:10.1073/pnas.93.20.10763. PMC:38229. PMID:8855254.
- ^ "Two Photon Absorption Spectra | KBFI KBFI". KBFI (بEnglish). Archived from the original on 2021-10-08. Retrieved 2020-09-03.
- ^ أ ب ت Podgorski K.؛ Terpetschnig E.؛ Klochko O.P.؛ Obukhova O.M.؛ Haas K. (2012). "Ultra-Bright and -Stable Red and Near-Infrared Squaraine Fluorophores for In Vivo Two-Photon Imaging". PLOS ONE. ج. 7 ع. 12: e51980. Bibcode:2012PLoSO...751980P. DOI:10.1371/journal.pone.0051980. PMC:3522634. PMID:23251670.
- ^ Liu، Lingzhi؛ Shao، Mei؛ Dong، Xiaohu؛ Yu، Xuefeng؛ Liu، Zhihong؛ He، Zhike؛ Wang، Ququan (15 أكتوبر 2008). "Homogeneous Immunoassay Based on Two-Photon Excitation Fluorescence Resonance Energy Transfer". Analytical Chemistry. ج. 80 ع. 20: 7735–7741. DOI:10.1021/ac801106w. PMID:18800850.
- ^ Przhonska، Olga V.؛ Webster، Scott؛ Padilha، Lazaro A.؛ Hu، Honghua؛ Kachkovski، Alexey D.؛ Hagan، David J.؛ Van Stryland، Eric W. (2010). "Two-Photon Absorption in Near-IR Conjugated Molecules: Design Strategy and Structure–Property Relations". Advanced Fluorescence Reporters in Chemistry and Biology I. Springer Series on Fluorescence. ج. 8. ص. 105–147. DOI:10.1007/978-3-642-04702-2_4. ISBN:978-3-642-04700-8.
| الفحص المجهري ثنائي الفوتون في المشاريع الشقيقة: | |