|
تضامنًا مع حق الشعب الفلسطيني |
سيلينيد الألومنيوم
اذهب إلى التنقل
اذهب إلى البحث
| سيلينيد الألومنيوم[1] | |
|---|---|
| أسماء أخرى | |
Aluminium(III) selenide |
|
| المعرفات | |
| رقم CAS | 1302-82-5 |
| بوب كيم (PubChem) | 164804 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | Al2Se3 |
| الكتلة المولية | 290.84 غ/مول |
| المظهر | مسحوق أصفر إلى بني |
| الرائحة | عديم الرائحة |
| الكثافة | 3.44 غ/سم3 |
| نقطة الانصهار | 947 °س، 1220 °ك، 1737 °ف |
| الذوبانية في الماء | يتفكك |
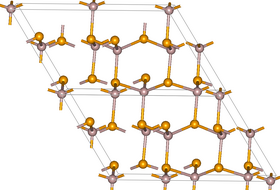
| البنية | |
| البنية البلورية | نظام بلوري أحادي الميل، رمز بيرسون، زمرة فراغية Cc, No. 9[2] |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
-566.9 كيلوجول/مول |
| إنتروبيا مولية قياسية S |
154.8 جول/مول كلفن |
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
سيلينيد الألومنيوم هو مركب كيميائي له الصيغة Al2Se3، ويكون على شكل بلورات صفراء.
التحضير
يحضر هذا المركب من تفاعل عنصري الألومنيوم والسيلينيوم عند درجة حرارة تقارب 1000 °س:[3]
الخواص
يوجد المركب في الشروط القياسية على شكل مسحوق بلوري أصفر إلى بني، وهو حساس للرطوبة، إذ يتحلمه بسرعة ليعطي غاز سيلينيد الهيدروجين:[4][5]
الاستخدامات
يستفاد من تفاعل التفكك المائي لمركب سيلينيد الألومنيوم في الحصول على غاز سيلينيد الهيدروجين،[6] المفيد في صناعة أشباه الموصلات.[3]
مراجع
- ^
Lide، David R. (1998). Handbook of Chemistry and Physics (ط. 87). Boca Raton, FL: CRC Press. ص. 4–40. ISBN:0-8493-0594-2
{{استشهاد بكتاب}}: صيانة الاستشهاد: postscript (link) - ^ Steigmann، G. A.؛ Goodyear، J. (1966). "The crystal structure of Al2Se3". Acta Crystallographica. ج. 20: 617. DOI:10.1107/S0365110X66001506.
- ^ أ ب Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis, 2011, ISBN 1-4398-1462-7, S. 12
- ^ Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 172
- ^ Langner, Bernd E. (2005) "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a23_525
- ^ Waitkins، G. R.؛ Shutt، R. (1946). "Aluminum Selenide and Hydrogen Selenide". Inorganic Syntheses. Inorganic Syntheses. ج. 2: 183–186. DOI:10.1002/9780470132333.ch55. ISBN:9780470132333.