|
تضامنًا مع حق الشعب الفلسطيني |
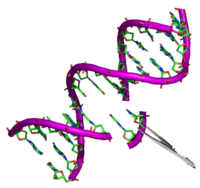
تحرير جيني
| جزء من سلسلة مقالات عن |
| علم الأحياء التركيبي |
|---|
| الدوائر البيولوجية التركيبية |
| تحرير جيني |
| الخلايا الاصطناعية |
| علم الأحياء الغريب |
| مواضيع أخرى |
التحرير الجيني (بالفرنسية: L'édition génomique)، (بالإنجليزية: Genome Editing) ويسمى أيضا التحرير الجيني بإنزيمات النيكلياز المعدلة وهي مجموعة من تقنيات التعديل الجيني من خلال «إعادة كتابة المادة الوراثية» لأي كائن حي من النبات والحيوان والبكتيريا والخمائر وهي في أول التطبيق على الإنسان. تعتبر هذه التقنية أكثر دقة بكثير من التقنيات السابقة للهندسة الوراثية حيث كانت التعديلات في أجزاء كبيرة مبنية على الحظ. أهم غايات التحرير الجيني هي علاج الأمراض المستعصية على الطب الحديث كالإيدز والتهاب الكبد الفيروسي والبتا تالاسيميا.
المبدأ والأهمية
من المناهج الشائعة في علم الأحياء الحديث هو تعديل تسلسل الحمض النووي (الوراثي) للكائن الحي (أو خلية واحدة) ومراقبة تأثير هذا التغيير على الكائن الحي (النمط الظاهري). إنّ قضية التحرير الجيني قضية شائكة، جاءت بعد اهتمام كثيف باستخدام أدوات «كريسبر» في تعديل صفات الأجنة البشرية. قد استخدم العلماء تقنية «كريسبر» (CRISPR) في التعديل الوراثي للناموس وذبابة الفاكهة Drosophila melanogaster. كما استطاع العلماء ـ من خلال الجمع بين تقنية «كريسبر»، وإحدى تقنيات علم الأحياء الجزيئي، تُسَمَّى «الدفع الجيني» (gene drive)، زيادة كفاءة نقل هذه التعديلات إلى النسل بشكل كبير. وبمجرد إجراء هذه التغيرات الجينية؛ فهي تنتشر بذاتها، وإذا خرجَت من المعمل؛ فسينتشر تأثيرها في كل جيل جديد.[1] اعتمَد أول تطبيق لتقنية التحرير الجيني في الإنسان منهجًا معمليًّا كاملا. ففي العام 2014، نشرت شركة «سانجامو» للعلوم الحيوية (Sangamo BioSciences) في ريتشموند بكاليفورنيا نتائج من تجربتها الإكلينيكية التي استخدمت فيها خلايا مُعدلة جينيًّا لعلاج 12 مريضًا بفيروس نقص المناعة البشرية.[2] وبدلًا من استخدام إنزيمات «TALENs»، استخدم الباحثون إنزيم نوكلييز أصابع الزنك (ZFN) قاطع الحمض النووي، الذي يقوم بقطع الجين المخصص لنوع من البروتين الموجود على الخلايا التائية التي يستهدفها فيروس نقص المناعة البشرية، وذلك إثر إضافة الإنزيم للدم المُستخلَص من المرضى؛ ثم عاوَد الفريق حقن تلك الخلايا في دم المرضى.
إن العلاجات التجريبية عامةً، سواء أكانت خارج، أم داخل الجسم الحي، تحمل خطر التسبب في تقطعات أو طفرات في أماكن أخرى في الجينوم، إلا أن التجارب داخل الجسم الحي تتضمن مخاوف أخرى؛ إذ إن الناقل الذي يوصل الحمض النووي يمكنه أن يبقى نشطًا في الجسم لعدة سنوات بعد حقنه؛ ما قد يؤدي إلى أمورٍ غير متوقَّعة، مثل إثارة رد فعل مناعي ضد إنزيم تقطيع الحمض النووي.. وهو ما يُقلِق عالِم الأحياء فالدر آرودا، الذي يعمل بجامعة بنسلفانيا في فيلادلفيا حاليًّا على استكشاف علاجات لمرض سيولة الدم، تتضمن العلاج الجيني التقليدي. ومن جانبها، صرحت شركة «سانجامو» بأنها لم تجد دليلًا على مثل تلك الآثار الجانبية في دراساتها على الحيوانات. أما قاسم، فيقول إن التحديات الأخرى التي يتضمنها التحرير الجيني في الجسم الحي تشمل التأكد من إتمام تحرير عدد كاف من الخلايا المُستهدَفة، وإن الناقل يوصل حمولته إلى المكان الصحيح في الجسم.[3]
أدوات التحرير الجيني: المقص الحيوي الجزيئي
تم تطوير أربع عائلات من إنزيمات النيكلياز المعدلة لأجل هذه التقنية:
- نيكلياز بأصابع الزنك (بالإنجليزية: Zinc-finger nucleases ZFNs)
- النيكلياز المستفعل نوع منشط للنسخ (بالإنجليزية: Transcription activator-like effector nucleases TALEN)
- التكرارات القصيرة المتناوبة المجمعة والمتباعدة بانتظام أو كريسبر (بالإنجليزية: Clustered Regularly Interspaced Short Palindromic Repeats CRISPR)
- الميغانيكلياز (بالإنجليزية: Meganuclease)
تعتبر هذه الإنزيمات كمقصات حيوية جزيئية لها الدور الأساسي في نجاح تجارب التحرير الجيني حتى على الإنسان، واختيرت على رأس أبرز الإنجازات العلمية لعام 2015.
تاريخيًا
كانت تقنية تحرير الجينوم رائدةً في التسعينيات، قبل ظهور طرق تحرير الجينات الحالية الشائعة القائمة على النوكلياز، ومع ذلك، كان استخدامها محدودًا بسبب انخفاض كفاءة التحرير. اختارت مجلة نيتشر تحرير الجينوم باستخدام نوكليازات هندسية جينية، أي الفئات الرئيسية الثلاثة لهذه الإنزيمات، والتي هي نوكلياز إصبع الزنك (ZFNs)، والنوكليازات المستجيبة الشبيهة بمنشط النسخ (TALENs) والميغانوكليازات المُعدلة هندسيًا كأسلوب عام 2011 لذلك العام. اختارت مجلة ساينس نظام كريسبر كيز باعتباره التقدم العلمي الأهم لعام 2015.[4]
اعتبارًا من عام 2015، استُخدمت أربع عائلات من النوكليازات الهندسية هي: الميغانوكلياز، ونوكلياز إصبع الزنك (ZFNs)، والنوكليازات المستجيبة الشبيهة بمنشط النسخ (TALEN)، والتكرارات المتناوبة القصيرة المتباعدة بانتظام (البروتين المرتبط بكريسبر 9). يوجد تسع تقنيات تحرير جيني متاحة منذ عام 2017.[5]
في عام 2018، استخدمت الطرق الشائعة للتحرير الجيني نوكليازًا هندسيًا أو «مقص جزيئي». تُنشئ هذه النيوكليزات فواصل شرائط مزدوجة خاصة بالموقع (DSBs) في المواقع المرغوبة في الجينوم. تُصلَح فواصل حبل الدنا المزدوج المستحثة من خلال الربط النهائي غير المتماثل (NHEJ) أو إعادة التركيب المتماثل (HR)، مما يؤدي إلى حدوث طفرات مستهدفة (تعديلات).[6]
في مايو 2019، أفاد محامون في الصين، في ضوء ما زُعم عن التعديل الجيني الذي أجراه العالم الصيني هي جيانكوي لأول إنسان مُعدّل جينيًا (انظر جدل لولو ونانا)، صياغة لوائح تبين أن أي شخص يتلاعب بالجينوم البشري عن طريق تقنيات تحرير الجينات، مثل كريسبر، سيكون مسؤولًا عن أي عواقب سلبية ذات صلة. نوقش منظور تحذيري حول النقاط العمياء المحتملة ومخاطر تقنية كريسبر والتقنيات الحيوية ذات الصلة، مع التركيز على الطبيعة العشوائية لعمليات التحكم الخلوية.[7]
صمم معهد روزلين التابع لجامعة إدنبرة خنازير مقاومة لفيروس يسبب متلازمة الجهاز التنفسي والجهاز التناسلي في الخنازير، والتي تكلف مربي الخنازير في الولايات المتحدة وأوروبا 2.6 مليار دولار سنويًا.
في فبراير 2020، أظهرت تجربة أمريكية بأمان تعديل الجينات CRISPR على 3 مرضى بالسرطان. في عام 2020، صدرت الموافقة على بيع طماطم صقلية روج هاي غابا، وهي طماطم تنتج المزيد من الأحماض الأمينية التي يُقال إنها تعزز الاسترخاء، للبيع في اليابان.[8]
في عام 2021، خططت إنجلترا (وليس بقية المملكة المتحدة) لإزالة القيود المفروضة على النباتات والحيوانات المعدلة وراثيًا، والانتقال من اللوائح المتوافقة مع الاتحاد الأوروبي إلى قواعد أقرب إلى تلك المعمول بها في الولايات المتحدة وبعض الدول الأخرى. وجد تقرير صادر عن المفوضية الأوروبية في أبريل 2021 «مؤشرات قوية» على أن القوانين التنظيمية الحالية غير متناسبة مع تقنيات تحرير الجينات. في وقت لاحق من عام 2021، أعلن الباحثون عن بديل لتقنية كريسبر، والتي عُرفَت بالنشاط الموجه للعناصر المتنقلة (OMEGA) بما في ذلك IscB وIsrB وTnpB كنوكليازات داخلية موجودة في الجينات القافزة، والتي توجهها الرنا المرسال نوع ω الصغيرة.[9]
المراجع
- ^ مجلة Nature الطبعة العربية، العدد 34 ، 1 جويلية 2015 ، ص10. نسخة محفوظة 08 ديسمبر 2016 على موقع واي باك مشين.
- ^ [1] Tebas, P., Stein, D., Tang, W. W., Frank, I., Wang, S. Q., Lee, G., & Holmes, M. C. (2014). Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. New England Journal of Medicine, 370(10), 901-910.. نسخة محفوظة 26 مارس 2017 على موقع واي باك مشين.
- ^ مجلة Nature الطبعة العربية، العدد 40 ، 1 جانفي 2016 ، ص24. نسخة محفوظة 22 مارس 2016 على موقع واي باك مشين.
- ^ Science News Staff (17 ديسمبر 2015). "Breakthrough of the Year: CRISPR makes the cut". مؤرشف من الأصل في 2022-01-21.
- ^ Church G. "The future of genetic codes and BRAIN codes". YouTube. NIHvcast. مؤرشف من الأصل في 2021-04-19. اطلع عليه بتاريخ 2017-02-10.
- ^ Puchta H، Fauser F (2013). "Gene targeting in plants: 25 years later". The International Journal of Developmental Biology. ج. 57 ع. 6–8: 629–37. DOI:10.1387/ijdb.130194hp. PMID:24166445.
- ^ Cyranoski D (مايو 2019). "China set to introduce gene-editing regulation following CRISPR-baby furore". Nature. DOI:10.1038/d41586-019-01580-1. PMID:32424191. S2CID:182604140. مؤرشف من الأصل في 2022-06-18. اطلع عليه بتاريخ 2019-05-20.
- ^ Stokstad, Erik (26 May 2021). "U.K. set to loosen rules for gene-edited crops and animals". Science | AAAS (بEnglish). Archived from the original on 2021-08-17. Retrieved 2021-05-27.
- ^ "New programmable gene editing proteins found outside of CRISPR systems". Broad Institute (بEnglish). 9 Sep 2021. Archived from the original on 2022-03-02. Retrieved 2021-10-04.
| تحرير جيني في المشاريع الشقيقة: | |