|
تضامنًا مع حق الشعب الفلسطيني |
تأثير المجال (كيمياء)
هذه مقالة غير مراجعة. (ديسمبر 2020) |
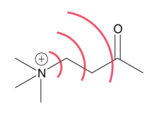
تأثير المجال هو استقطاب جزيء عبر الفضاء. التأثير يحدث بسبب مجال كهربائي ناتج عن توطين الشحنة في جزيء. [1] هذا المجال ، الذي هو بديل ومعتمد على التشكل ، يمكن أن يؤثرعلى البنية والتفاعل من خلال معالجة موقع كثافة الإلكترون في الروابط و / أو الجزيء الكلي. [2] عملية استقطاب الجزيء من خلال روابطه ظاهرة منفصلة تُعرف بالحث . [3] تكون التأثيرات الميدانية ضعيفة نسبيًا ، وتتناقص بسرعة مع المسافة ، ولكن لا يزال يُكتشف أنها تغير الخصائص الجزيئية مثل الحموضة.

مصادر ميدانية


يمكن أن تنشأ التأثيرات الميدانية من المجال الكهربائي ثنائي القطب لرابطة تحتوي على ذرة كهربية أو بدائل سحب الإلكترون ، وكذلك تحتوي على ذرة أو عنصر بديل يحمل شحنة رسمية. [1] يمكن لكلًا من اتجاه ثنائي القطب وتركيز الشحنة تحديد شكل المجال الكهربائي للجزيء والذي سيعمل على توطين كثافة الإلكترون نحو أو بعيدًا عن المواقع الاهتمام ، مثل الهيدروجين الحمضي. عادةً ما ترتبط التأثيرات الميدانية بمحاذاة مجال ثنائي القطب فيما يتعلق بمركز التفاعل. [5] نظرًا لأن هذه تحدث من خلال تأثيرات الفضاء ، فإن التركيب ثلاثي الأبعاد للجزيء يعد اعتبارًا مهمًا. قد يتم مقاطعة الحقل بواسطة روابط أو ذرات أخرى قبل التكاثر إلى موقع رد الفعل محل الاهتمام. يمكن أن تتحرك ذرات السالبية الكهربية المختلفة معًا بشكل أقرب مما يؤدي إلى استقطاب السندات عبر الفضاء الذي يحاكي التأثير الاستقرائي من خلال الروابط. [6] سيكلوهبتان و ثنائي سيكلوكتان (يُرى على اليسار) مركبان يُعزى فيهما التغيير في الحموضة مع الاستبدال إلى تأثير المجال. [4] يتم توجيه ثنائي القطب CX بعيدًا عن مجموعة حمض الكربوكسيل ، ويمكنه سحب كثافة الإلكترون بعيدًا لأن مركز الجزيء فارغ ، مع ثابت عازل منخفض ، وبالتالي فإن المجال الكهربائي قادر على الانتشار بأقل مقاومة.
فائدة التأثير
يمكن أن يحاذي ثنائي القطب لتحقيق الاستقرار أو عدم الاستقرار في تكوين أو فقدان الشحنة ، وبالتالي تقليل ( في حالة الإستقرار) أو زيادة (في حالة عدم استقرار) حاجز التنشيط لحدث كيميائي. [1] لذلك يمكن للتأثيرات الميدانية ضبط الحموضة أو القاعدة الأساسية للروابط داخل مجالاتها من خلال التبرع بكثافة الشحن أو سحبها. [5] فيما يتعلق بالحموضة ، هناك اتجاه شائع يجب ملاحظته وهو أنه ، بشكل استقرائي ، فإن بديل سحب الإلكترون بالقرب من بروتون حمضي سيخفض pKa (أي يزيد الحموضة) ، وبالتالي ، فإن البديل المتبرع بالإلكترون سيرفع pKa . [7] سيكون لإعادة تنظيم الشحن بسبب التأثيرات الميدانية نفس النتيجة. ينتشر الحقل ثنائي القطب الكهربائي عبر الفراغ حول الجزيء في اتجاه البروتون الحمضي أو في منتصفه ، مما يقلل من الحموضة ، بينما يزيد ثنائي القطب الموجه بعيدًا من الحموضة ويطيل في نفس الوقت رابطة XH. [8] وبالتالي يمكن أن تساعد هذه التأثيرات في ضبط حموضة / قاعدية الجزيء لبروتونات / نزع بروتين مركب معين ، أو تعزيز قدرة مانح رابطة الهيدروجين على التعرف الجزيئي أو تطبيقات استشعار الأنيون. [9] [10] تم عرض التأثيرات الميدانية أيضًا في المجالات المستبدلة للسيطرة على خرائط الجهد الكهروستاتيكي ، وهي خرائط لكثافة الإلكترون المستخدمة لشرح التفاعلات بين الجزيئات. [2]
أدلة على تأثيرات المجال

التأثيرات الإلكترونية الموضعية هي مزيج من التأثيرات الاستقرائية وتأثيرات المجال. بسبب وجود تشابه في هذه التأثيرات ، من الصعب فصل مساهماتها في البنية الإلكترونية للجزيء.ورغم ذلك ، هناك مجموعة كبيرة من المؤلفات المكرسة لتطوير فهم الأهمية النسبية للاستقراء والتأثيرات الميدانية من خلال تحليل المركبات ذات الصلة في محاولة لتحديد كل تأثير بناءً على البدائل الحالية والهندسة الجزيئية. [4] [12] [13] [14] [15] على سبيل المثال ، تختلف المركبات الثلاثة الموجودة على اليمين ، جميع الأوكتان ، فقط في عدد الروابط بين مجموعة سحب الإلكترون X ومجموعة وظيفية حمضية ، والتي هي تقريبًا نفس المسافة المكانية في كل مركب. [11] من المعروف أن البديل المسحوب للإلكترون سوف يقلل من بي كي آي لبروتون معين (أي يزيد الحموضة) بشكل استقرائي. [7] إذا كان الحث هو التأثير السائد في هذه المركبات ، يجب أن تزداد الحموضة خطيًا مع عدد المسارات الاستقرائية المتاحة (الروابط). ومع ذلك، يظهر البيانات التجريبية التي تؤثر على الحموضة في أوكتان وما يتصل بها من كوبان هي مشابهة جدا، وبالتالي يجب أن يكون التأثير المهيمن عبر الفضاء.


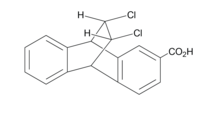
في الصورة الموضحة أدناه وإلى اليسار ، توفر الكلور تأثيرًا مجاليًا. تركيز الشحنة السالبة على كل كلور له تأثير عبر الفضاء يمكن رؤيته في قيم بي كي آي النسبية. عندما يتم توجيه الكلور فوق مجموعة حمض الكربوكسيل ، يكون بي كي آي أعلى لأن فقدان البروتون يكون أقل ملاءمة بسبب زيادة الشحنة السالبة في المنطقة. ينتج عن فقدان البروتون شحنة سالبة تكون أقل استقرارًا إذا كان هناك بالفعل تركيز متأصل للإلكترونات. [16] يمكن أن يُعزى هذا إلى تأثير المجال لأنه في نفس المركب مع الكلورين الموجه بعيدًا عن المجموعة الحمضية ، يكون pKa أقل ، وإذا كان التأثير استقرائيًا ، فلن يكون موضع التوافق مهمًا. [17]

المراجع
- ^ أ ب ت Anslyn, Eric V.، Dougherty, Dennis A. (2006). Modern physical organic chemistry. Sausalito, CA: University Science. ISBN:9781891389313. OCLC:55600610.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Wheeler، Steven E.؛ Houk، K. N. (2009). "Through-Space Effects of Substituents Dominate Molecular Electrostatic Potentials of Substituted Arenes". Journal of Chemical Theory and Computation. ج. 5 ع. 9: 2301–2312. DOI:10.1021/ct900344g. ISSN:1549-9618. PMID:20161573.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ L.، Patrick, Graham (1997). Beginning organic chemistry. Oxford: Oxford University Press. ISBN:978-0198559368. OCLC:37293506.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت ث Wilcox، Charles F.؛ Leung، Constance (1968). "Transmission of substituent effects. Dominance of field effects". Journal of the American Chemical Society. ج. 90 ع. 2: 336–341. DOI:10.1021/ja01004a023. ISSN:0002-7863.
- ^ أ ب Dewar، Michael J. S.؛ Grisdale، Patrick J. (1962). "Substituent Effects. I. Introduction". Journal of the American Chemical Society. ج. 84 ع. 18: 3539–3541. DOI:10.1021/ja00877a023. ISSN:0002-7863.
- ^ Daley, Richard F.، Daley, Sally J. (2005). Organic Chemistry (ط. 1.3). Daley Press.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Siggel، Michele R. F.؛ Streitwieser، Andrew.؛ Thomas، T. Darrah. (1988). "The role of resonance and inductive effects in the acidity of carboxylic acids". Journal of the American Chemical Society. ج. 110 ع. 24: 8022–8028. DOI:10.1021/ja00232a011. ISSN:0002-7863.
- ^ Parveen، Salma؛ Chandra، Asit K.؛ Zeegers-Huyskens، Thérèse (2009). "Theoretical Investigation of the Interaction between Fluorinated Dimethyl Ethers (nF = 1−5) and Water: Role of the Acidity and Basicity on the Competition between OH···O and CH···O Hydrogen Bonds". The Journal of Physical Chemistry A. ج. 113 ع. 21: 6182–6191. Bibcode:2009JPCA..113.6182P. DOI:10.1021/jp902244j. ISSN:1089-5639. PMID:19422184.
- ^ Molina، Pedro؛ Zapata، Fabiola؛ Caballero، Antonio (2017). "Anion Recognition Strategies Based on Combined Noncovalent Interactions". Chemical Reviews. ج. 117 ع. 15: 9907–9972. DOI:10.1021/acs.chemrev.6b00814. ISSN:0009-2665. PMID:28665114.
- ^ Tresca، Blakely W.؛ Hansen، Ryan J.؛ Chau، Calvin V.؛ Hay، Benjamin P.؛ Zakharov، Lev N.؛ Haley، Michael M.؛ Johnson، Darren W. (2015). "Substituent Effects in CH Hydrogen Bond Interactions: Linear Free Energy Relationships and Influence of Anions". Journal of the American Chemical Society. ج. 137 ع. 47: 14959–14967. DOI:10.1021/jacs.5b08767. ISSN:0002-7863. PMID:26539974.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب ت ث Cole، Thomas W.؛ Mayers، Carolyn J.؛ Stock، Leon M. (1974). "Chemistry of the bicyclo[2.2.2]octanes. XV. Dissociation constants of 4-substituted cubane-1-carboxylic acids. Evidence for the field model for the polar effect". Journal of the American Chemical Society. ج. 96 ع. 14: 4555–4557. DOI:10.1021/ja00821a032. ISSN:0002-7863.
- ^ Progress in Physical Organic Chemistry, Volume 13 - Wiley Online Library. Progress in Physical Organic Chemistry (بEnglish). 1981. DOI:10.1002/9780470171929. ISBN:9780470171929.
- ^ Stock، Leon M. (1972). "The origin of the inductive effect". Journal of Chemical Education. ج. 49 ع. 6: 400. Bibcode:1972JChEd..49..400S. DOI:10.1021/ed049p400. ISSN:0021-9584.
- ^ Hansch، Corwin.؛ Leo، A.؛ Taft، R. W. (1991). "A survey of Hammett substituent constants and resonance and field parameters". Chemical Reviews. ج. 91 ع. 2: 165–195. DOI:10.1021/cr00002a004. ISSN:0009-2665.
- ^ Dewar، Michael J. S.؛ Grisdale، Patrick J. (1962). "Substituent Effects. IV.1 A Quantitative Theory". Journal of the American Chemical Society. ج. 84 ع. 18: 3548–3553. DOI:10.1021/ja00877a026. ISSN:0002-7863.
- ^ Pearson، Ralph G. (1963). "Hard and Soft Acids and Bases". Journal of the American Chemical Society. ج. 85 ع. 22: 3533–3539. DOI:10.1021/ja00905a001. ISSN:0002-7863.
- ^ أ ب ت Grubbs، E.J.؛ Fitzgerald، R.؛ Phillips، R.E.؛ Petty، R. (1971). "The transmission of substituent effects in isomeric dichloroethano-bridged anthracene derivatives". Tetrahedron. ج. 27 ع. 5: 935–944. DOI:10.1016/s0040-4020(01)92492-5.