|
تضامنًا مع حق الشعب الفلسطيني |
علم المياه
علم المياه |

علم المياه أو الهيدرولوجيا هي دراسة المياة وتوزيعها فوق الأرض وصفاتها وخصائصها الطبيعية والكيميائية وتفاعلها مع البيئة والكائنات الحية.[1][2][3]
أشتقت الاسم من الكلمات الإغريقية «هيدرو» والتي تعني الماء و «لوغوس» التي تعني العلم.
والهيدرولوجيا هي أحد أفرع الجغرافيا الطبيعية Physical Geography , وقد برع فيه الكثير من الجغرافيين على مر العصور.
ويختص هذا الفرع من الجغرافيا الطبيعية بدراسة الماء على سطح الأرض وخصائصه وتوزيعه وتواجده ودوراته وايضا تهتم الهيدرولوجيا بالآثار البيئية ذات الصلة بالماء.
ومن اهتمامات علم الهيدرولوجيا:
1.الدراسات المتعلقة بالكوارث الخاصة بالمياة والتغيرات الهيدرولوجية.
2. المياة الجوفية في بيئة متغيرة.
3.التصدي لندرة المياة ونوعية المياة.
4.المياة والاستقرارت البشرية في المستقبل.
5.التوازانات البيئية والهندسية لعالم مستدام.
6.التعليم في مجال المياة، طريق لتحقيف الأمن المائي.
أعلنت الأمم المتحدة أن العقد 2005 – 2015 هو عقد «الماء لأجل الحياة». وأشار تقرير للأمم المتحدة إن خُمس سكان كوكب الأرض يفتقدون المياة الصالحة للشرب بسبب سوء إدارة الموارد حيث يعيش فقراء العالم على أقل من جالونين ونصف من المياة في اليوم وهو ما يعادل واحد من ثلاثين من الاستهلاك اليومي للدول الغنية. لأن 70 %من سطح الأرض ماء و97,5% منها مياة مالحة في المحيطات والبحار و 1% مياه عذبة في الأنهار والبحيرات وباطن الأرض صالحة للاستخدام الآدمي و68,9 % من المياه العذبة فوق الكوكب في شكل جليد. وجميع الحضارات القديمة قد نشأت حول ضفاف الأنهار بالقرب من مصادر المياه كما في الفرات بالعراق والنيل بمصر. وحاليا أصبحت مشكلة المياه تتصدر هموم سكان العالم. فنجد أكثر من خمس سكانه يعانون من أزمة توفر المياه العذبة والنقية. مما سيجعل الصراع القادم في العالم حول السيطرة على مصادر المياه. و19% من الكهرباء في العالم من الطاقة المائية.

الماء اسم يطلق على الحالة السائلة لمركب الهيدروجين والأكسجين. وكان الفلاسفة الأقدمون يعتبرون الماء كعنصر أساسي لكل المواد السائلة وظل هذا الاعتقاد سائدًا حتى القرن 18. ففي عام 1781 استطاع العالم الكيميائي البريطاني هنري كافنديش تخليق الماء بحرق الهيدروجين في الهواء محدثًا فرقعة ولم يكن كنمه هذه التجربة معروفًا حتى أتى الكيماوي الفرنسي أنطوان لافوازييه وأثبت أن الماء ليس عنصرًا بل مركبًا من الهيدروجين والأكسجين ثم اكتشف العالمان الفرنسي جوزيف لويس والألماني ألكسندر فون هومبولت أن الماء يتكون من حجمين من الهيدروجين وحجم من الأكسجين كما هما في التركيبة (H2O) السائدة حاليًا. أي أن الماء يتكون من «جزيئات». ويحتوي كل جُزَيْء على ثلاثة ذرات عبارة عن ذرتين هيدروجين وذرة أكسجين. وقطرة الماء الواحدة تحتوي على الملايين من هذه الجزيئات وكل الهيدروجين في الماء وزنه الجزيئي 1.
لقد وجد بالماء نسبة متدنية جدًا من الماء الثقيل أو ما يسمي بـ«أكسيد الدوتيريوم» (D2O) والديتريم هو نظير الهيدروجين ذو وزن جزيئي 2. كما به آثار قليلة من أكسيد التريتيوم (T2O) والتريتيم نظير للهيدروجين وزنه الجزيئي 3. فالهيدروجين، هو أخف عناصر الكون، وأكثرها وجوداً به، حيث تصل نسبته إلى أكثر من 90%، وهو غاز قابل للاشتعال. والأكسجين غاز نشط يساعد على الاشتعال. ويُكَوِّن حوالي 20% من الهواء الجوي، وهو ضروري لتنفس الكائنات الحية، ويدخل في التركيب العضوي لجميع الأحياء، مع الهيدروجين والكربون. وعلى الرغم من أن الهيدروجين غاز مشتعل، والأكسجين غاز يساعد على الاشتعال، إلاّ أنه عند اتحاد ذرتي هيدروجين مع ذرة أكسجين، ينتج الماء الذي يطفئ النار.؟ورغم أن الماء مكوَّن من ذرات أكسجين إلا أنه ليس الأكسجين الذي تحتاجه الكائنات المائية الحية كالسمك والنباتات البحرية. لأنها تعيش على الأكسجين الذائب كغاز في الماء. والمياة الجارية في الأنهار والمحيطات والمجاري المائية بها نسبة أعلى من الأكسجين عمَّا في المياة الراكدة بالبرك والمستنقعات التي تعيش بها أحياء مائية تستهلك الأكسجين بها.
ليس صحيحًا أن مياة الأمطار هي أنقى أنواع المياة العذبة. فهي تحتوي على معادن مذابة من الرياح الملوثة وجسيمات من التراب وغازات مذابة كثاني أكسيد الكربون وثاني أكسيد الكبريت كما في الأمطار الحمضية. والجليد أثناء تكوينه يمتص من الجو غاز ثاني أكسيد الكربون وغيره من الغازات الموجودة به ومواد عضوية وغير عضوية. والمياة في انسيابها فوق قشرة الأرض تتفاعل مع المعادن في التربة والصخور وتذوب بالمياة السطحية والجوفية كبريتات وكلوريدات وبيكربونات الصوديوم والبوتاسيوم واكاسيد الكالسيوم والماغنيسيوم. والمياة السطحية قد تتلوث بمياة المجاري والنفايات الصناعية. وقد تتسرب مياة النفايات والمجاري للمياة الجوفية أو الآبار الضحلة بما فيها فضلات الإنسان والحيوانات مكونة موادًا نيتروجينية وكلوريداتية. ومعظم المياة الطبيعية للشرب من الآبار العميقة بها مادة الفلوريد بكميات متفاوتة والتي تقلل تسوس الأسنان. ومياه البحار والمحيطات يتركز بها ملح الطعام (كلوريد الصوديوم).
السحب المطيرة
يلعب المياه دورا كبيرا في ظاهرة البرق والرعد. لأن البرق سببه تفريغ كهربائي مرئي بين سحب مطيرة أو بين سحابة مطيرة والأرض محدثا صوتا مدويا هو الرعد. ويعتقد علماء الأرصاد الجوية أن الجليد عامل ضروري في ظاهرة البرق التي لاتحدث إلا عندما يتكون الجليد في الطبقات العليا من السحب الرعدية. حيث بينت التجارب أن الماء عندما يتجمد يصبح الجليد سالب الشحنة كهربائيا والماء موجب الشحنة.لهذ1 توزع الشحنة في سحابة مطيرة كشحنات موجبة في منطقة أولى من السحابة وشحنات سالبة في منطقة أخرى وتسمى البنية الكهربائية للسحابة أنها ثنائية القطب ويحدث يومياً في مختلف أرجاء العالم حوالي 44ألف عاصفة رعدية و 8مليون وميض برقي.
التفريغ الكهربائي البرقي هو انتقال الشحنة الكهربائية الموجبة أو السالبة من منطقة في السحابة إلى منطقة أخرى أو بين السحابة والأرض. وتحدث السحب الرعدية المعتدلة بضع ومضات في الدقيقة وتنتج قدرة طاقية تساوي بضع مئات من الميجاواطات، وهي قدرة محطة نووية صغيرة لتوليد الطاقة الكهربائية. فالطاقة الكهربائية بالسحابة تستمد في البداية من الحرارة التي تسبب تمدد بخار الماء فيصير أقل كثافة من الهواء المحيط به، ولذلك يصعد، وأثناء صعوده يتكاثف أو يتجمد فتنطلق الحرارة الكامنة ويبدأ حينئذ الماء السائل أو الجليد بالسقوط.وفي لحظة التفريغ البرقي تنقص القوى الكهربائية فجأة، وتزداد سرعة هبوط المطر على نحو ملحوظ.
دورة الماء

فوق الأرض نجد أن دورة الماء تبين أن الماء فوق الأرض في حركة دائمة منذ بلايين السنين ما بين سائل أو بخار أو مادة صلبة. فالأرض لاتصلح للحياة بدون الماء. ودورة المياه ليس لها نقطة بداية وتسيرها الشمس. فنجدها تسخن مياه المحيطات حيث توجد معظم مياه الدنيا. فيتبخر بعضها بالهواء. كما نجد ان الجليد والثلج يمكن أن يتساميا مباشرة ويتحولان من الحالة الصلبة لبخار ماء مباشرة. فنجد التيارات الهوائية ترقع البخار بالجو مع ما ينتحه النبات أو ما يتبخر من التربة من بخار ماء حيث يبرد بطبقات الجو العليا متكثفا ومكونا سحبا تسيرها الرياح حول الأرض لتنزل علي الأرض كمطر أو جليد مكونة القلنسوة الجليدية التي تحتفظ بالمياه المتجمدة لآلاف السنين.
قد ينصهر الجليد في المناخ الدافيء متحولا لماء دافق فوق الأرض كمجاري وأنهار أو تبتلعه التربة كمياه جوفية أو يصب في المحيطات والبحيرات ليعود لسيرته الأولي في عملية تدويرية منتظمة ومنظمة بحرارة الشمس. ويتميز بخار الماء بالتكثيف من الجو الدافيء لو لامس سطحا باردا. وهذا ما نلاحظه حول كوب ماء مثلج حيث يتكون عليه من الخارج قطرات الماء. ولو تصاعد الهواء لطبقات الجو العليا الباردة تكثف ما به من بخار ماء وتكونت قطرات تتجمع معا مكونة السحب. وهذا ما نلاحظه في الجو البارد عندما نتنفس. فنري هواء الزفير الدافيء يخرج ليصطدم بالهواء البارد فيتكثف ما به من بخار مكونا سحابة. فمصادر المياه في الطبيعة هي الأمطار ومياه البحار والبحيرات حيث المياه سطحية ومياه الآبار والينابيع حيث المياه جوفية. فماء المحيطات والبحار يصعد إلى الهواء، عن طريق عملية التبخر، حيث يُكوِّن السحاب، الذي تدفعه الرياح إلى مناطق مختلفة. ويتكثف ويهطل أمطاراً على الأرض. ثم يرجع إلى المحيطات مرة أخرى.
هناك كمية قليلة من السحاب، الذي يتكّون من خلال عملية البخر من الرطوبة، الموجودة في سطح التربة وعملية النتح من أوراق النبات.ثم يتكثف هذا السحاب، ليسقط أمطاراً على الأرض. وتسقط معظم هذه الأمطار، مرة أخرى، في المحيطات والبحار، ويتبقى جزء قليل يسقط على اليابسة..ثم تبدأ دورة جديدة للمياه من المحيطات، إلى الهواء، إلى الأرض، ثم إلى المحيط. وهذه الدورة الدائمة لمياه الأرض، تُسمى دورة الماء. ونتيجة لهذه الدورة، فإن كمية الماء العذب الموجودة على سطح الأرض، هي الكمية نفسها منذ قديم الأزل. وهذه الكمية يعاد تدويرها مرة بعد مرة
صفات الماء
الماء النقي سائل شفاف عديم اللون لا رائحة له، يستوي في ذلك الماء المالح والماء العذب. إلاّ أن الماء العذب عديم الطعم، بينما الماء المالح له طعم مالحا؛ نتيجة ذوبان أملاح به. والماء له زرقة خفيفة تتدرج حسب عمق المياه في البحار والمحيطات، والمياه النقية تغلي عند درجة 100 مئوية والصفر المئوي في مستوي سطح البحر حيث يكون الضغط الجوي العادي 76سم زئبقي. أما فوق المرتفعات حيث يقل الضغط الجوي نجد أن الماء يغلي عند درجة أقل من 100 درجة مئوية. وهذا ما يجعل بيضة مسلوقة تأخذ وقتا حتى تسوي فوق جبل، ولو أذيبت مادة في الماء، فإن درجة التجمد تنخفض. ولهذا يرش الملح أثناء فصل الشتاء فوق الشوارع لمنع تكون الجليد. عسر الماء الطبيعي سببه أملاح الكالسيوم والماغنسيوم. ولوكان العسر للمياه سببه بيكربونات وكربونات الكالسيوم والماغنيبوم فيعتبر عسرا مؤقتا ويمكن ازالته بالغليان.
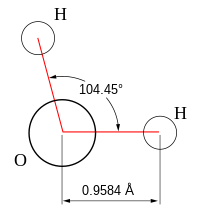
أما عسر المياه الدائم فيمكن ازالته بطرق كيماوية. والماء كأي سائل يأخذ شكل الإِناء الذي يوضع فيه. ويمكن تحويله إلى الحالة الغازية عندما يتبخر بتأثير الحرارة، كـما بمكن تحويله إلى حالة صلبة عندما يصبح ثلجا عند درجة الصفر المئوي. ويرتبط الهيدروجين الموجب الشحنة الكهربائية بالأكسجين السالب الشحنة الكهربائية داخل جزيء الماء، برابطة تساهمية تشترك فيها كل ذرة بجزء منها مع ذرة أخرى، لتكون جزيئاً قوياً للغاية يصعب تحلله.و كل جزيء ماء يتجاذب بالجزيئات المجاورة له، من خلال تجاذب كهربي بشكل يشبه قطبي المغناطيس. فطرف ذرة الأكسجين يمثل شحنة سالبة، وطرفا ذرتي الهيدروجين يمثلان شحنة موجبة. ونتيجة لهذا الاختلاف في الشحنات الكهربية، تتجاذب كل ذرة هيدروجين في جزئ الماء، مع ذرة أكسجين في الجزيء المجاور، بنوع من التجاذب الكهربي، يطلق عليه « رابطة هيدروجينية » وتُعد الروابط التساهمية والهيدروجينية بين جزيئات الماء مسؤولة عن الخواص الفريدة للماء. لأن الجزيئات في حركة دائمة. فسرعة حركة هذه الجزيئات تولد الحالة التي يكون عليها الماء سواء أكانت غازية (بخار ماء) أو سائلة (ماء سائل) أو صلبة (جليد). وكل جزيئات الماء تجذب بعضها البعض وهذا ما جعلها تتجمع معا وهذا ما يجعل نقطة الماء كروية الشكل. والماء النقي ليس حامضيا ولا قلويا بل متعادل (أس هيدروجيني 7) ويذيب معظم المواد ولاسيما في التربة أو في النبات أوفي أجسامنا.
وعندما تنخفض درجة حرارة الماء إلى درجة الصفر المئوي، تفقد جزيئات الماء طاقتها، وتقل حركتها، ويزيد ترابطها بالروابط الهيدروجينية، بما يزيد من الفراغات بين جزيئات الماء كما في حالة الجليد. حقيقة المواد تنكمش بالبرودة. والماء حينما يبرد، ينكمش أيضا حتى يصل إلى 4 درجات مئوية، ثم يبدأ بعدها في التمدد بزيادة انخفاض درجة الحرارة. فالماء عندما يتجمد يتمدد في الحجم وتقل كثافته، ويطفو كقشرة من الجليد فوق سطح الماء. ولولا هذه الخاصية الشاذة والعلاقة بين انخفاض الكثافة وانخفاض درجة الحرارة للماء، لازدادت كثافة الثلج المتكون على السطح عن بقية الماء، وهبط إلى القاع، معرضاً سطح الماء، الذي تحته، إلى درجة حرارة منخفضة. فتتجمد كل طبقات الماء، في مياه المناطق القطبية، أوالمتجمدة بسبب شدة البرودة. ويستحيل معها الحياة. لكن الحقيقة نجدها مع انخفاض درجة حرارة الجو، تتجمد طبقات الماء العليا فقط، وتقل كثافتها وتتمدد، فتطفو على سطح الماء، وتعزل بقية الماء تحتها، عن برودة الجو، فيبقى الماء سائلاً ويسمح باستمرار الحياة. والماء فوق الأرض ينظم حرارتها.
الخاصية الشعرية
يتميز الماء بالخاصية الشعرية التي لها أهميتها حيث ينتقل الماء والمواد المذابة فيه خلال فراغات المواد المسامية بفعل قوة الشد السطحي والتصاق وتماسك الماء. فلو وضعت ورقة تواليت (نشاف) في كوب ماء. فلإنها مسامية سوف تتبلل من أسفل لأعلي. وهذه الخاصية الشعرية نجدها في جذور النباتات حيث يمتص الماء من التربة مذابا فيه المواد المغذية، لينتقل بفعلها من اسفل لأعلي ضد الجاذبية ويظل يرؤتفع حتي تتغلب الجاذبية عليه وتوقف صعوده. ولنتصور هذا لو وضعنا أنبوبة شعرية زجاجية في كوب ماء سنجد أن مستوي الماء بها أعلي من مستوي الماء في الكوب. والشد السطحي للماءخاصية ثانية تمكن بعض الحشرات المائية بالسيرأو الانزلاق فوق سطحه والماء له خاصية شد سطحي أعلي من السوائل العادية ولايفوقه سوي الزئبق في هذه.
المياه المعدنية
مياه الينابيع الحارة المعدنية وقدرتها علي الشفاء كانت معروفة لدي الإغريق في معالجة الأمراض الجلدية حيث تستعمل في معالجة الكثير من الأمراض الجلدية كالصدفية والاكزيما وبعض أنواع الحساسية وامراض المفاصل والجهاز التنفسي والجهاز العصبي وامراض الكلي والكبد. والمياه المعدنية تركيبها الكيميائي ثابت عكس مياه العيون. وتحتوي علي نسبة عالية من المعادن المذابة بطريقة طبيعية وعلي كافة الايونات والعناصر الضرورية لادامة نمو وحماية الجسم. والمياه المعدنية تخرج من تحت سطح الأرض في شكل عيون مائية حارة (سخان) أو آبار لاستخراج المياه الجوفية. والمياه المعدنية لها طعم خاص حلو عذب أو مر أومالح خفيف.كما أن المياه المعدنية آمنة من البكتيريا ولا تحتاج الي اية معالجات كيميائية لتعقيمها.
فالآبار التي تقع مخازن المياه الجوفية فيها علي عمق (30 ــ 50 متراً تحت سطح الأرض) من نوع مياه الابار الصالحة للشرب. والآبار التي مخازن المياه الجوفية علي عمق (120 متراً فاكثر) تكون من نوع المياه المعدنية التي ترتبط بصخور الحجر الجيري والدولومايت لحقبة الميزوزوي والباليوزوي. وترتبط المياه المعدنية الحارة بالصخور النارية والبركانية في المناطق التي تمتاز بنشاط تكتوني علي امتداد الفوالق العميقة بالحدود الفاصلة بين تراكيب وبلوكات جيولوجية كبيرة، وعلي امتداد الاحزمة البركانية القديمة والحديثة. عكس مياه العيون التي ترتبط بالأنواع المختلفة من الصخور حيث تختلف الصفات الفيزيائية والكيميائية لها بين موقع واخر. كلما تغيرت نوعية الطبقات أوالترسبات الحاملة لها. كما تتغير كمية تدفق المياه فيها لاسيما في الفترات التي تتساقط فيها الأمطار والثلوج بكميات قليلة أو حين يقع الجفاف ويستمر لفترات قد تستغرق سنوات هذا كله يؤثر بشكل كبير علي مياه العيون. عكس المياه المعدنية التي بها الكالسيوم والماغنيسيوم والفلورايدات والنترات والحديد والبيكربونات والكلوريدات والسلفات (الكبريتات) والسليكات.
الماء في حياتنا
للماء أهمية حيوية لعيش الكائنات الحية بما فيها الإنسان. لأن له وظائف متعددة بالجسم. حيث الماء أهم مكونات الكائن الحي فنجد أن من 50 –90% من وزن الكائن الحي ماء. والبروتوبلازم هو المادة الأساسية في الخلايا الحية. وتتكون من محلول دهون وبروتينات وكربوهيدرات وأملاح ذائبة في ماء.والدم في الحيوانات والعصير في النباتات يتكونان من الماء ويعملان علي انتقال الغذاء والتخلص من النفايات. كما يلعب الماء دورا أساسيا في تكسير جزيئات الكربوهيدرات والبروتينات. وهذه العملية مستمرة في الخلايا الحية. والماء يساعد في خلط الطعام ومروره بسهولة من الفم إلى المعدة. كما يجعل الطعام المهضوم في الجهاز الهضمي مواداً مائعة قابلة للامتصاص. مع تقليل صلابة البراز وتليينه. ليساعد الجهاز الإخراجي في طرد السموم من الجسم على هيئة بول عن طريق الكليتين. كما يجعل انسجة الجسم مرنة ليمكنّها أداء وظيفتها. ويعوّض الجسم عما يفقده من ماء أثناء عملية التنفس والعرق والبول. والـدم يحتوي على 90% من وزنـه ماء، والماء يجله سائلا حيث يصل إلى جميع أجزاء الجسم حاملا له الغذاء والأكسجين. والبلازما التي تشكل 55% من الدم بالإنسان تتكون من 90% ماء. والإنسان يحتاج إلي 2-3 لنر ماء يوميا. ويمكن له أن يعيش شهرا بلا طعام لكنه لايعيش أكثر من إسبوع بدون ماء.
انظر أيضا
مصادر
- ^ "معلومات عن علم المياة على موقع thes.bncf.firenze.sbn.it". thes.bncf.firenze.sbn.it. مؤرشف من الأصل في 2019-12-10.
- ^ "معلومات عن علم المياه على موقع d-nb.info". d-nb.info. مؤرشف من الأصل في 2019-12-10.
- ^ "معلومات عن علم المياه على موقع jstor.org". jstor.org. مؤرشف من الأصل في 2019-05-28.
- كتاب «منظومة الحياة» لأحمد محمد عوف
| علم المياه في المشاريع الشقيقة: | |


