نترجة (كيمياء)
نترجة في الكيمياء وعلم الأحياء (بالإنجليزية: Nitrification) هي عملية أكسدة الأمونيا NH3وتحويلها إلى نترات (NO3−) عن طريق نوع من البكتيريا. وهذا التفاعل يتم على مرحلتين: في العملية الأولى يتأكسد الأمونيا إلى نتريت، ثم يتأكسد النتريت الناتج إلى نترات. وكلا العمليتان تمد البكتيريا القائمة بتلك العمليتين بالطاقة للنمو والقيام بوظائفها الحيوية الأخرى.
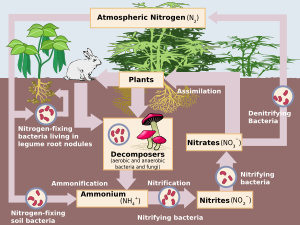
تلعب النترجة دورًا هامًا في دورة النتروجين في الطبيعة حيث أنها تحول الأمونيا الناتجة من موت الكائنات الحية إلى نترات. بذلك تحصل النباتات على غذائها من مواد تحتوي على النيتروجين والمعادن.
كان أول من بحث في موضوع النترجة الباحث «سرجيي فينوجرادسكي» وتبين له أن النترجة هي عملية مركزة تقوم بها العديد من أنواع البكتيريا. وقام بوصف تلك العمليات في منشوراته العلمية [1][2] عن النترجة وتفاعلاتها المتتابعة، كما استطاع تحديد أنواع البكتيريا المشتركة في تلك العمليات. فكان أول من حدد أنواع البكتيريا المشتركة، كما ابتكر السابقة «نتروزو» -Nitroso كتعبير يرتبط بنوع تلك الفصائل من البكتيريا التي وصف بها الجزء الأول من عملية النترجة. وأما الفصائل المشتركة في الجزء الثاني من العملية فأعطاها السابقة «نيترو» -Nitro في اسم البكتيريا.
الجزء الأول من التفاعل
يتكون التفاعل الأول من تأكسد الأمونيا بالأكسجين فينتج نتريت طبقا للمعادلة 1. في الظروف العادية لدرجة الحرارة والضغط، يطلق كل 1 مول من الأمونيا طاقة قدرها 235 kJ كيلو جول، طبقًا لمعادلة الطاقة الحرة
- ΔG°' = −235 kJ/mol.
- معادلة 1 :
في هذا التفاعل يتـأكسد الأمونيا إلى نتريت NO2−.
نوع البكتيريا التي تقوم بتلك العملية الأولى تسمى «بكتيريا تؤكسد الأمونيا» أو «نتريت بكتيريا». كل تلك الفصائل تجرى عملياتها في الهواء. ومن ضمنها أنواع البكتيريا التي تقوم بتلك العملية الأولى، تحمل في أول اسمها السابقة -Nitroso:
- نتروزوموناس Nitrosomonas
- نتروزوسبيرا Nitrosospira
- نتروزوفيبريو Nitrosovibrio
- نتروزولوبوس Nitrosolobus
- نتروزوكوكوس Nitrosococcus
ويتأكسد الأمونيوم بواسطة جزيئات الأكسجين على خطوتين. الخطوة الأولى (المعادلة 2) يتحول الأمونيا إلى هيدروكيلامين بواسطة إنزيم أمونيوم أوكسيجينيز (AMO). خلال هذا التفاعل يكتسب جزيء الهيدروكسيلامين أحد ذرات الأكسجين من جزيء الأكسجين، وتختزل ذرة الأكسجين الباقية في الماء. وفي الخطوة الثانية (المعادلة 3) يتأكسد الهيدروكسيلامين إلى نتريت. من تأكسد 4 مول من الهيدروكسيلامين واكتساب إلكترونات (معادلة 2) يستخدم منها 2 مول إلكترونات للتفاعل 1.
- معادلة 2:
في هذا التفاعل تتأكسد الأمونيا NH_3 إلى هيدروكيلامين NH2OH وماء H2O.
- معادلة 3:
- معادلة 4:
هذا التفاعل ينتج ماء.
الجزء الثاني من التفاعل
في الجزء الثاني من التفاعل يتأكسد النتريت بجزيء أكسجين منتجًا نترات. ينتج من هذا التفاعل طاقة قدرها 76 كيلو جول/مول تحت الظروف العادية لدرجة الحرارة والضغط، (تغير الطاقة الحرة ΔG°' مقداره −76 kJ/mol).
- المعادلة 5:
يحفز ذلك التفاعل بواسطة إنزيم نتريأكسيديز Nitritoxidase.
وتسمى البكتيريا التي تقوم بالجزء الثاني من التفاعل «بكتيريا تؤكسد النتريت» أو «بكتيريا نترات». كل أنواعها تلك الفصيلة ما عدا «نتروباكير» تتفاعل في الهواء. فصائل البكتيريا التي تنتج نترات يسبق اسمها سابقة -Nitro، وينتمي إليها:
- نتروباكتير Nitrobacter
- نتروسبيرا Nitrospira
- نتروسبينا Nitrospina
- نتروكوكوس Nitrococcus
التفاعل بالكامل
يؤدي جزئي التفاعل (معادلة 1 ومعادلة 5) إلى التفاعل الكلي:
- المعادلة 6:
تحت الظروف المعتادة لدرجة الحرارة (25 درجة مئوية) والضغط (1 ضغط جوي) ينتج من هذا التفاعل حرارة (طاقة) قدرها 311 kJ لكل مول أمونيا. (أي أن التغير في الطاقة الحرة ΔG°' يبلغ −311 كيلو جول/مول).
يوجد نوعان من البكتيريا بنفس الأعداد تقريبًا تحت الظروف العادية من بكتيريا تؤكسد الأمونيا وبكتيريا تؤكسد النتريت بحيث لا يتراكم النتريت في الطبيعة.
المراجع
- ^ S. Winogradsky: Recherches sur les organismes de la nitrification. In: Annales de l'Institut Pasteur Bd. 4, 1892, S. 213-231, 257-275 und 760-771.
- ^ S. Winogradsky: Contributions á la morphologie des organismes de la nitrification. In: Archives des sciences biologiques St. Petersburg Bd. 1, 1892, S. 88-137.