بيرمنغنات
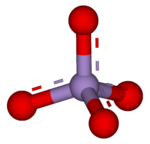
بيرمنغنات هو الاسم العام للمركب الكيميائي الذي يحتوي على أيون المنغنات (VII) (أو المنجنات) (MnO− 4).[1] لأن المنغنيز يتواجد في حالة الأكسدة 7+، يعتبر البرمنغنات (VII) عامل أكسدة (مؤكسِد) قوي. يمتلك هذا الأيون بنية جزئية رباعية السطوح. يكون محلول البرمنغنات أرجواني اللون وثابت أو قلوي قليلاً في الأس الهيدروجيني (PH).
| بيرمنغنات | |
|---|---|
| تسمية الاتحاد الدولي للكيمياء | |
Permanganate |
|
| الخواص | |
| صيغة كيميائية | MnO4 |
| كتلة مولية | 118.94 غ.مول−1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
التفاعل الكيميائي الدقيق يعتمد على الملوثات العضوية الموجودة والمؤكسدات المستخدمة في التفاعل. على سبيل المثال، يتم أكسدة الإثلين ثلاثي الكلور (C2H3Cl3) من قبل برمنغنات الصوديوم لينتج عنه ثنائي أكسيد الكربون (CO2)، ثنائي أكسيد المنغانيز (أو أكسيد المنغنيز الرباعي) (MnO2)، أيون الصوديوم (+Na)، أيون الكلوريد (-Cl)، وأخيراً، أيون الهيدرونيوم (+H).
في المحلول الحمضي (الأسيدي)، يصبح البرمنغنات عديم اللون وينخفض إلى حالة أيون المنغنيز (II) المؤكسدة +2.
8H+ + MnO− 4 + 5 e− → Mn2+ + 4 H2O
في المحلول القاعدي القوي، يصبح لونه أخضر وينخفض إلى حالة أيون المنغنيز المؤكسدة +6. ولكن في الوسط المحايد، يكون لونها بني وتنخفض إلى حالة أيون المنغنيز المؤكسدة +4.
انظر أيضاً
مراجع
- ^ "معلومات عن بيرمنغنات على موقع jstor.org". jstor.org. مؤرشف من الأصل في 2019-05-26.
| بيرمنغنات في المشاريع الشقيقة: | |