|
تضامنًا مع حق الشعب الفلسطيني |
سرطان بطانة الرحم
| سرطان الرحم | |
|---|---|
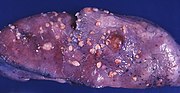
موقع ونمو سرطان الرحم.
| |
| معلومات عامة | |
| الاختصاص | علم الأورام، طب النساء |
| الأسباب | |
| عوامل الخطر | السمنة، التعرض المفرط لهرمون الإستروجين، ارتفاع ضغط الدم، السكري، تاريخ العائلة[1][2] |
| المظهر السريري | |
| البداية المعتادة | بعد سن اليأس[3] |
| الأعراض | نزيف المهبل، عسر التبول أو عسر الجماع، ألم حوضي[1] |
| الإدارة | |
| التشخيص | خزعة بطانة الرحم[1] |
| العلاج | استئصال الرحم بطريق البطن، العلاج الإشعاعي، العلاج الكيميائي، العلاج الهرموني |
| المآل | معدل البقاء على قيد الحياة لمدة خمس سنوات ~ 80% (الولايات المتحدة)[4] |
| الوبائيات | |
| انتشار المرض | 3.8 مليون (الإجمالي المتأثر في عام 2015)[5] |
| الوفيات | 89,900 (2015)[6] |
| تعديل مصدري - تعديل | |
سرطان بطانة الرحم (بالإنجليزية: Endometrial cancer) هو سرطان ينشأ من بطانة الرحم (الغشاء المبطن للرحم)[1]، يكون نتيجة للنمو غير الطبيعي للخلايا التي لديها القدرة على الغزو أو الانتشار إلى أجزاء أخرى من الجسم[7]، وتكون العلامة الأولية غالبًا نزيف مهبلي غير مرتبط بفترة الحيض[1]، كما يشمل أعراض أخرى مثل عسر التبول أو عسر الجماع أو ألم الحوض[1]، ويكون سرطان بطانة الرحم أكثر شيوعًا بعد انقطاع الطمث.[3]
تُعاني حوالي 40% من الحالات المرضية من البدانة[2]، ويرتبط سرطان بطانة الرحم أيضًا بالتعرض المفرط لهرمون الإستروجين وارتفاع ضغط الدم ومرض السكري[1]، وبالرغم من أن تناول الإستروجين بمفرده يزيد من خطر الإصابة بسرطان بطانة الرحم فإن تناول كل من الإستروجين والبروجستيرون معًا -كما هو الحال في معظم حبوب منع الحمل- يقلل من المخاطر[1][2]، ويرتبط ما بين 2- 5% من الحالات بالجينات الموروثة من الآباء[2]، وفي بعض الأحيان يُشار إلى سرطان بطانة الرحم على أنه «سرطان الرحم» على الرغم من أنه يختلف عن أشكال أخرى من سرطان الرحم مثل سرطان عنق الرحم والساركوما الرحمية ومرض ورم الأرومة الغاذية الحملي[8]، ويُعد النوع الأكثر شيوعًا من سرطان بطانة الرحم هو سرطانة شبيهة ببطانة الرحم والذي يمثل أكثر من 80% من الحالات[2]، يتم تشخيص سرطان بطانة الرحم عادة عن طريق خزعة بطانية رحمية أو عن طريق أخذ عينات خلال عملية تعرف باسم توسيع وكحت الرحم[1]، وتُعتبر لطاخة عنق الرحم ليست كافية عادة لإظهار سرطان بطانة الرحم[9]، لا يتطلب فحص منتظم للأشخاص المعرضين لدرجة طبيعية من خطر الإصابة بسرطان بطانة الرحم.[10]
يُعتبر الخيار العلاجي الرئيسي لسرطان بطانة الرحم هو استئصال الرحم عن طريق البطن (عملية جراحية لإزالة الرحم بشكل كلي) مع إزالة قناتي فالوب والمبيضين على كلا الجانبين، وتدعى هذه العملية استئصال البوق والمبيض على كلا الجانبين، وفي الحالات الأكثر تقدمًا يمكن أيضًا التوصية بالعلاج الإشعاعي أو العلاج الكيميائي أو العلاج الهرموني، وإذا تم تشخيص المرض في مرحلة مبكرة فإن النتيجة ستكون إيجابية حيث يصل معدل البقاء على قيد الحياة لخمس سنوات في الولايات المتحدة لأكثر من 80%.[4]
في عام 2012 أصيبت حوالي 320,000 امرأة بسرطانات بطانة الرحم حديثًا وتسببت بوفاة 76,000 امرأة[2]، ما جعل هذا المرض ثالث أكثر الأسباب شيوعًا للوفاة عن طريق السرطانات التي تؤثر فقط على النساء بعد سرطان المبيض وسرطان عنق الرحم[2]، وهو أكثر شيوعًا في الدول المتقدمة[2] ويُعَد أكثر أنواع السرطانات شيوعًا في الجهاز التناسلي الأنثوي في الدول المتقدمة، وقد ارتفعت معدلات سرطان بطانة الرحم في عدد من البلدان بين عامي 1980 و2010[2] ويعتقد أن هذا يرجع إلى زيادة أعداد كبار السن وزيادة معدلات السمنة.[11]
العلامات والأعراض
يحدث نزيف مهبلي أو تبقيع لدى النساء بعد سن اليأس في 90% من حالات سرطان بطانة الرحم[3][12][13]، ويعتبر النزيف شائعًا بشكل خاص مع السرطانة الغدية التي تحدث في ثلثي الحالات[3][10]، كما أنه قد تكون الدورة الشهرية غير الطبيعية أو الطويلة جدًا أو الغزيرة أو المتكررة قبل سن اليأس علامة على الإصابة بسرطان بطانة الرحم.[10]
ليس من الشائع حدوث أعراض أخرى غير النزيف، وتشمل الأعراض الأخرى إفرازات مهبلية بيضاء رقيقة أو صافية في النساء بعد سن اليأس، حيث يُظهر المرض الأكثر تقدمًا أعراضًا أو علامات أكثر وضوحًا يمكن اكتشافها في الفحص البدني، وقد يتضخم الرحم أو قد ينتشر السرطان مما يسبب ألمًا أسفل البطن أو تشنجًا في الحوض[10]، ويُعد كل من عسر الجماع وعسر التبول علامات أقل شيوعًا في حالات سرطان بطانة الرحم[8]، وقد يمتلئ الرحم أيضًا بالقيح (مما يُسبب بما يعرف بـ تقيح الرحم)[14]، تعاني حوالي 10-15% من النساء اللائي تظهر لديهن هذه الأعراض الأقل شيوعًا (الإفرازات المهبلية وألم الحوض والقيح) من السرطان.[15]
عوامل الخطر
تشمل عوامل الخطر لسرطان بطانة الرحم: السمنة وداء السكري وسرطان الثدي واستخدام عقار تاموكسيفين وعدم الإنجاب وسن اليأس المتأخر والمستويات العالية من الإستروجين والتقدم في السن.[14][15] وتبين دراسات الهجرة -التي تفحص التغيّر في خطر الإصابة بالسرطان بين السكان الذين ينتقلون بين بلدان ذات معدلات مختلفة من السرطان- أن هناك بعض العناصر البيئية تسبب سرطان بطانة الرحم[16] لكن عوامل الخطر البيئية هذه غير محددة بشكل جيد.[17]
الهرمونات
تتضمن معظم عوامل الخطر لسرطان بطانة الرحم مستويات عالية من هرمون الاستروجين، ويُعتقد أن 40% من الحالات مرتبطة بالبدانة[2]؛ فبسبب السمنة يزيد فائض الأنسجة الدهنية الذي بدوره يُزيد عملية تحويل الأندروستندويون إلى إسترون هو الإستروجين، وتؤدي المستويات العالية من الإسترون في الدم إلى نقصان أو انقطاع الإباضة مما يعرض بطانة الرحم لمستويات عالية باستمرار من هرمون الإستروجين.[18] كما تؤدي السمنة إلى ضعف التخلص من هرمون الاستروجين من الدم[18]، وترتبط متلازمة تكيس المبايض (PCOS) -التي تسبب أيضًا عدم انتظام أو عدم وجود إباضة- بزيادة معدلات سرطان بطانة الرحم للأسباب نفسها مثل السمنة. على وجه التحديد تُعتبر السمنة والسكري النوع الثاني ومقاومة الإنسولين عوامل خطر للنوع الأول من سرطان بطانة الرحم، حيث تُزيد السمنة من خطر الإصابة بسرطان بطانة الرحم بنسبة 300-400%.
يعتبر علاج الإعاضة بالإستروجين أثناء سن اليأس عندما يكون غير متوازن (أو «معاكس») لنشاط البروجستين عامل خطر آخر؛ حيث أن الجرعات العالية أو فترات العلاج الطويلة من الإستروجين تحمل مخاطر أكبر للإصابة بسرطان بطانة الرحم[18]، وتُعد النساء ذوات الوزن المنخفض أكثر عرضة لخطر زيادة الإستروجين غير المقاوم[2]، ومن عوامل الخطر أيضًا زيادة فترة الخصوبة وذلك إما بفعل بدء الإحاضة في وقت مبكر أو بسبب تأخر سن اليأس[19]، حيث يُزيد الإستروجين غير المقاوم من خطر الإصابة بسرطان بطانة الرحم بنسبة 2 إلى 10 أضعاف، وهذا يتوقف على الوزن وطول مدة العلاج[2]، وفي الرجال المتحولين جنسيًا (كانوا نساء سابقاً) الذين يأخذون التستوستيرون ولم يقوموا باستئصال الرحم فإن تحويل هرمون التستوستيرون إلى هرمون الإستروجين عبر الأندروستنديون قد يؤدي إلى ارتفاع خطر الإصابة بسرطان بطانة الرحم.[20]
الجينات

يمكن أن تُسبب الاضطرابات الوراثية أيضًا سرطان بطانة الرحم، وبشكٍل عام فإن الأسباب الوراثية تسهم في 2-10% من حالات سرطان بطانة الرحم[2][21]، وتسبب متلازمة لينش (السرطان الوراثي القولوني المستقيمي اللاسليلي) سرطان بطانة الرحم أيضًا وخاصة قبل سن اليأس وهذه المتلازمة عبارة عن اضطراب وراثي صبغي جسمي سائد يؤدي بشكل رئيسي إلى سرطان القولون والمستقيم، وتعاني النساء المصابات بمتلازمة لينش من 40–60% من خطر الإصابة بسرطان بطانة الرحم وهو أعلى من خطر الإصابة بسرطان القولون والمستقيم (الأمعاء الغليظة) أو سرطان المبيض. ينمو كلٌّ من سرطان المبيض وبطانة الرحم في وقت واحد في 20% من النساء، يحدث سرطان بطانة الرحم دائمًا قبل سرطان القولون قبل 11 عامًا في المتوسط[17]، يأتي التسرطن في متلازمة لينش من طفرة في الجينات MLH1 و/أو MLH2: الجينات التي تشارك في عملية إصلاح عدم التطابق، وتسمح للخلية بتصحيح الأخطاء في الحمض النووي. وتشمل الجينات الأخرى المتحورة في متلازمة لينش MSH2 وMSH6، وPMS2، والتي تعد أيضًا جينات لإصلاح عدم التطابق. تمثل النساء المصابات بمتلازمة لينش 2–3% من حالات سرطان بطانة الرحم، بينما ترفع بعض المصادر هذه النسبة لتصل إلى 5 %[17]، وبناءً على طفرة هذه الجينات فإن النساء المصابات بمتلازمة لينش لديهن مخاطر مختلفة لسرطان بطانة الرحم، فمع طفرات MLH1 تكون نسبة خطر الإصابة 54%، ومع MSH2 تكون النسبة 21%، بينما مع MSH6 تكون النسبة 16%.
تعتبر النساء اللواتي لديهن تاريخ عائلي لسرطان بطانة الرحم أكثر عرضة للخطر[8]، لا يتسبب جينا بروتين BRCA1 وBRCA2 -المرتبطان ببعض أكثر أنواع سرطانات النساء الأخرى شيوعًا- بسرطان بطانة الرحم، لكن هناك ارتباط واضح مع هذه الجينات ويُعزى ذلك إلى استخدام عقار تاموكسيفين في حالات سرطان الثدي والمبيض وهو دواء يمكن أن يتسبب بحدوث سرطان بطانة الرحم، يمكن لمتلازمة كاودن الوراثية أن تسبب سرطان بطانة الرحم؛ حيث تعاني النساء المصابات بهذا الاضطراب من 5 إلى 10% من خطر الإصابة بسرطان بطانة الرحم[2] مقارنة بنسبة 2 إلى 3% عند النساء غير المصابات.[17]
كما وُجِد أن التباين الوراثي الشائع يؤثر على معدل خطورة سرطان بطانة الرحم عن طريق دراسات ارتباط الجينوم على نطاق واسع[22][23]، حيث ارتبطت 16 منطقة جينومية بسرطان بطانة الرحم، كما فسرت المتفاوتات الشائعة نسبة تصل إلى 7% من المخاطر المتعلقة بالعائلة.[23]
اضطرابات صحية أخرى
تزيد بعض العلاجات لأشكال أخرى من السرطان من خطر الإصابة بسرطان بطانة الرحم مدى الحياة، حيث يكون خطر الإصابة في الأساس 2-3 %[17]، وقد ارتبط التاموكسيفين -دواء يستخدم لعلاج سرطان الثدي الإيجابي للإستروجين- بسرطان بطانة الرحم في حوالي 0.1% من المستخدمات للعقار خاصة النساء المسنات، ولكن تفوق فوائد التاموكسيفين والنجاة من الإصابة بسببه خطر الإصابة بسرطان بطانة الرحم[24]، وقد وُجِد أن دورة استخدام مدتها عام إلى عامين لعقار التاموكسيفين تضاعف خطر الإصابة بسرطان بطانة الرحم تقريبًا، ودورة استخدام مدتها خمس سنوات تضاعف خطر الأصابة أربع مرات[19]، بينما لم يرفع الرالوكسيفين -دواء مشابه- من خطر الإصابة بسرطان بطانة الرحم، وقد كانت الإصابة بسرطان المبيض في السابق عامل خطر لسرطان بطانة الرحم[25] وكذلك العلاج الإشعاعي السابق لمنطقة الحوض، وعلى وجه التحديد ترتبط أورام الخلية الحبيبية في المبيض والورم القرابي بسرطان بطانة الرحم.
وقد لوحظ أيضًا نقص المناعة في سرطان بطانة الرحم[14]، ويعد ارتفاع ضغط الدم عامل خطر أيضًا ولكن قد يكون هذا بسبب ارتباطه بالبدانة، ويرتبط الجلوس بانتظام لفترات طويلة بارتفاع معدل الوفيات بسبب سرطان بطانة الرحم، بينما ممارسة التمارين الرياضية لا تُزيل خطر الإصابة بسرطان بطانة الرحم لكنها تقلل منه.[26]
عوامل الحماية
يُعد كل من التدخين واستخدام البروجستين عاملين وقائيين ضد سرطان بطانة الرحم؛ حيث يوفر التدخين الحماية عن طريق تغيير التمثيل الغذائي للاستروجين وتعزيز فقدان الوزن وانقطاع الطمث المبكر، ويستمر هذا التأثير الوقائي لفترة طويلة حتى بعد توقف التدخين، بينما يتواجد البروجستين في حبوب منع الحمل المركبة واللولب الرحمي الهرموني[27]، فتعمل حبوب منع الحمل المركبة على تقليل المخاطر كلما طال استخدامها: حيث تقلل المخاطر بنسبة 56% بعد أربع سنوات، وبنسبة 67% بعد ثماني سنوات، وبنسبة 72% بعد اثني عشر عامًا، ويستمر هذا الحد من المخاطر لمدة خمسة عشر عامًا على الأقل بعد إيقاف استخدام موانع الحمل، وقد تحتاج النساء البدينات إلى جرعات أعلى من البروجستين لحمايتهن، ويُعتبر إنجاب أكثر من خمسة رضع هو أيضًا عامل وقائي[14]، كما أن إنجاب طفل واحد على الأقل يقلل من الخطر بنسبة 35%، وتؤدي الرضاعة الطبيعية لأكثر من 18 شهرًا إلى تقليل المخاطر بنسبة 23%، بالإضافة إلى أن زيادة النشاط البدني يقلل من مخاطر إصابة المرأة بنسبة 38-46%، وهناك أدلة أولية على أن تناول الصويا يُعد عاملًا وقائيًا.[28]
الفيزيولوجيا المرضية
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
يتكون سرطان بطانة الرحم عند وجود أخطاء في نمو خلايا بطانة الرحم الطبيعية، وعادة عندما تنمو الخلايا وتكبر أو تتضرر فإنها تموت وتأخذ مكانها خلايا جديدة، يبدأ السرطان عندما تتشكل خلايا جديدة لا حاجة لها بالإضافة إلى عدم موت الخلايا القديمة أو التالفة كما ينبغي، وغالبًا ما يشكل تراكم الخلايا الإضافية كتلة من النسيج تسمى الورم، ويكون لدى هذه الخلايا السرطانية غير الطبيعية العديد من التشوهات الجينية التي تؤدي إلى نموها بشكل مفرط.[8]
في 10-20% من سرطانات بطانة الرحم -ومعظمهم من الدرجة الثالثة (أعلى تصنيف نسيجي)- توجد الطفرات في الجينات الكابتة للورم، وعادة تكون جينات بي53 أو PTEN، وفي 20% من حالات فرط تنسج بطانة الرحم و50% من السرطانات الشبيهة ببطانة الرحم يعاني جين PTEN من طفرة فقدان الوظيفة أو من طفرة لاغية، مما يجعله أقل فعالية أو غير فعال تمامًا، تؤدي خسارة وظيفة PTEN إلى زيادة تنظيم مسار PI3k / Akt / mTOR مما يؤدي إلى نمو الخلايا، كما يمكنه إما أن ينشِّط مسار بي53 نشاطًا زائدًا أو يثبطه في سرطان بطانة الرحم، ولكن عندما يتواجد جين بي53 المتحور بشكلٍ مفرط فإن السرطان يميل إلى أن يكون عدواني بشكل خاص، ترتبط طفرات بي53 وعدم استقرار الكروموسومات بالسرطانات المصلية التي تميل أن تشبه سرطان المبيض وقناة فالوب، كما يُعتقد أن السرطانات المصلية تتطور من ورم غدي داخل ظهارة البطانة الرحمية. ترتبط طفرات فقدان وظيفة PTEN وp27 بمآلٍ جيد خاصة عند النساء البدينات، حيث يظهر الجين الورمي Her2/neu -الذي يشير إلى سوء مآل الورم- في 20% فقط من السرطانات الشبيهة ببطانة الرحم والسرطانات المصلية، وقد عُثر على طفرات CTNNB1 (بيتا-كاتينين، جين النسخ) في 14-44% من سرطانات بطانة الرحم وقد تشير إلى مآل جيد ولكن البيانات غير واضحة في هذا الخصوص، توجد طفرات بيتا كاتنين بشكل شائع في سرطانات بطانة الرحم مع خلايا حرشفية، كما عٌثر على طفرات جين FGFR2 في حوالي 10% من سرطانات بطانة الرحم ولكن مآلهم غير واضح[29]، وقد وُجد أن جين SPOP -جين آخر كابح للأورام- يتحور في بعض حالات سرطان بطانة الرحم: حيث ثَبُت أن 9% من سرطانات بطانة الرحم ذات الخلايا الصافية و8% من سرطانات بطانة الرحم المصلية لها طفرات في هذا الجين.[30]
تميل سرطانات النوع الأول والثاني (الموضحة أدناه) إلى حدوث طفرات مختلفة، فيحمل جين ARID1A في الغالب طفرة نقطية في سرطان بطانة الرحم من النوع الأول، ويتحور أيضًا في 26% من سرطانات بطانة الرحم ذات الخلايا الصافية و18% من السرطانات المصلية، وفي الغالب يوجد إسكات الجين والطفرات النقطية للعديد من الجينات في سرطان بطانة الرحم النوع الأول[2]، بينما تكون الطفرات في الجينات الكابتة للورم شائعة في سرطان بطانة الرحم من النوع الثاني[2]، أما جين PIK3CA فإنه يتحور عادة في كل من النوع الأول والنوع الثاني، وفي النساء المصابات بسرطان بطانة الرحم المصاحب لمتلازمة لينش يكون اضطراب التكرارات المترادفة القصيرة شائعًا.
يعتبر حدوث فرط تنسج بطانة الرحم (فرط نمو خلايا بطانة الرحم) عامل خطر مهم لأن فرط التنسج يمكن أن يتطور في الغالب إلى سرطانة غدية على الرغم من أن السرطان يمكن أن يتطور دون حدوث فرط التنسج[18]، ففي غضون عشر سنوات تتطور 8% إلى 30% من حالات تضخم بطانة الرحم اللانمطية إلى سرطان، في حين أن 1-3% من حالات فرط التنسج النمطية يحدث لها ذلك[31]، ويتميز التضخم اللانمطى بحدوث تشوهات واضحة في نوى الخلايا، كما يُشار أيضًا إلى فرط تنسج بطانة الرحم محتمل التسرطن باسم ورم داخل ظهارة البطانة الرحمية[32]، يمكن للطفرات في جين كيراس أن تسبب فرط تنسج بطانة الرحم وبالتالي سرطان بطانة الرحم من النوع الأول، ويحدث فرط تنسج بطانة الرحم عادة بعد سن الأربعين[8]، كما يحدث خلل التنسج الغشائي البطاني مع زيادة مفرطة في بي53 ويتطور إلى سرطان مصلي.[14]
التشخيص
يتم تشخيص سرطان بطانة الرحم أولًا عن طريق الفحص البدني أو خزعة بطانية رحمية أو توسيع وكحت الرحم (إزالة أنسجة بطانة الرحم: D & C)، ثم يُفحص هذا النسيج تشريحيًا لاكتشاف خصائص السرطان، وإذا تم العثور على السرطان فإنه يمكن إجراء التصوير الطبي لمعرفة ما إذا كان السرطان قد انتشر أو غزا الأنسجة.[33]
الفحص


لا يوصَى بالتنظير الشعاعي الروتيني للنساء اللاتي لا يعانين من الأعراض لأنه يمكن علاج المرض في مراحل أعراضه الأولية، وبدلًا من ذلك فإن النساء -خاصة من وصلت إلى سن اليأس منهن- يجب أن تكون على دراية بأعراض وعوامل خطورة سرطان بطانة الرحم، ويُعد اختبار التنظير الشعاعي لعنق الرحم (مثل لطاخة بابانيكولاو) طريقة غير مفيدة لتشخيص المرض لأن اللطاخة تكون عادية 50% من الوقت[10]، بينما يتم استخدام لطاخة بابانيكولاو لاكتشاف المرض الذي انتشر بالفعل إلى عنق الرحم[8]، وتكون نتائج فحص الحوض عادية باستمرار خاصة في المراحل الأولية من المرض، كما يحدث تغيرات في حجم أو شكل أو اتساق الرحم أو الأجزاء المجاورة والداعمة له عندما يكون المرض في مراحله المتطورة[10]، وقد وُجِد أن ضيق عنق الرحم يُعد إشارة إلى وجود سرطان بطانة الرحم عند تجمُّع قيح أو دم داخل الرحم مما يؤدي إلى ما يعرف ب تقيح الرحم أو تدمي الرحم.[12]
من الضروري أن تبدأ النساء المصابات بمتلازمة لينش الحصول على تنظير شعاعي خزعي سنويًا بدايةً من عمر 35، لكن تختار بعض السيدات القيام باستئصال الرحم والمبيض وقناة فالوب لتقليل احتمالية الإصابة بسرطان بطانة الرحم أو سرطان المبيض.[10]
ازداد استخدام الموجات فوق الصوتية عبر المهبل لفحص سمك بطانة الرحم في النساء اللاتي يعانين من نزيف بعد فترة اليأس في الولايت المتحدة مما يساعد على تشخيص سرطان بطانة الرحم[34]، بينما في المملكة المتحدة يتم استخدام كل من الخزعة البطانية الرحمية والموجات فوق الصوتية عبر المهبل بالاقتران مما يُشكِّل مستوى الرعاية لتشخيص سرطان بطانة الرحم[14]، ويُمكن أن يساعد تجانس الأنسجة المرئية في الموجات فوق الصوتية عبر المهبل في تحديد ما إذا كان سمك بطانة الرحم سرطانيًا، وتكون نتائج الموجات فوق الصوتية وحدها غير حاسمة في حالات سرطان بطانة الرحم؛ لذلك يتم استخدام وسيلة أخرى مثل الخزعة البطانية الرحمية بالاقتران معها، بينما تكون دراسات التصوير الأخرى ذات استخدام محدود، فتُستخدم الآشعة المقطعية في التصوير قبل العمليات الجراحية للأورام التي تظهر بصورة متقدمة في الاختبارات البدنية أو لديها أنواع فرعية عالية الخطورة (معدل مرتفع من الانبثاث)[35]، كما يمكن استخدام الآشعة المقطعية أيضًا في فحص الأمراض التي تقع خارج الحوض[14]، ويُستخدم التصوير بالرنين المغناطيسي في تحديد إذا ما انتشر السرطان إلى عنق الرحم أو إذا كان عبارة عن سرطانة غدية داخل عنق الرحم، أيضًا يتم استخدام التصوير بالرنين المغناطيسي لفحص العقد الليمفاوية المُجاورة.[14]
يتم استخدام كل من توسيع وتجريف الرحم أو الخزعة البطانية الرحمية للحصول على عينة نسيج للفحص الهستولوجي، وتُعد الخزعة البطانية الرحمية هي أقل الوسائل تغلغلًا في الجسم لكنها قد لا تعطي نتائج حاسمة كل مرة، يُظهر تنظير الرحم التشريح العياني لبطانة الرحم فقط والذي لا يكشف عن السرطان غالبًا ولذلك لا يتم استخدامه إذا لم يقترن بالخزعة البطانية الرحمية، لكن يمكن استخدامه في تأكيد تشخيص السرطان، وقد أشارت أدلة جديدة أن توسيع وتجريف الرحم لديه معدل سلبي خاطئ أكثر من الخزعة البطانية الرحمية.
قبل بداية العلاج تتم التوصية بالعديد من الفحوصات الأخرى والتي تشمل: آشعة سينية على الصدر واختبارات وظائف الكبد واختبارات وظائف الكلى واختبار مستويات الواصم الورمي CA-125 الذي تزداد نسبته في حالة الإصابة بسرطان بطانة الرحم.[8]
التصنيف
ربما تكون سرطانات بطانة الرحم مُشتقة من الخلايا الظهارية (وتُعرف ب «السرطانات»)، أو مُشتقة من أورام خلايا ظهارية وجذعية لحمية متوسطة مختلطة (تُعرف ب «ساركوما سرطانية»)، أو مُشتقة من أورام خلايا جذعية لحمية متوسطة.[36]
يُعد التصنيف التقليدي لسرطانات بطانة الرحم قائمًا على:
- إما المظاهر السريرية ومظاهر الغدد الصماء (كالنوع الأول والثاني)
- أو على صفات علم أمراض الأنسجة (كالخلية الصافية أو الشبيهة ببطانة الرحم أو المصلية)
بعض الأورام تكون صعبة التصنيف أو لديها صفات تتداخل مع أكثر من نوع، فمثلًا يكون للأورام الشبيهة ببطانة الرحم ذات الدرجة العالية صفات كل من النوع الأول والثاني.[36]
سرطانة
الغالبية العُظمى من حالات سرطان بطانة الرحم تكون عبارة عن سرطانة (وفي الغالب تكون سرطانة غدية)، مما يعني أنها تنشأ من الطبقة المفردة من الخلايا الظهارية التي تبطن بطانة الرحم وتُكَوِّن غددها، ويوجد العديد من الأنواع الفرعية المجهرية لسرطانة بطانة الرحم، تُقسَّم هذه الأنواع إلى نوعين رئيسيين هما: النوع الأول والنوع الثاني، ويعتمد التقسيم على المظاهر السريرية ومنشأ المرض، كما يتميز كل من النوعين عن الآخر.[10]
- النوع الأول من سرطانة بطانة الرحم يحدث في أغلب الأحيان قبل أو تقريبًا في توقيت انقطاع الطمث، وفي الولايات المتحدة يكون النوع الأول أكثر شيوعًا عند النساء البيضاوات خاصةً من لديهن تاريخ سابق بفرط تنسج بطانة الرحم، ويكون النوع الأول من سرطانات بطانة الرحم غالبًا منخفض الدرجة ويغزو أجزاء ضئيلة جدًا من عضل الرحم، ومرتبطًًا بالتعرض للإستروجين بالإضافة إلى أنه يتحسن بدرجة جيدة مع العلاج[10]، ويُشكِّل النوع الأول من السرطانات 75-90% من حالات سرطان بطانة الرحم.[14]
- بينما يحدث النوع الثاني من السرطانات غالبًا في النساء الأكبر سنًا بعد انقطاع فترة الطمث، وفي الولايات المتحدة يكون أكثر شيوعًا في السيدات السمراوات، ولا يرتبط بالتعرض الزائد للإستروجين أو التاريخ المرضي لفرط تنسج بطانة الرحم، ويكون النوع الثاني في أغلب الأحيان ذا درجة مرتفعة حيث يقوم بغزو أجزاء عميقة من عضل الرحم من نوع الخلايا الصافية أو المصلية، كما أنه يحمل تشخيصًاأكثر فقرًا، فعند تقييم الأعراض يمكن أن يظهر في البداية سرطان المبيض الظهاري[10][37]، وبعد ذلك يتطور ليصبح النوع الأول من الأورام وأكثر عدوانية مع العديد من مخاطر النكس والانبثاث.[14]
سرطانة غدية شبيهة ببطانة الرحم
في السرطانات الغدية الشبيهة ببطانة الرحم تنمو الخلايا السرطانية في أنماط تُشبه بطانة الرحم الطبيعية، ويصاحبها وجود الكثير من الغدد الجديدة المتكونة من خلايا الظهارة العمادية مع بعض الأنوية غير الطبيعية، ويكون للسرطانات الغدية الشبيهة ببطانة الرحم ذات الدرجة المنخفضة خلايا متمايزة جيدًا لا تغزو عضل الرحم وتُرى بجانب فرط تنسج بطانة الرحم، وتتكون غدد الأورام بالقرب من بعضها البعض بدون الأنسجة (اللحمية) التي تفصلها عادةً، بينما يكون للسرطانات الغدية الشبيهة ببطانة الرحم ذات الدرجة الأعلى خلايا أقل تمايزًا وأوراق أكثر صلابة من الخلايا السرطانية التي لا تنتظم في غدد، كما أنها تكون مرتبطة بضمور بطانة الرحم، ويوجد العديد من الأنواع الفرعية للسرطانات الغدية الشبيهة ببطانة الرحم تحمل نفس المآل، وتشمل متغيرات الخلايا المهدبة والمفرزة والغدية الخملية، ويوجد أيضًا نوع فرعي يتَّصف بتمايز حرشفي، وبعض السرطانات الغدية الشبيهة ببطانة الرحم تحمل بؤرًا من السرطانة المخاطية.[38]
تحدث الطفرات الجينية الأكثر شيوعًا المرتبطة بالسرطانة الغدية الشبيهة ببطانة الرحم في جينات PTEN المثبط للورم وPIK3CA وهو كيناز وأيضًا جينات KRAS وهو عبارة عن جي تي بيز يقوم بتوصيل الإشارة وكذلك جينات CTNNB1 التي تشارك في تلاصق واستشعار الخلية، ويُعد جين CTNNB1 (بيتا كاتنين) هو الجين الأكثر شيوعًا للتعرض للطفرات في النوع الفرعي الحرشفي من السرطانة الغدية لبطانة الرحم.[39]
سرطانة مصلية
تُعد السرطانة المصلية ورمًا بطانيًا رحميًا من النوع الثاني حيث يُشكِّل 5-10% من حالات سرطان بطانة الرحم المُشَخصة، وهو شائعًا بعد انقطاع الطمث لدى السيدات اللاتي تُعانين من ضمور بطانة الرحم، وأيضًا هو شائع لدى السيدات السوداوات، ويكون مرض سرطانة بطانة الرحم المصلية عدوانيًا ويغزو غالبًا عضل الرحم ثم ينتقل خلال الصفاق (حيثُ يظهر على هيئة كعكة ثربية) أو الجهاز الليمفاوي، وفيما يخُص علم الأنسجة فإن هذا المرض يظهر معه أنوية لانموذجية وتراكيب حليمية، وعلى عكس السرطانات الغدية الشبيهة ببطانة الرحم التي يظهر فيها خلايا عمودية فإنه يظهر في سرطانة بطانة الرحم المصلية خلايا مستديرة، حوالي 30% من حالات سرطانة بطانة الرحم المصلية تمتلك أجسامًا رملية[18]، وتنتشر السرطانات المصلية بصورة مُختلفة عن أغلب أنواع سرطانات بطانة الرحم الأخرى؛ حيثُ يمكنها الانتشار خارج الرحم بدون غزو عضل الرحم.[18] وتمتاز الطفرات الجينية التي تُرى في حالات السرطانات المصلية بعدم الاستقرار الصبغي، وتحدث في الجين المثبط للورم TP53.[39]
سرطانة الخلية الصافية
تُعد سرطانة الخلايا الصافية ورمًا بطانيًا رحميًا من النوع الثاني، وهي تُشَكل أقل من 5% من حالات سرطانة بطانة الرحم المُشخصة، وكمثل سرطانة الخلايا المصلية فإن سرطانة الخلايا الصافية أيضًا تكون عدوانية وتحمل مآلًا سيئًا، وبالنسبة لعلم الأنسجة فهي تميزها صفات شائعة في كل الخلايا الصافية: حيث يكون السيتوبلازم واضحًا مسماويًا عند صبغه بصبغة H&E، وتكون أغشية الخلايا متميزة ومرئية، كما يكون نظام إشارة خلية p53 غير نشطًا في سرطانة الخلايا الصافية لبطانة الرحم[14]، ويكون هذا الشكل من السرطانات أكثر شيوعًا في النساء اللاتي تعانين من انقطاع الطمث.[18]
سرطانة مخاطية
تُعد السرطانة المخاطية شكلًا نادرًا لسرطان بطانة الرحم؛ حيث تشكِّل أقل من 1-2% من حالات سرطانة بطانة الرحم المشخصة، وتكون السرطانة المخاطية في أغلب الأحيان مرحلة أولي ودرجة أولى مما يسمح لها بتحسن جيد، وهي تمتلك خلايا عمودية متمايزة جيدًا ومنظمة على شكل غدد، بالإضافة إلى وجود الموسين المميز في السيتوبلازم، ويجب التمييز بين السرطانة المخاطية والسرطانة الغدية العنقية.
سرطانة مختلطة أو لامتمايزة
السرطانات المختلطة هي تلك التي تمتلك خلايا من النوع الأول وأخرى من النوع الثاني، وهي تشكل على الأقل 10% من الورم، وتشمل ورم مولر المختلط الخبيث الذي ينشأ من ظهارة بطانة الرحم وله مآل سيئ.[40] وتشكل سرطانات بطانة الرحم اللامتمايزة أقل من 1-2% من حالات سرطان بطانة الرحم المشخصة، ويكون لها مآل أسوأ من مآل أورام الدرجة الثالثة، وبالنسبة لعلم الأنسجة فإن هذه الأورام تُظهر ملاءات من الخلايا الظهارية المتطابقة التي لا يمكن تمييزها عن بعضها.
سرطانات أخرى
تعد كل من سرطانة الخلايا الحرشفية اللانتقالية وسرطانة الخلايا الانتقالية أنواع نادرة الحدوث في بطانة الرحم، ويكون لسرطانة الخلايا الحرشفية في بطانة الرحم مآلًا سيئًا، وقد تم الإبلاغ عن هذا المرض أقل من مائة مرة في المستندات الطبية منذ وصفه عام 1892، ولكي يتم تشخيص سرطانة الخلايا الحرشفية الأولية في بطانة الرحم (والتي يُرمز لها ب PSCCE) فإنه يجب ألا يكون هناك سرطان أولي آخر في بطانة الرحم أو في عنق الرحم ويجب ألا يرتبط المرض بالخلايا الظهارية لعنق الرحم، وبسبب نُدرة حدوث هذا النوع من السرطانات فإنه لا يوجد حتى الآن دلائل إرشادية لكيفية علاجه ولا يوجد علاج مثالي، وتظل الأسباب الوراثية الشائعة غير مميزة[41]، كما تُعد سرطانة الخلايا الانتقالية الأولية أكثر نُدرة؛ فقد تم الإبلاغ عن 16 حالة فقط منذ عام 2008، ولذلك لم يتم تمييز الفيزيولوجيا المرضية أو العلاج الخاصِّين بالمرض[42]، وبالنسبة لعلم الأنسجة فإن سرطانة الخلايا الانتقالية التي تحدث في الرحم تُشبه السرطانات الشبيهة ببطانة الرحم ويتم تمييزها عن سرطانات الخلايا الانتقالية الأخرى.[43]
ساركومة

على عكس سرطانات بطانة الرحم فإن الساركومة البطانية السدوية الرحمية هي عبارة عن سرطانات تنشأ من النسيج الضام اللاغدي لبطانة الرحم، وتكون غالبًا غير عدوانية وإذا تكرر حدوثها يمكنها أن تستمر لعقود، كما تُحدث انبثاثات للرئتين والحوض والتجاويف الصفاقية بصورة أكثر تكرارًا[18]، وتكون لتلك السرطانات مستقبلات للإستروجين والبروجستيرون[44]، ولساركومة بطانة الرحم السدوية ذات الدرجة المنخفضة مآل جيد حيث تصل نسبة البقاء على قيد الحياة لمدة خمس سنوات 60-90%، بينما يكون للدرجة المتقدمة من المرض مآلًا سيئًا حيث تزداد معدلات تكرار الحدوث وتصل نسبة البقاء لمدة خمس سنوات فقط 25%[45]، ويتحدد مآل الدرجة المتقدمة إذا كان السرطان قد اخترق الشرايين والأوردة أم لا، فبدون غزو المرض للأوعية الدموية تصل نسبة البقاء لخمس سنوات إلى 83% بينما تقل هذه النسبة إلى 17% في حالات غزو الأوعية الدموية، ويكون للمرحلة الأولى من الساركومة البطانية السدوية الرحمية أفضل مآل فتصل نسبة البقاء على قيد الحياة لمدة خمس سنوات إلى 98% ونسبة البقاء لعشر سنوات إلى 89%، وهي تمثل 0.2% من سرطانات الرحم.[46]
الانبثاث
ينتقل سرطان بطانة الرحم بصورة متكررة إلى المبيضين وقناتي فالوب وذلك عندما يكون السرطان في الجزء العلوي من الرحم، بينما ينتقل إلى عنق الرحم عندما يكون في الجزء السفلى من الرحم، وينشر السرطان بدايةً في عضل الرحم والأغشية المصلية، ثم بعد ذلك ينتشر إلى تراكيب الحوض والأعضاء التناسلية الأخرى، وعندما يصل الانتشار إلى الجهاز اللمفي فإن أول ما يتأثر تكون العقد اللمفاوية الحوضية والمجاورة للأورطى لكن بدون نمط محدد على عكس سرطان عنق الرحم، وتنتشر الانبثاثات الأكثر بعدًا عن طريق الدم وغالبًا تؤثر على الرئتين والكبد والدماغ والعظام[47]، وينتشر سرطان بطانة الرحم إلى الرئتين في 20-25% من الحالات أي أكثر من أي سرطان نسائي آخر.[48]
علم أمراض الأنسجة
يوجد نظام ثلاثي المستويات لتقسيم سرطانات بطانة الرحم تبعًا لعلم الأنسجة، حيث تتراوح السرطانات من:
- سرطانات بخلايا جيدة التمايز (الدرجة الأولى)
- سرطانات بخلايا فقيرة التمايز للغاية (الدرجة الثالثة)[19]
وتُعد سرطانات الدرجة الأولى هي سرطانات أقل عدوانية ولها أفضل مآل، بينما سرطانات الدرجة الثالثة هي الأكثر عدوانيةً ومن المحتمل تكرار حدوثها، أما سرطانات الدرجة الثانية فهي وسطية بين الدرجة الأولى والدرجة الثالثة من ناحية تمايز الخلايا ودرجة عدوانية المرض.[49]
علم أمراض الأنسجة لسرطانات بطانة الرحم يكون متنوعًا كثيرًا، ولكن الحالات الأكثر شيوعًا هي السرطانة الغدية الشبيهة ببطانة الرحم المتمايزة جيدًا[40]، والتي تتكون من غدد عديدة صغيرة ومزدحمة بدرجات مختلفة من اللانمطية النووية والنشاط الميتوزي والتطبُّق، وذلك يظهر غالبًا في خلفية فرط تنسج بطانة الرحم، يُمكن تمييز السرطانة الغدية الصريحة عن فرط التنسج اللانمطي عن طريق اكتشاف غزو سدوي صافٍ أو غدد «باك تو باك» التي تمثل استبدال غير مدمر لسدى بطانة الرحم عن طريق السرطان، ومع تطور المرض يرتشح عضل الرحم.[50]
تصنيف المراحل
يتم تصنيف مراحل سرطانة بطانة الرحم جراحيًا بواسطة نظام تصنيف السرطان الذي وضعه الاتحاد الدولي لطب النساء والتوليد عام 2009 ويكون كما يلي:[51]
| المرحلة | الوصف |
|---|---|
| المرحلة الأولى (أ) | يقتصر الورم على الرحم مع غزو أقل من نصف عضل الرحم |
| المرحلة الأولى (ب) | يقتصر الورم على الرحم مع غزو أكثر من نصف عضل الرحم |
| المرحلة الثانية | يشمل الورم الرحم ولحمة عنق الرحم |
| المرحلة الثالثة (أ) | يغزو الورم الأغشية المصلية وملحقات الرحم |
| المرحلة الثالثة (ب) | يشمل الورم المهبل وجنيب الرحم |
| المرجلة الثالثة (ج1) | يشمل الورم العقد اللمفية بالحوض |
| المرجلة الثالثة (ج2) | يشمل الورم العقد اللمفية المجاورة للأورطى مع أو بدون عقد الحوض |
| المرحلة الرابعة (أ) | يغزو الرحم الغشاء المخاطي للمثانة البولية والأمعاء |
| المرحلة الرابعة (ب) | انبثاثات بعيدة تشمل البطن والعقد الليمفاوية الإربية |
أكثر أنماط الانتشار التي تظهر تشمل غزو عضل الرحم والحوض والعقد اللمفية المجاورة للأورطى[3]، في بعض الأحيان قد يشتمل السرطان على مرحلة 0 والتي تشير إلى «سرطانة لابدة»[8]، في 26% من السرطانات محتملة المرحلة المبكرة يكشف تصنيف المراحل أثناء العملية عن انبثاثات بعيدة وانبثاثات تصل إلى الحوض مما يجعل من الضروري إجراء عملية جراحية شاملة.
-
المرحلة الأولى (أ) و(ب) لسرطان بطانة الرحم
-
المرحلة الثانية لسرطان بطانة الرحم
-
المرحلة الثالثة لسرطان بطانة الرحم
-
المرحلة الرابعة لسرطان بطانة الرحم
إدارة المرض
الجراحة

إن العلاج المبدئي لسرطان بطانة الرحم هو الجراحة، 90% من السيدات المصابات بالمرض يتم علاجهن ببعض أشكال الجراحة[19]، ويتكون العلاج الجراحي بالتحديد من استئصال الرحم والذي يتضمن اسئتصال كل من المبيض والبوق على كلا الجانبين، ويتم استئصال العقد الليمفاوية المجاورة للأورطى أو العقد الليمفاوية بالحوض في حالة أورام الدرجة الثانية أو المتقدمة عن ذلك[15]، لكن في الولايات المتحدة يتم إجراء استئصال العقد اللمفاوية لسرطان بطانة الرحم بجميع الدرجات، بينما في المملكة المتحدة يتم الاستئصال للدرجة الثانية للمرض وما فوقها[14]، أما بالنسبة لفائدة استئصال العقد المفية في حالات أورام الدرجة الأولى فما زالت مختلف عليها حتى الآن، وفي حالات الدرجة الثالثة والرابعة تكون جراحة الاختزال الخلوي مثالية[15] وقد تشمل أيضًا خزعة الثرب، وفي المرحلة الرابعة يتواجد انبثاثات لأماكن بعيدة ويمكن استخدام الجراحة أيضًا كعلاج ملطف، ويُعد الاستكشاف البطني هو الإجراء الجراحي التقليدي ومع ذلك فإن التنظير البطني (جراحة ثُقب المفتاح) يكون مرتبطًا بالمراضة الأقل قابليةً للجراحة، لا يوجد اختلاف بين كلا الإجرائيين في البقاء[52]، ويُنصح باستئصال الرحم عبر البطن أكثر من استئصاله عبر المهبل لأنه عبر البطن يسمح بفحص وغسيل التجويف البطني لاكتشاف أي دليل آخر لوجود السرطان، حيث يتم تصنيف مرحلة السرطان أثناء الجراحة.[53]
تشمل موانع إجراء الجراحة وجود ورم عصيّ الجراحة أو السمنة الزائدة أو عملية ذات خطورة كبيرة نسبيًا أو الرغبة في الحفاظ على الخصوبة، موانع الاستعمال هذه تتواجد في حوالي 5-10% من الحالات، السيدات اللاتي يرغبن في الحفاظ على خصوبتهن ويعانون من سرطان مرحلة أولى بدرجة منخفضة يمكن أن يتم علاجهن باستخدام البروجستين مع أو بدون تيموكسيفين متزاول معه، يمكن أن يستمر هذا العلاج حتى لا يستجيب السرطان للعلاج أو حتى الولادة[54]، يمكن أن يحدث انثقاب للرحم أثناء الخرعة البطانية أو توسيع وكشط الرحم[55]، يمكن أن تشمل الآثار الجانبية للجراحة فشل الوظيفة الجنسية والسلس المؤقت ووذمة لمفية إلى جانب الآثار الجانبية لأي عملية جراحية بما في ذلك الإمساك.[8]
العلاج الإضافي
يوجد عدد من العلاجات الإضافية الممكنة، يُمكن أن يَتبع الجراحة العلاج الإشعاعي أو العلاج الكيميائي في حالات زيادة معدل الخطورة أو الإصابة بالسرطانات ذات الدرجة المرتفعة وهو ما يُسمى العلاج المساند.[15]
المعالجة الكيميائية
يُعد العلاج الكيميائي المساند علاجًا مُبتكرًا حديثًا، يتكون من توليفة من باكليتاكسيل (أو تاكسينات أخرى مثل دوسيتاكسيل) ودوكسوروبيسين (والأنثراسيكلين الأخرى) والبلاتينات خاصةً سيسبلاتين وكاربوبلاتين، وقد وُجِد أن العلاج الكيمياوي المساند يُزيد من فرص البقاء على قيد الحياة في المرحلة الثالثة والرابعة من السرطان أكثر من العلاج الإشعاعي[15][19][56]، ويُمكن أن تؤدي طفرات عدم التوافق أثناء إصلاح الجينات –مثل التي تحدث في متلازمة لينش- إلى مقاومة البلاتينات، مما يعني أن العلاج الكيميائي بالبلاتينات يكون غير فعال للأشخاص المصابين بمثل هذه الطفرات[57]، وتكون الآثار الجانبية للعلاج الكيميائي شائعة الحدوث وتشمل فقدان الشعر وانخفاض نسبة الخلايا المتعادلة في الدم بالإضافة إلى مشاكل في المعدة والأمعاء.[15]
يكون العلاج الكيمياوي الملطّف خيارًا موجودًا في الحالات التي لا توصَى بها الجراحة، فيرتبط العلاج الكيمياوي ذو الجرعات الأعلى بالبقاء على قيد الحياة لفترات أطول[15][19]، وغالبًا يتم استخدام العلاج الكيميائي الملطف –خاصةً الذي يستخدم الكابيسيتابين والجيمسيتابين- في علاج سرطان بطانة الرحم المُرتدّ.
المعالجة الإشعاعية

يُستخدم العلاج الإشعاعي المساند بصورة شائعة في حالات سرطان بطانة الرحم ذات المرحلة المبكرة (المرحلة الأولى أو الثانية)، يُمكن أن يتم إيصاله عن طريق المعالجة الكثبية المهبلية -التي تُصبح الوسيلة المفضلة نتيجة لنقص سُمِّيّتها- أو عن طريق العلاج الإشعاعي بحزمة شعاعية خارجية، تشمل المعالجة الكثبية وضع مصدر الإشعاع في العضو المُصاب، ففي حالة سرطان بطانة الرحم يتم وضع مصدر الإشعاع مُباشرةً في المهبل، يشمل العلاج الإشعاعي ذو الحزمة الخارجية حزمة من الإشعاعات تصوَّب إلى المنطقة المصابة من خارج الجسم، وتستخدم المعالجة الكثبية المهبلية لعلاج أي سرطان أخمص متبقي في المهبل، بينما يُمكن أن يُستخدم العلاج الإشعاعي ذو الحزمة الشعاعية الخارجية لعلاج السرطان المتبقي في الحوض بعد الجراحة، ومع ذلك فإن فوائد العلاج الإشعاعي المساند مثيرة للجدل، حيث يقل معدل الانتكاسة في الحوض مع استخدام العلاج الإشعاعي بحزمة خارجية بصورة ملحوظة، لكن لا يتحسن معدل الانبثاثات ومعدل البقاء على قيد الحياة[3]، توفر المعالجة الكثبية المهبلية جودة أفضل للحياة من العلاج الإشعاعي بحزمة خارجية.
يُمكن أن يُستخدم العلاج الإشعاعي أيضًا قبل الجراحة في حالات معينة، فعندما تُظهر صور ما قبل العملية أو التقييم السريري غزو الورم لعنق الرحم يمكن أن يتم إجراء الإشعاع قبل القيام باستئصال الرحم كاملًا[12]، يمكن أن يتم استخدام أيضًا المعالجة الكثبية أو بحزمة خارجية –كلٌ على حدة أو الاثنين معًا- عندما يكون هناك موانع لإجراء استئصال الرحم، وكلتا الوسيلتين للعلاج الإشعاعي يكون لها آثار جانبية تصيب خاصةً القناة الهضمية.[3]
المعالجة الهرمونية
يكون العلاج بالهرمونات مفيدًا فقط في أنواع خاصة من سرطان بطانة الرحم، وقد اعتُقِد ذات مرة أنه مفيد في أغلب الحالات[3][15]، فإذا كان الورم جيد التمايز ولديه مستقبلات للبروجسترون والإستروجين يمكن استخدام البروجستينات كعلاج، حوالي 25% من السرطانات الشبيهة ببطانة الرحم المنبثة تُظهر استجابة للبروجستينات، أيضًا فإن الساركوما السدوية البطانية الرحمية يُمكن أن تُعالج بعوامل هرمونية تشمل تاموكسفين وهيدروكسي بروجستيرون كابروات وليتروزول وأسيتات المجسترول وميدروكسي بروجستيرون[18]، يكون هذا العلاج فعالًا في حالات الساركوما السدوية البطانية الرحمية لانها تشمل مستقبلات للإستروجين والبروجستيرون، تعمل مستقبلات البروجستين كمثبط للورم في خلايا سرطان بطانة الرحم[58]، تُظهر الأبحاث التمهيدية والمحاولات السريرية بأن هذه العلاجات لها استجابة كبيرة حتى في حالات الأمراض المنبثة.
تتبُّع المرض
يرتفع الواصم الورمي CA-125 بصورة متكررة في سرطان بطانة الرحم ويمكن استخدامه لمراقبة الاستجابة للعلاج خاصةً في سرطان الخلايا المصلية أو السرطانات المتقدمة[59]، يمكن أن يُرشح التصوير السينيمائي بالرنين المغناطيسي الدوري أو التصوير المقطعي المحوسب في الأمراض المتقدمة، ويجب على السيدات اللاتي يحملن تاريخ الإصابة بسرطان بطانة الرحم أن يقمن بالفحص الدوري للحوض لمراقبة العلاج لمدة خمس سنوات، حيث يوصى بالفحوصات التي تتم كل ثلاثة لأربعة أشهر وذلك في أول سنتين من تتبع العلاج، وبعد ذلك كل ستة أشهر في الثلاث سنوات التالية.
لا يجب أن تقوم السيدات المصابات بسرطان بطانة الرحم بالتصوير الروتيني لتتبُّع السرطان إذا لم تظهر أعراض جديدة أو تبدأ واصمات الورم بالازدياد، يكون التصوير بدون تلك الدواعي عائقًا لأنه لا يحتمل أن يكتشف انتكاس المرض أو تطور معدل البقاء على قيد الحياة بينما يكلف أموالًا وتكون له آثار جانبية[60]، وإذا تم الارتياب في حدوث انتكاسة فإنه يوصى بالتصوير المقطعي بالإصدار البوزيتروني.
المآل
| المرحلة | معدل البقاء لمدة 5 سنوات |
|---|---|
| المرحلة الأولى (أ) | 88% |
| المرحلة الأولى (ب) | 75% |
| المرحلة الثانية | 69% |
| المرحلة الثالثة (أ) | 58% |
| المرحلة الثالثة (ب) | 50% |
| المرحلة الثالثة (ج) | 47% |
| المرحلة الرابعة (أ) | 17% |
| المرحلة الرابعة (ب) | 15% |
معدلات البقاء على قيد الحياة
يُقدَّر معدل البقاء على قيد الحياة لمدة خمس سنوات لحالات السرطانة الغدية الشبيهة ببطانة الرحم بعد العلاج المناسب بنسبة 80%[62]، أكثر من 70% من السيدات يكون لديهن سرطان المرحلة الأولى الذي له أفضل مآل، بينما يكون لسرطانات المرحلة الثالثة والرابعة مآل أسوأ لكن تكون هذه الأنواع نادرة نسبيًا فتحدث فقط في 13% من الحالات، يصل متوسط البقاء على قيد الحياة لسرطانات بطانة الرحم ذات المرحلة الثالثة والرابعة إلى تسعة أو عشرة أشهر[15][63]، وتُشير الأعمار الأكبر للمصابين إلى مآل أسوأ، في الولايات المتحدة يكون للنساء البيضاوات معلات أكبر للبقاء عن النساء السوداوات اللاتي يتطور لديهم أشكال أكثر عدوانية للمرض[18]، يكون للأورام التي لديها تعصير عالٍ لمستقبلات البروجستيرون مآل جيد مقارنةً بالأورام التي لديها تعصير ضئيل لمستقبلات البروجستيرون، يُعد السبب الأكثر شيوعًا لوفاة المصابين بسرطان بطانة الرحم هو مرض القلب[64] بالإضافة إلى المشاكل الأخرى المتعلقة بالبدانة[65]، لذلك فبعد التشخيص يرتبط تحسين جودة الحياة بنظام حياة صحي (بدون بدانة وبنشاط فيزيائي ونظام غذائي سليم).[66]
معدلات الرجعة
معدلات الرجعة لسرطان بطانة الرحم ذي المرحلة المبكرة تتراوح بين 3 ل 17% بناءً على العلاج الأولي والمساند[62]، أغلب الانتكاسات (75-80%) تحدث خارج الحوض وغالبًا ما تحدث بعد سنتين لثلاث سنوات من العلاج (حوالي 64% من الحالات تحدث بعد سنتين و87% من الحالات تحدث بعد ثلاث سنوات).[67]
السرطانات ذات المراحل المتأخرة يُحتمل رجوعها كثيرًا كتلك التي قد اخترقت عضل الرحم أو عنق الرحم أو التي انبثت في الجهاز اللمفي، وتُعد كل من السرطانة المصلية اللحمية وسرطانة الخلايا الصافية والسرطانة الشبيهة ببطانة الرحم أنواعًا فرعيةً لها أكبر خطورة للرجعة[19]، أيضًا يكون للأنواع الفرعية ذات الدرجات المتقدمة مخاطر مرتفعة للرجعة.[14]
أكثر الأماكن شيوعًا لحدوث الرجعة هو المهبل[3]، انتكاسات سرطان بطانة الرحم التي تحدث في المهبل يكون لها أفضل مآل، فإذا حدث الانتكاس لسرطان لم يتم علاجه بالإشعاع يكون العلاج الإشعاعي ذو الحزمة الخارجية هو الخط الأول للعلاج وغالبًا ما ينجح، بينما إذا حدث انتكاس لسرطان قد تم علاجه بالإشعاع فيكون الخيار الوحيد المتاح كعلاج وقائي هو اجتثاث الحوض، كما يمكن القيام بالعلاج الكيميائي البدائي وجراحة الاختزال الخلوي والإشعاع[68]، ومع علاج رجعة المهبل المكانية بالإشعاع يصل معدل البقاء لمدة خمس سنوات إلى 50%، يتم علاج رجعة السرطان في الحوض بالجراحة والإشعاع، بينما يتم علاج رجعة السرطان في البطن بالإشعاع والعلاج الكيميائي إن أمكن، ومن أماكن الرجعة الشائعة الأخرى: العقد الليمفاوية بالحوض والعقد الليمفاوية المجاورة للأبهر والصفاق (28% من حالات الانتكاس) والرئتين، ويمكن أن تحدث الرجعة أيضًا في الدماغ (أقل من 1%) والكبد (7%) والغدد الكظرية (1%) والعظام (4-7% خاصةً في الهيكل العظمي المحوري) والعقد الليمفاوية الواقعة خارج البطن (0.4-1%) والطحال والعضلات (2-6%).[67]
الوبائيات
اعتبارًا من عام 2014 يتم تشخيص حوالي 320.000 سيدة عالميًا بمرض سرطان بطانة الرحم كل عام، 76.000 منهن يمتن مما يجعل هذا المرض سادس أكثر الأمراض شيوعًا لدى النساء[2]، ويُعد أكثر شيوعًا في الدول المتقدمة حيث يبلغ خطر الإصابة بسرطان بطانة الرحم عند الأشخاص الذين يولدون بالرحم 1.6% مقارنةً ب0.6% في الدول النامية[15]، فهو يصيب 12.9 كل 100.000 سيدة سنويًا في الدول المتقدمة.[19]
أكثر أنواع السرطان التي تُصيب السيدات اللاتي يتم تشخيص حالاتهن في الولايات المتحدة يكون سرطان بطانة الرحم، فيكون رابع السرطانات شيوعًا عند السيدات[18] حيثُ يشكِّل 6% من كل حالات السرطان التي تحدث لهن[69]، اعتبارًا من عام 2014 بالولايات المتحدة تم تقدير حوالي 52.630 سيدة تُشخَّص سنويًا بالمرض وحوالي 8.590 منهن يمتن بسببه[70]، أكبر معدلات الإصابة بهذا المرض تكون في شمال وشرق أوروبا وشمال أفريقيا، بينما أقل معدلات الإصابة بالمرض تكون في أفريقيا وغرب آسيا، ففي عام 2012 تم تشخيص 41% من حالات سرطان بطانة الرحم في آسيا فقط، بينما تم تشخيص 48% من الحالات في شمال وشرق أوروبا وشمال أفريقيا معًا[2]، وعلى عكس أغلب أنواع السرطان فقد زاد عدد حالات سرطان بطانة الرحم في السنوات الأخيرة مما في ذلك زيادة نسبة الحالات حوالي 40% في المملكة المتحدة من عام 1993 حتى عام 2013 [15]، بعض من هذه الزيادة ربما تكون بسبب الزيادة في معدلات البدانة[19] وتوقعات الحياة وقلة معدل المواليد في الدول المتقدمة، يقدر متوسط خطر الإصابة بسرطان بطانة الرحم حوالي 2-3%[17]، ويتم تشخيص سنويًا حوالي 7.400 حالة في المملكة المتحدة وحوالي 88.000 حالة في الاتحاد الأوروبي.[71]
يظهر سرطان بطانة الرحم بصورة أكثر تكرارًا أثناء فترة ما حول الإياس (الفترة التي تسبق أو تلي الإياس أو فترة الإياس نفسها) بين عمر 50-65 عام[18]، حوالي 75% من حالات سرطان بطانة الرحم تحدث بعد سن اليأس[3]، بينما 5% من الحالات تصيب السيدات اللاتي تقل أعمارهن عن 40، و10-15% من الحالات تصيب السيدات اللاتي تقل أعمارهن عن 50، هذه المجموعات العمرية تكون معرضة لتطور سرطان المبيض في نفس الوقت[18]، متوسط العمر العالمي للحالات التي يتم تشخيصها بسرطان بطانة الرحم هو 63 عام، لكن في الولايات المتحدة يكون متوسط عمر الحالات 60 عامًا، تُعاني المرأة الأمريكية البيضاء من خطورة أكبر للإصابة بسرطان بطانة الرحم من المرأة الأمريكية السوداء حيث يبلغ معدل الخطورة عند كل منهما 2.88% و1.69% على التوالي، المرأة الأمريكية-اليابانية تحمل معدلات خطورة أقل بينما تحمل المرأة التي أصلها من هواوي معدلات أعلى.
البحث
يوجد العديد من العلاجات التجريبية لسرطان بطانة الرحم قيد البحث، ويشمل ذلك العلاج المناعي والهرموني والكيميائي، ويُستخدم التراستوزوماب (الهيرسبتين) –جسم مضاد لبروتين Her2– في السرطانات التي تكون إيجابية للجين الورمي Her2/neu لكن ما زال البحث مستمرًا، تكون العلاجات المناعية أيضًا تحت الفحص خاصةً في السرطانة المصلية الحلمية الرحمية.
يُمكن أن تُحلل السرطانات باستخدام التقنيات الجينية (ويشمل هذا تتابع DNA والكيمياء النسيجية المناعية) لتحديد إذا كان يُمكن استخدام علاجات معينة مخصصة لجينات متحورة لعلاجها، تُستخدم مثبطات PARP لعلاج سرطان بطانة الرحم ذي طفرات PTEN[2] خاصة الطفرات التي يقل بها تمثيل PTEN، المثبط الذي يكون نشطًا ضد سرطان بطانة الرحم هو «أولاباريب»، لا يزال البحث مستمرًا في هذا المجال اعتبارًا من 2010.[21][72][73]
ما زالت الأبحاث مستمرة حول استخدام الميتفورمين (علاج السكر) للسيدات البدينات المصابات بسرطان بطانة الرحم قبل الجراحة، وقد أظهرت البحوث المبكرة أنه فعال في إبطاء معدل تكاثر الخلايا السرطانية[74]، وقد أظهر البحث التمهيدي أن جرعة الميتفورين قبل العملية يمكن أن تُقلل تعصير الأوسمة الورمية، لم يظهر أن الاستخدام طويل الأجل للميتفورين له تأثير وقائي ضد تطور السرطان ولكن من الممكن أن يُحسِّن من معدل بقاء المصابات على قيد الحياة.[75]
يُجرى البحث على تيمزيروليموس –مثبط mTOR- كعلاج مُحتمل، وتُظهر الأبحاث أن مثبطات mTOR يُمكن أن تكون فعالة خاصة للسرطانات التي تحمل طفرات في PTEN[2]، كما يجرى البحث على ريدافورليموس (ديفورليمس) كعلاج لمن سبق له العلاج الكيميائي، قد أصبح البحث الأولي واعدًا ومحاولة المرحلة الثانية لريدافورليمس تم الانتهاء منها قبل عام 2013، وقد أُجرى البحث على علاجات البروجستين/الريدافورليمس المختلطة لسرطان بطانة الرحم الناكس، كما يُجرى البحث على مثبطات التيروسين كيناز وبيفاسيزوماب –التي تثبط تولد الأوعية الدموية- كعلاج محتمل لسرطان بطانة الرحم ذي المستويات المرتفعة من عامل النمو البطاني الوعائي[2]، ويُجرى البحث على إكسابيبيلون كعلاج كيميائي محتمل لسرطان بطانة الرحم الناكس أو المتقدم؛ كما يجرى البحث على علاجات للساركومة البطانية الرحمية اللامتمايزة ذات الدرجة العالية النادرة ذلك لأنه لا يوجد مستوى محدد من الرعاية لهذا المرض حتى الآن، بالإضافة إلى أنه يُجرى البحث على العلاجات الكيميائية بما يشمل الدوكسوروبيسين والإيفوسفامايد.
تتطور أيضًا الأبحاث في أغلب الجينات والأوسمة الحيوية التي يُمكن أن ترتبط بسرطان بطانة الرحم، ويتم فحص التأثير الواقي لموانع الحمل الفموية المركبة واللولب. وقد أظهرت الأبحاث البدائية أن لولب ليفونورغيستريل الذي يوضع لمدة عام مع الحقن لمدة ستة أشهر بهرمونات مطلقة لموجهة الغدد التناسلية يمكن أن يوقف تقدم سرطان بطانة الرحم لدى السيدات صغيرات السن[76]، كما أن العقار التجريبي الذي يربط هرمونًا بدوكسوروبيسين هو أيضًا قيد الفحص للحصول على كفاءة أكبر في السرطانات التي تحمل مستقبلات للهرمونات، العلاج الهرموني الذي يكون مؤثرًا في علاج سرطان الثدي –ويشمل استخدام مثبطات أروماتاز- هو أيضًا قيد الفحص لاستخدامه لعلاج سرطان بطانة الرحم، من هذه العقارات عقار «أناستروزول» الذي يُجرى البحث عليه حاليًا لاستخدامه في الانتكاسات الإيجابية الاستجابة للهرمونات بعد العلاج الكيميائي[77]، كما أنه ما زال البحث في علاجات هرمونية للساركومة الحلمية البطانية الرحمية مستمرًا، وهو يشمل المحاولات التي تُجرى على عقارات مثل ميفيبريستون -مضاد بروجستين- وأمينوغلوتيثيميد ويتروزول –مثبطا أروماتاز-.
لا تزال الأبحاث على أفضل وسيلة تصوير لاكتشاف وتصنيف سرطان بطانة الرحم مستمرة؛ وقد أظهر البحث أن الاستئصال الكامل للعقد الليمفاوية الحوضية جراحيًا مع استئصال الرحم في المرحلة الأولى لسرطان بطانة الرحم لا يُحسن معدل البقاء على قيد الحياة بينما يزيد من خطورة الآثار الجانبية السلبية بما في ذلك الأوديما اللمفية. تكشف أبحاث أخرى احتمالية تحديد العقد الليمفاوية الخفيرة للخزعة عن طريق حقن الورم بصبغة تضيء أسفل الأشعة تحت الحمراء، يُعد العلاج بالإشعاع المعدَّلة شدته قيد الاختبار وهو يُستخدم بالفعل في بعض المراكز في حالات سرطان بطانة الرحم لتقليل الآثار الجانبية للعلاج الإشعاعي التقليدي، وبذلك لم تعد خطورة الانتكاسة تقدَّر كميًّا، وتستمر الأبحاث على العلاج بالأكسجين عالي الضغط لتقليل الآثار الجانبية.
لا يوجد دليل كافٍ لتحديد إذا كانت المصابات بسرطان بطانة الرحم يستفدن من المزيد من التدخلات السلوكية ونمط الحياة الذي يهدف إلى فقدان المزيد من الوزن.[78]
التاريخ والثقافة
لا يُعرف سرطان بطانة الرحم بصورة شائعة عند العامة على الرغم من تكرار حدوثه، حيث يوجد معرفة ضئيلة بأعراضه مما يؤدي إلى تشخيصه في وقت متأخر وبالتالي يسوء معدل بقاء المصابات.[79]
المراجع
- ^ أ ب ت ث ج ح خ د ذ "General Information About Endometrial Cancer". National Cancer Institute. 22 أبريل 2014. مؤرشف من الأصل في 3 سبتمبر 2014. اطلع عليه بتاريخ 3 سبتمبر 2014.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك International Agency for Research on Cancer (2014). World Cancer Report 2014. منظمة الصحة العالمية. Chapter 5.12. ISBN:978-92-832-0429-9.
- ^ أ ب ت ث ج ح خ د ذ ر Kong، A؛ Johnson، N؛ Kitchener، HC؛ Lawrie، TA (18 أبريل 2012). "Adjuvant radiotherapy for stage I endometrial cancer". The Cochrane Database of Systematic Reviews. ج. 4: CD003916. DOI:10.1002/14651858.CD003916.pub4. PMC:4164955. PMID:22513918.
- ^ أ ب "SEER Stat Fact Sheets: Endometrial Cancer". المعهد الوطني للسرطان. مؤرشف من الأصل في 6 يوليو 2014. اطلع عليه بتاريخ 18 يونيو 2014.
- ^ GBD 2015 Disease and Injury Incidence and Prevalence، Collaborators. (8 أكتوبر 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. ج. 388 ع. 10053: 1545–1602. DOI:10.1016/S0140-6736(16)31678-6. PMC:5055577. PMID:27733282.
{{استشهاد بدورية محكمة}}:|مؤلف1-الأول=باسم عام (مساعدة) - ^ GBD 2015 Mortality and Causes of Death، Collaborators. (8 أكتوبر 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. ج. 388 ع. 10053: 1459–1544. DOI:10.1016/s0140-6736(16)31012-1. PMC:5388903. PMID:27733281.
{{استشهاد بدورية محكمة}}:|مؤلف1-الأول=باسم عام (مساعدة) - ^ "Defining Cancer". National Cancer Institute. مؤرشف من الأصل في 25 يونيو 2014. اطلع عليه بتاريخ 10 يونيو 2014.
- ^ أ ب ت ث ج ح خ د ذ "What You Need To Know: Endometrial Cancer". NCI. National Cancer Institute. مؤرشف من الأصل في 8 أغسطس 2014. اطلع عليه بتاريخ 6 أغسطس 2014.
- ^ "Endometrial Cancer Treatment (PDQ®)". National Cancer Institute. 23 أبريل 2014. مؤرشف من الأصل في 3 سبتمبر 2014. اطلع عليه بتاريخ 3 سبتمبر 2014.
- ^ أ ب ت ث ج ح خ د ذ ر Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 823. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 817. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ أ ب ت Reynolds RK، Loar PV (2010). "Gynecology". Current Diagnosis & Treatment: Surgery (ط. 13th). ماكجرو هيل التعليم. ISBN:978-0-07-163515-8.
- ^ Clarke MA، Long BJ، Del Mar Morillo A، Arbyn M، Bakkum-Gamez JN، Wentzensen N (سبتمبر 2018). "Association of Endometrial Cancer Risk With Postmenopausal Bleeding in Women: A Systematic Review and Meta-analysis". JAMA Internal Medicine. ج. 178 ع. 9: 1210–1222. DOI:10.1001/jamainternmed.2018.2820. PMC:6142981. PMID:30083701.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش Saso S، Chatterjee J، Georgiou E، Ditri AM، Smith JR، Ghaem-Maghami S (يوليو 2011). "Endometrial cancer". BMJ. ج. 343: d3954. DOI:10.1136/bmj.d3954. PMID:21734165.
- ^ أ ب ت ث ج ح خ د ذ ر ز س Galaal، K؛ Al Moundhri، M؛ Bryant، A؛ Lopes، AD؛ Lawrie، TA (15 مايو 2014). "Adjuvant chemotherapy for advanced endometrial cancer". The Cochrane Database of Systematic Reviews. ج. 5: CD010681. DOI:10.1002/14651858.CD010681.pub2. PMID:24832785.
- ^ Hoffman، BL؛ Schorge، JO؛ Schaffer، JI؛ Halvorson، LM؛ Bradshaw، KD؛ Cunningham، FG، المحررون (2012). "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. ص. 818. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 4 يناير 2014.
- ^ أ ب ت ث ج ح Ma، J؛ Ledbetter، N؛ Glenn، L (2013). "Testing women with endometrial cancer for lynch syndrome: should we test all?". Journal of the Advanced Practitioner in Oncology. ج. 4 ع. 5: 322–30. PMC:4093445. PMID:25032011.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش Soliman PT، Lu KH (2013). "Neoplastic Diseases of the Uterus". Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ أ ب ت ث ج ح خ د ذ Vale، CL؛ Tierney، J؛ Bull، SJ؛ Symonds، PR (15 أغسطس 2012). "Chemotherapy for advanced, recurrent or metastatic endometrial carcinoma". The Cochrane Database of Systematic Reviews. ج. 8: CD003915. DOI:10.1002/14651858.CD003915.pub4. PMID:22895938.
- ^ Committee on Health Care for Underserved Women (ديسمبر 2011). "Health Care for Transgender Individuals: Committee Opinion No. 512". Obstetrics and Gynecology. American Committee for Obstetrics and Gynecology. ص. 1454–1458. DOI:10.1097/aog.0b013e31823ed1c1. PMID:22105293. مؤرشف من الأصل في 16 ديسمبر 2014.
- ^ أ ب Reinbolt RE، Hays JL (أكتوبر 2013). "The Role of PARP Inhibitors in the Treatment of Gynecologic Malignancies". Frontiers in Oncology. ج. 3: 237. DOI:10.3389/fonc.2013.00237. PMC:3787651. PMID:24098868.
- ^ Cheng TH, Thompson DJ, O'Mara TA, Painter JN, Glubb DM, Flach S, et al. (Jun 2016). "Five endometrial cancer risk loci identified through genome-wide association analysis". Nature Genetics (بEnglish). 48 (6): 667–674. DOI:10.1038/ng.3562. PMC:4907351. PMID:27135401.
- ^ أ ب O'Mara TA, Glubb DM, Amant F, Annibali D, Ashton K, Attia J, et al. (Aug 2018). "Identification of nine new susceptibility loci for endometrial cancer". Nature Communications (بEnglish). 9 (1): 3166. Bibcode:2018NatCo...9.3166O. DOI:10.1038/s41467-018-05427-7. PMC:6085317. PMID:30093612.
- ^ Staley، H؛ McCallum، I؛ Bruce، J (17 أكتوبر 2012). "Postoperative tamoxifen for ductal carcinoma in situ". The Cochrane Database of Systematic Reviews. ج. 10: CD007847. DOI:10.1002/14651858.CD007847.pub2. PMID:23076938.
There is evidence from other reports that tamoxifen increases the risk of endometrial cancer although the data presented in this review describes only 10 events occurring in 1798 participants (0.5%) after seven years of follow-up.
- ^ Coleman، RL؛ Ramirez، PT؛ Gershenson، DM (2013). "Neoplastic Diseases of the Ovary". في Lentz، GM؛ Lobo، RA؛ Gershenson، DM؛ Katz، VL (المحررون). Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Biswas A، Oh PI، Faulkner GE، Bajaj RR، Silver MA، Mitchell MS، Alter DA (2015). "Sedentary Time and Its Association With Risk for Disease Incidence, Mortality, and Hospitalization in Adults: A Systematic Review and Meta-analysis". Annals of Internal Medicine. ج. 162 ع. 2: 123–32. DOI:10.7326/M14-1651. PMID:25599350.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 819. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ "Endometrial Cancer Prevention". PDQ. NIH. 28 فبراير 2014. مؤرشف من الأصل في 5 يناير 2015.
- ^ Thaker PH، Sood AK (1 يناير 2012). "Molecular Oncology in Gynecologic Cancer". Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Mani RS (سبتمبر 2014). "The emerging role of speckle-type POZ protein (SPOP) in cancer development". Drug Discovery Today. ج. 19 ع. 9: 1498–502. DOI:10.1016/j.drudis.2014.07.009. PMC:4237012. PMID:25058385.
A recent exome-sequencing study revealed that 8% of serious endometrial cancers and 9% of clear cell endometrial cancers have SPOP mutations
- ^ Luo L، Luo B، Zheng Y، Zhang H، Li J، Sidell N (يونيو 2013). "Levonorgestrel-releasing intrauterine system for atypical endometrial hyperplasia". The Cochrane Database of Systematic Reviews. ج. 6 ع. 6: CD009458. DOI:10.1002/14651858.CD009458.pub2. PMID:23737032.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 820. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ كيف يتم التوصل إلى تشخيص سرطان الرحم؟ نسخة محفوظة 17 ديسمبر 2019 على موقع واي باك مشين.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 821. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 824. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ أ ب Murali R، Soslow RA، Weigelt B (يونيو 2014). "Classification of endometrial carcinoma: more than two types". The Lancet. Oncology. ج. 15 ع. 7: e268–78. DOI:10.1016/S1470-2045(13)70591-6. PMID:24872110.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 826. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 827. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ أ ب Colombo N، Preti E، Landoni F، Carinelli S، Colombo A، Marini C، Sessa C (سبتمبر 2011). "Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 22 Suppl 6 ع. Supplement 6: vi35–9. DOI:10.1093/annonc/mdr374. PMID:21908501.
- ^ أ ب Johnson N، Bryant A، Miles T، Hogberg T، Cornes P (أكتوبر 2011). "Adjuvant chemotherapy for endometrial cancer after hysterectomy". The Cochrane Database of Systematic Reviews ع. 10: CD003175. DOI:10.1002/14651858.CD003175.pub2. PMC:4164379. PMID:21975736.
- ^ Goodrich S، Kebria-Moslemi M، Broshears J، Sutton GP، Rose P (سبتمبر 2013). "Primary squamous cell carcinoma of the endometrium: two cases and a review of the literature". Diagnostic Cytopathology. ج. 41 ع. 9: 817–20. DOI:10.1002/dc.22814. PMID:22241749.
- ^ Mariño-Enríquez A، González-Rocha T، Burgos E، Stolnicu S، Mendiola M، Nogales FF، Hardisson D (نوفمبر 2008). et al. "Transitional cell carcinoma of the endometrium and endometrial carcinoma with transitional cell differentiation: a clinicopathologic study of 5 cases and review of the literature". Human Pathology. ج. 39 ع. 11: 1606–13. DOI:10.1016/j.humpath.2008.03.005. PMID:18620731.
- ^ Ahluwalia M، Light AM، Surampudi K، Finn CB (أكتوبر 2006). "Transitional cell carcinoma of the endometrium: a case report and review of the literature". International Journal of Gynecological Pathology. ج. 25 ع. 4: 378–82. DOI:10.1097/01.pgp.0000215296.53361.4b. PMID:16990716.
- ^ Sylvestre VT، Dunton CJ (أبريل 2010). "Treatment of recurrent endometrial stromal sarcoma with letrozole: a case report and literature review". Hormones & Cancer. ج. 1 ع. 2: 112–5. DOI:10.1007/s12672-010-0007-9. PMID:21761354.
- ^ Hensley ML (2012). "Uterine sarcomas: histology and its implications on therapy". American Society of Clinical Oncology Educational Book. American Society of Clinical Oncology. Annual Meeting: 356–61. DOI:10.14694/EdBook_AM.2012.32.7 (غير نشط 5 يوليو 2019). PMID:24451763.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: وصلة دوي غير نشطة منذ 2019 (link) - ^ D'Angelo E، Prat J (يناير 2010). "Uterine sarcomas: a review". Gynecologic Oncology. ج. 116 ع. 1: 131–9. DOI:10.1016/j.ygyno.2009.09.023. PMID:19853898.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 828. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ Typical and atypical metastatic sites of recurrent endometrial carcinoma نسخة محفوظة 17 ديسمبر 2019 على موقع واي باك مشين.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 825. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ Modern Surgical Pathology (2 Volume Set). 2002. ISBN:978-0-7216-7253-3.
- ^ "Stage Information for Endometrial Cancer". المعهد الوطني للسرطان. يناير 1980. مؤرشف من الأصل في 2014-04-06. اطلع عليه بتاريخ 2014-04-23.
- ^ Galaal K، Bryant A، Fisher AD، Al-Khaduri M، Kew F، Lopes AD (سبتمبر 2012). "Laparoscopy versus laparotomy for the management of early stage endometrial cancer". The Cochrane Database of Systematic Reviews. ج. 9 ع. 9: CD006655. DOI:10.1002/14651858.CD006655.pub2. PMID:22972096.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 829. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 833. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ McGee J، Covens A (2013). "Gestational Trophoblastic Disease". Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Smith JA، Jhingran A (2013). "Principles of Radiation Therapy and Chemotherapy in Gynecologic Cancer". Comprehensive Gynecology (ط. 6th). Mosby. ISBN:978-0-323-06986-1.
- ^ Guillotin D، Martin SA (نوفمبر 2014). "Exploiting DNA mismatch repair deficiency as a therapeutic strategy". Experimental Cell Research. ج. 329 ع. 1: 110–5. DOI:10.1016/j.yexcr.2014.07.004. PMID:25017099.
- ^ Patel B، Elguero S، Thakore S، Dahoud W، Bedaiwy M، Mesiano S (2014). "Role of nuclear progesterone receptor isoforms in uterine pathophysiology". Human Reproduction Update. ج. 21 ع. 2: 155–73. DOI:10.1093/humupd/dmu056. PMC:4366574. PMID:25406186.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 831. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ "Five Things Physicians and Patients Should Question". اختر بحكمة. Society of Gynecologic Oncology. 31 أكتوبر 2013. مؤرشف من الأصل في 2013-12-01. اطلع عليه بتاريخ 2014-07-27.
- ^ "Survival by stage of endometrial cancer". جمعية السرطان الأمريكية. 2 مارس 2014. مؤرشف من الأصل في 2014-07-31. اطلع عليه بتاريخ 2014-06-10.
- ^ أ ب Nicolaije KA، Ezendam NP، Vos MC، Boll D، Pijnenborg JM، Kruitwagen RF، Lybeert ML، van de Poll-Franse LV (مايو 2013). "Follow-up practice in endometrial cancer and the association with patient and hospital characteristics: a study from the population-based PROFILES registry". Gynecologic Oncology. ج. 129 ع. 2: 324–31. DOI:10.1016/j.ygyno.2013.02.018. PMID:23435365.
- ^ Ang C، Bryant A، Barton DP، Pomel C، Naik R (فبراير 2014). "Exenterative surgery for recurrent gynaecological malignancies". The Cochrane Database of Systematic Reviews. ج. 2 ع. 2: CD010449. DOI:10.1002/14651858.CD010449.pub2. PMID:24497188.
- ^ Ward KK، Shah NR، Saenz CC، McHale MT، Alvarez EA، Plaxe SC (أغسطس 2012). "Cardiovascular disease is the leading cause of death among endometrial cancer patients". Gynecologic Oncology. ج. 126 ع. 2: 176–9. DOI:10.1016/j.ygyno.2012.04.013. PMID:22507532.
- ^ Fader AN، Arriba LN، Frasure HE، von Gruenigen VE (يوليو 2009). "Endometrial cancer and obesity: epidemiology, biomarkers, prevention and survivorship". Gynecologic Oncology. ج. 114 ع. 1: 121–7. DOI:10.1016/j.ygyno.2009.03.039. PMID:19406460.
- ^ Koutoukidis DA، Knobf MT، Lanceley A (يونيو 2015). "Obesity, diet, physical activity, and health-related quality of life in endometrial cancer survivors". Nutrition Reviews. ج. 73 ع. 6: 399–408. DOI:10.1093/nutrit/nuu063. PMC:4477700. PMID:26011914.
- ^ أ ب Kurra V، Krajewski KM، Jagannathan J، Giardino A، Berlin S، Ramaiya N (مارس 2013). "Typical and atypical metastatic sites of recurrent endometrial carcinoma". Cancer Imaging. ج. 13: 113–22. DOI:10.1102/1470-7330.2013.0011. PMC:3613792. PMID:23545091.
- ^ "Endometrial Cancer". Williams Gynecology (ط. 2nd). ماكجرو هيل التعليم. 2012. ص. 834. ISBN:978-0-07-171672-7. مؤرشف من الأصل في 2014-01-04.
- ^ "General Information about Endometrial Cancer". Endometrial Cancer Treatment (PDQ). NIH. 23 أبريل 2014. مؤرشف من الأصل في 20 يونيو 2014.
- ^ Burke WM، Orr J، Leitao M، Salom E، Gehrig P، Olawaiye AB، Brewer M، Boruta D، Villella J، Villella J، Herzog T، Abu Shahin F (أغسطس 2014). "Endometrial cancer: a review and current management strategies: part I". Gynecologic Oncology. ج. 134 ع. 2: 385–92. DOI:10.1016/j.ygyno.2014.05.018. PMID:24905773.
- ^ Colombo N، Preti E، Landoni F، Carinelli S، Colombo A، Marini C، Sessa C (أكتوبر 2013). "Endometrial cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up". Annals of Oncology. 24 Suppl 6: vi33–8. DOI:10.1093/annonc/mdt353. PMID:24078661.
- ^ Lee JM، Ledermann JA، Kohn EC (يناير 2014). "PARP Inhibitors for BRCA1/2 mutation-associated and BRCA-like malignancies". Annals of Oncology. ج. 25 ع. 1: 32–40. DOI:10.1093/annonc/mdt384. PMC:3868320. PMID:24225019.
- ^ Banerjee S، Kaye S (ديسمبر 2011). "PARP inhibitors in BRCA gene-mutated ovarian cancer and beyond". Current Oncology Reports. ج. 13 ع. 6: 442–9. DOI:10.1007/s11912-011-0193-9. PMID:21913063.
- ^ Suh DH، Kim JW، Kang S، Kim HJ، Lee KH (يوليو 2014). "Major clinical research advances in gynecologic cancer in 2013". Journal of Gynecologic Oncology. ج. 25 ع. 3: 236–48. DOI:10.3802/jgo.2014.25.3.236. PMC:4102743. PMID:25045437.
- ^ Sivalingam VN، Myers J، Nicholas S، Balen AH، Crosbie EJ (2014). "Metformin in reproductive health, pregnancy and gynaecological cancer: established and emerging indications". Human Reproduction Update. ج. 20 ع. 6: 853–68. DOI:10.1093/humupd/dmu037. PMID:25013215.
- ^ Minig L، Franchi D، Boveri S، Casadio C، Bocciolone L، Sideri M (مارس 2011). "Progestin intrauterine device and GnRH analogue for uterus-sparing treatment of endometrial precancers and well-differentiated early endometrial carcinoma in young women". Annals of Oncology. ج. 22 ع. 3: 643–9. DOI:10.1093/annonc/mdq463. PMID:20876910.
- ^ "Womb cancer research". CancerHelp UK. Cancer Research UK. مؤرشف من الأصل في 2014-08-22. اطلع عليه بتاريخ 2014-08-31.
- ^ Kitson، Sarah؛ Ryan، Neil؛ MacKintosh، Michelle L.؛ Edmondson، Richard؛ Duffy، James Mn؛ Crosbie، Emma J. (فبراير 2018). "Interventions for weight reduction in obesity to improve survival in women with endometrial cancer". The Cochrane Database of Systematic Reviews. ج. 2: CD012513. DOI:10.1002/14651858.CD012513.pub2. ISSN:1469-493X. PMID:29388687. مؤرشف من الأصل في 2019-08-08.
- ^ Carlisle، Daloni (21 سبتمبر 2014). "Womb cancer: the most common diagnosis you've never heard of". The Guardian. مؤرشف من الأصل في 22 سبتمبر 2014. اطلع عليه بتاريخ 29 سبتمبر 2014.
وصلات خارجية
- دليل مفصل من جمعية السرطان الأمريكية حول سرطان بطانة الرحم
- المعهد القومي الأمريكي للسرطان: سرطان بطانة الرحم
- صور علم الأمراض التشريحي
| في كومنز صور وملفات عن: سرطان بطانة الرحم |